不同临床指标在不同病因HCC患者中的变化差异及预后意义*
曹艳平,隋洪婷,潘 猛,曲宝聚,朴红心(延边大学附属医院,吉林延吉133000)
肝癌(HCC)是我国常见的恶性肿瘤之一,已跃居世界恶性肿瘤致死病因第2位[1]。中国每年约有38.3万人病死于 HCC,约占全球的 51%[2]。乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)感染是引起HCC的主要危险因素之一[3],与由2种肝炎病毒所引起的持续活动性肝炎和肝纤维化密切相关[4]。从《2015中国肿瘤登记年报》的中国癌症分布情况结果显示,处于东南沿海及东北地区是全国HCC的高发地区,其中吉林省延边州发病率位居吉林省丙型肝炎发病率的首位,且明显高于全国同期发病率[5]。本文回顾性分析延边地区HBV、HCV不同病毒感染及非病毒感染HCC患者的临床实验指标,以探讨其在HBV和HCV感染相关性HCC中的变化差异及预后价值,为临床治疗提供依据。
1 资料与方法
1.1 一般资料 回顾性分析延边大学附属医院电子病历信息系统,检索2000—2016年本院收治的原发性HCC患者3 767例,按照《原发性肝癌诊疗规范(2011年版)》及排除合并人类免疫获得性病毒(HIV)等其他病毒感染、伴酒精性及脂肪性肝病、糖尿病、白血病及伴有其他恶性肿瘤患者,本研究共纳入2 634例,其中HBV-HCC组 1 099例,HCV-HCC组 1 170例,HBV∕HCV-HCC组 130例,非病毒感染 HCC(UV-HCC)组235例。
1.2 方法 收集所有患者的性别、年龄、血小板(PLT)、血红蛋白(Hb)、凝血酶原时间(PT)、国际标准化比值(INR)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、清蛋白(ALB)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、尿素氮(BUN)、肌酐(CREA)、空腹血糖(GLU)指标数据。所有指标检测均严格按照试剂盒说明书进行操作。Hb指标检测使用希森美康XE-2100全自动血液分析仪;PT、INR指标检测使用法国STAGO全自动血凝仪;ALT、AST、ALB、GGT、TBIL、BUN、CRE、GLU 指标检测使用罗氏分析仪CobasE702。
1.3 统计学处理 应用SPSS22.0统计软件进行数据分析,方差齐性检验采用Levence法;相关性分析采用Spearman等级相关分析;计量资料以或中位数表示,非正态分布资料多组间均数比较采用Kruskal-WallisH法检验,多组均数间的两两比较采用Nemenyi法,计数资料以率或构成比表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组患者的一般资料情况 四组PLT、Hb、PT、INR、AST、ALT、ALB、GGT、TBIL 指标比较,差异均有统计学意义(P<0.01);而四组 BUN、CREA 水平比较,差异均无统计学意义(P>0.05)。见表1。
2.2 四组各指标多重比较 多重比较显示,PLT水平在UV-HCC组均高于HBV-HCC组、HCV-HCC组及HBV∕HCV-HCC 组,差异均有统计学意义(P<0.01);HBV-HCC组高于HCV-HCC组,差异有统计学意义(P<0.01);其余组间比较,差异均无统计学意义(P>0.05)(图1A)。Hb水平在 HBV-HCC组中显著高于HCV-HCC组及UV-HCC组,差异均有统计学意义(P<0.01);其余组间比较,差异均无统计学意义(P>0.05)(图1B)。HBV-HCC 组、HCV-HCC 组及 HBV∕HCV-HCC组PT、INR、ALT水平均高于UV-HCC组,差异均有统计学意义(P<0.01);其余组间比较,差异均无统计学意义(P>0.05)(图1C、D、F)。HBV-HCC 组 AST 水平高于UV-HCC 组,差异有统计学意义(P<0.01)(图1E)。HCV-HCC组ALB、GGT水平均低于HBV-HCC组、UV-HCC组,差异均有统计学意义(P<0.01);其余组间比较,差异均无统计学意义(P>0.05)(图1G、H)。UV-HCC 组TBIL水平较HBV-HCC组、HCV-HCC组均降低,差异均有统计学意义(P<0.01);其余组间比较,差异均无统计学意义(P>0.05)(图1I)。HCV-HCC 组 GLU 水平高于 HBV-HCC组,差异有统计学意义(P<0.01);其余组间比较,差异均无统计学意义(P>0.05),见图1J。
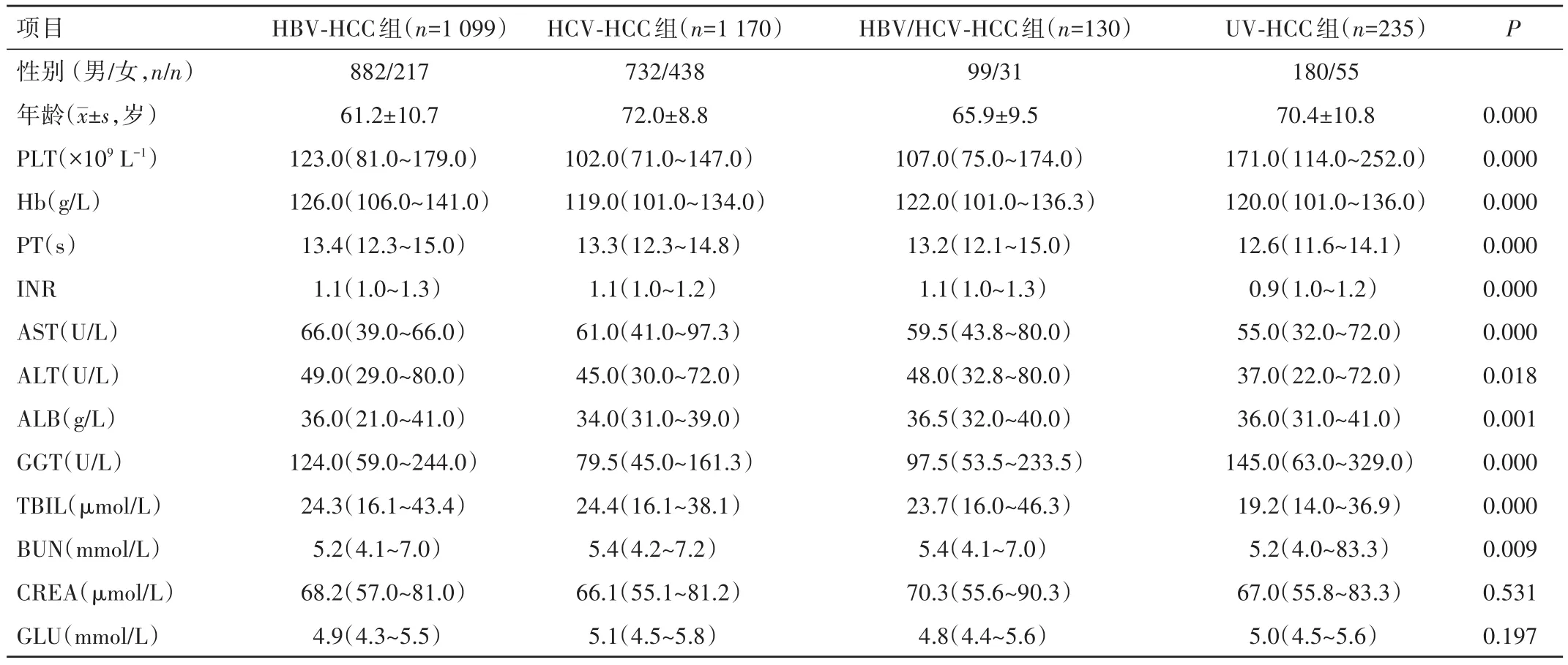
表1 四组患者一般情况比较
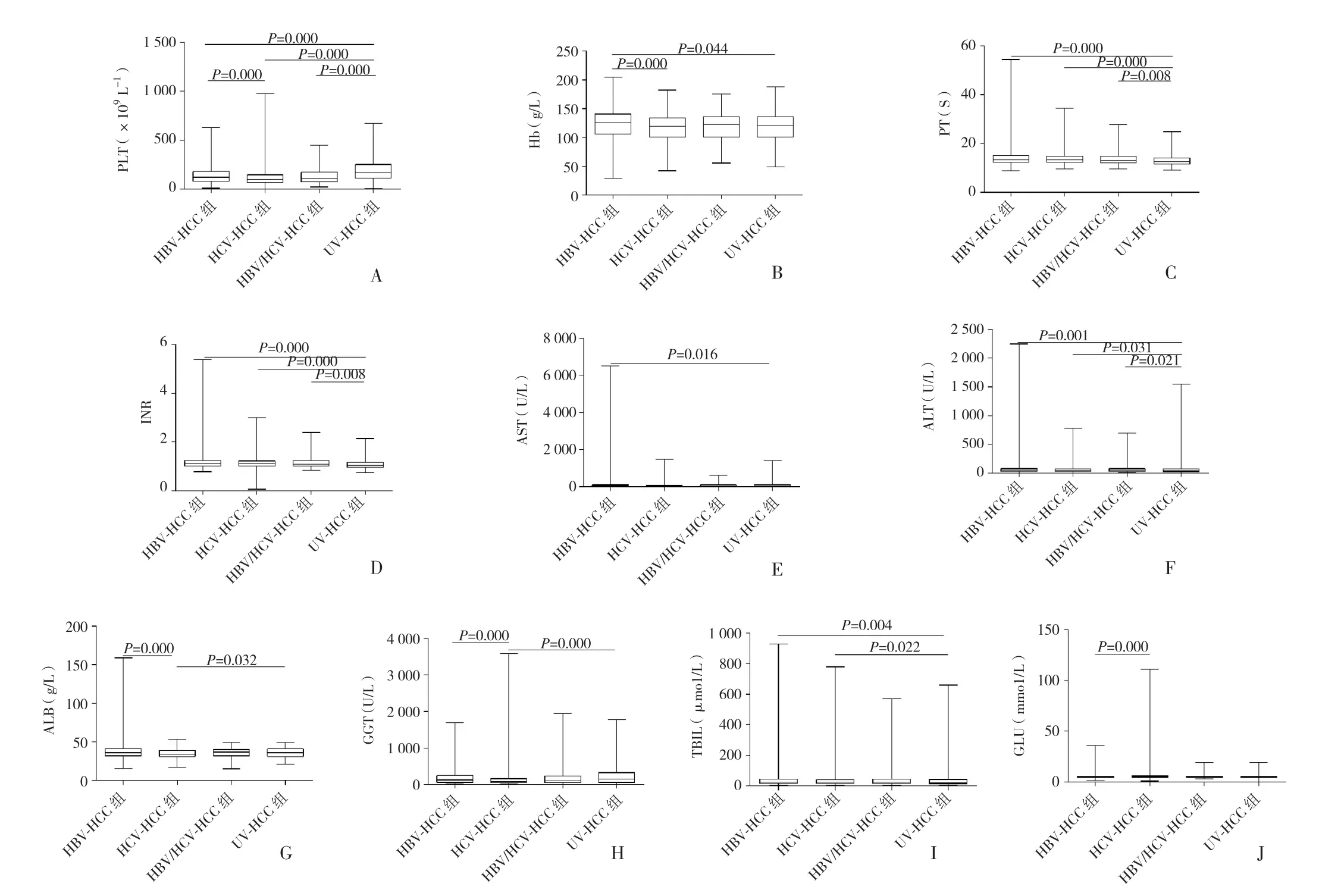
图1 常规原比例分布情况
2.3 不同临床指标在不同病因HCC中的预后价值比较 各指标通过与终末期肝病模型(MELD)评分进行Spearman等级相关分析结果显示,所有HCC组中PT、INR、AST、ALT、GGT、TBIL、CREA 指标与 MELD 评分均存在显著相关性,其中HBV-HCC组AST、ALT、GGT与MELD评分均存在显著相关性(r=0.761、0.514、0.938,P<0.001);HCV-HCC 组 PT、INR、TBIL、CREA 与 MELD评分存在显著相关性(r=0.561、0.577、0.691、0.606,P<0.001);HBV∕HCV-HCC 组 INR、TBIL、CREA 与 MELD评分显著相关性(r=0.622、0.653、0.661,P<0.001);UVHCC组INR、TBIL与MELD评分存在显著相关性(r=0.503、0.613,P<0.001)。{MELD 评分=3.8ln[TBIL(mg∕dL)]+11.2ln(INR)+9.6ln[CREA(mg∕dL)]+6.4(病因:胆汁性或酒精性0,其他1}。
3 讨 论
不同临床指标在不同病因HCC患者中呈现不同的变化趋势。UV-HCC组、HBV-HCC组、HCV-HCC组、HBV∕HCV-HCC 组患者在 PLT、Hb、PT、INR、AST、ALT、ALB、GGT、TBIL指标上均存在显著差异;而HBV-HCC、HCV-HCC与HBV∕HCV-HCC组患者在各指标上均无显著差异。PLT、Hb、ALB、GGT 水平在 HBV-HCC 组中均高于HCV-HCC组患者,而GLU水平低于HCV-HCC组患者;HBV、HCV-HCC组患者较非病毒感染者PLT、ALB 水平均降低,ALT、PT、INR、TBIL 指标均升高,这些指标的变化对临床评估患者病情改变具有一定的指导意义。这些指标在不同病因HCC的变化存在差异,但与病毒复制水平有无相关性还需要进一步探讨。
MELD评分是目前最有效的终末期肝病模型之一,在评价肝病严重程度、判断预后方面有重要的临床价值。通过与MELD评分相关分析结果显示,PT、INR、AST、ALT、GGT、TBIL、CREA 具有一定的预后价值,可以作为HCC患者预后评估的危险指标,并且在不同病因HCC中预后价值各有不同。有研究表明,HCC患者采用根治性肝切除术后PLT与肝功能恢复密切相关,可作为术后发生肝功能衰竭的危险指标[6]。Hb水平与HCC患者的生存时间呈正相关,Hb水平越低,患者的生活质量越差,生存时间越短。因此,Hb水平可作为判断HCC预后的危险因素之一[7]。但是,在本研究中未能证实PLT、Hb在HCC预后中的预测价值。有研究结果显示,原发性HCC患者出现凝血功能障碍、纤溶功能亢进,经介入治疗后减轻,但未恢复正常,凝血指标可能作为评价预后的敏感指标[8]。本研究结果表明,PT在HCV-HCC患者中评估预后风险的价值大于其他HCC患者,而且INR的价值由于PT、INR在HCV-HCC组、HBV∕HCV-HCC组、UV-HCC组患者中均显示一定的预测价值,但二者在HBV-HCC评估预后中的价值均较低。
AST、ALT、GGT用于评估HBV-HCC组预后的价值均显著优于其他病因HCC,其中GGT与HBV-HCC预后呈高度相关性,而在其他病因HCC中仅存在极低的相关性。最近的一些研究也表明,GGT作为HCC病例的独立预后指标,且预后价值优于Child-Pugh分级、MELD评分和血清甲胎蛋白(AFP)[9]。同时,有研究也显示,GGT的预测价值优于肿瘤数量、肿瘤大小、淋巴结侵犯、血清中性粒细胞计数(ANC)、淋巴细胞计数(ALC)、AFP,并且不受酒精摄入量的影响[10]。由于MELD模型计算较为复杂,临床上针对HBV-HCC患者可以优先考虑使用GGT水平评估预后风险。

