不同溶剂和方法对柴胡地上部分总黄酮提取率的影响*
郝彩琴,冷晓红,郭鸿雁,陈海燕(宁夏职业技术学院,宁夏银川750002)
柴胡来源于伞形科柴胡属植物,为常用中药,在我国已有2 000多年的应用历史,《中华人民共和国药典》2015版收载的柴胡品种为伞形科植物柴胡或狭叶柴胡的干燥根[1]。
柴胡味辛、苦,性微寒,具有疏散退热、舒肝升阳之功效,主治感冒发热、寒热往来、疟疾、月经不调及子宫脱垂等症状。现代药理研究证明,柴胡具有解热、镇痛、镇静、抗炎、保肝利胆、抗菌、抗病毒及抗肿瘤等作用[2-3]。柴胡的药效化学成分主要为皂苷、黄酮类、挥发油、植物甾醇和多糖等[4-5],其中柴胡黄酮具有较强的抗流感病毒作用,而且具有较好的抗炎、降温效果和对多种细菌有较强的抑制或杀灭作用[6-8]。有研究报道,柴胡的地上部位茎、叶、果实和地下部分根都含有黄酮类,而且不同部位黄酮的含量不同,且地上部位黄酮的含量要远高于地下部位[9-10]。
柴胡由于产地局限,蕴藏量稀少,长期盲目采挖已使野生资源濒危,被宁夏列为植物资源修复的重点品种,在宁夏柴胡属于六盘山区特色药材,现已形成规模化种植,但柴胡是以根入药为主的传统中药,茎叶多弃之不用,造成资源利用不足,为了开发利用药源,本研究对宁夏栽培柴胡地上部分黄酮类化合物的提取方法和溶剂进行系统研究,为充分利用和扩大柴胡药用部位提供理论依据。
1 材料与方法
1.1 材料
1.1.1 仪器 TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司),比色皿(玻璃),TYS-400A型高速多功能粉碎机(浙江省永康市红太阳机电有限公司),EL204万分之一电子天平[梅特勒-托利多仪器(上海)有限公司],RE-52A真空旋转蒸发仪(上海亚荣生化仪器厂),SIB-Ⅲ型循环式多用真空泵(郑州长城科工贸有限公司),78-1型磁力加热搅拌器(江苏省金坛市恒丰仪器制造有限公司),数控KQ-600DE型超声清洗仪(昆山市超声仪器有限公司),SHY-2A水浴恒温振荡器(常州国宇制造有限公司),美的EG720FF1-NS微波炉(Midea公司),KDM型调温电热套(山东鄄城华鲁电热仪器有限公司)。
1.1.2 药品与试剂 芦丁(中国食品药品检定研究院,批号:100080-201409),亚硝酸钠(上海广诺化学仪器有限公司),硝酸铝(上海广诺化学仪器有限公司),氢氧化钠(烟台市双双化工有限公司);无水乙醇(分析纯,西安化学试剂厂)、食用乙醇、蒸馏水。
1.1.3 药材 柴胡地上部分(2016年9月采自固原隆德县柴胡种植基地,经鉴定为北柴胡地上部分),自然晾干,粉碎过药典二号筛。
1.2 方法
1.2.1 紫外线检测方法的建立
1.2.1.1 标准曲线的建立 参照文献[11]中的方法并稍作改进,取10.6 mg芦丁用30%的乙醇溶解,转移至100 mL容量瓶中,并定容至刻度,得到质量浓度为0.106 mg∕mL的芦丁标准液。分别精密吸取 0.0、1.0、2.0、4.0、6.0、8.0和10.0 mL的芦丁标准液置于7个25 mL的容量瓶中,用30%的乙醇溶液稀释至10 mL;加入浓度为5%的亚硝酸钠溶液1 mL,静置6 min,再加入浓度为10%的硝酸铝溶液1 mL,静置6 min,然后再加入4%的氢氧化钠溶液1 mL,最后用30%的乙醇溶液定容,静置10 min,以试剂空白作为参比,用1 cm比色皿在400~800 nm波长范围进行扫描,测得最大吸收峰位于510 nm处,然后在510 nm波长处测定吸光度。得到以下芦丁标准曲线方程:
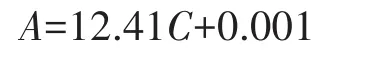
式中:A为吸光度,C为质量浓度(mg∕mL);R2为0.999 6。芦丁乙醇溶液在 0.000 0~0.042 4 mg∕mL 的范围内其线性关系良好。
黄酮浓度的计算公式为:

式(1)中:A为吸光度,C表示黄酮的质量浓度(mg∕mL)。
式(2)中:C为黄酮的质量浓度(mg∕mL),M柴胡为柴胡地上部分的质量(mg),V总为粗提液的定容体积,V取为移取用于测定黄酮浓度的粗提液的体积。
1.2.1.2 精密度试验 精密吸取芦丁标准溶液5.00 mL 5份,分别置于25 mL容量瓶中,按标准曲线测定方法测定。
1.2.1.3 稳定性试验 精密吸取芦丁标准溶液5.00 mL 3份,分别置于25 mL容量瓶中,按标准曲线测定方法测定,第1次测定为0 min,以后每隔10 min测定1次,共测定60 min。
1.2.1.4 重复性测定 准确称取柴胡地上部分粗粉1.000 g,按静态回流法用55%乙醇进行提取,提取液过滤浓缩,并定容于25 mL容量瓶中,平行做5份重复,各取1 mL定容后的溶液。
1.2.1.5 加样回收率测定 准确称取柴胡地上部分粗粉0.500 g,共6份,按静态回流法用55%乙醇进行提取,提取液过滤、浓缩,并定容于25 mL容量瓶中,然后各取1 mL分别加入25 mL容量瓶中,并各加入0.21 mg∕mL的芦丁标准液1.6 mL,并按标准曲线测定项下要求加入其他显色试剂,在标准曲线测定条件下进行吸光度测定,并按下式计算加标回收率:加标回收率=(加标样试测定值-试样测定值)∕加标量×100%。
1.2.1.6 样品测定 精密移取稀释定容好的提取液各1 mL,并分别置于25 mL容量瓶中,根据“1.2.1.1”项下紫外线检测方法进行含量测定,为防止提取液颜色对测定结果的影响,参照文献[12]以不加硝酸钠等显色剂的试样(即精密移取稀释定容好的提取液1 mL,置于25 mL容量瓶中,加30%的乙醇至刻度,摇匀)作为参比。
1.2.2 提取溶剂的选择
1.2.2.1 溶剂提取过程 精确称取宁夏栽培柴胡地上部分粗粉1.00 g共18份,分别置入100 mL具塞三角瓶中,并编号,1~3号分别加入35%乙醇溶液25 mL,4~6号分别加入45%乙醇溶液,25 mL,7~9号分别加入55%乙醇溶液25 mL,10~12号分别加入65%乙醇溶液25 mL,13~15号分别加入75%乙醇溶液25 mL,16~18号分别加入85%乙醇溶液25 mL,分别在室温下浸泡24 h,并减压、抽滤,滤液在旋转蒸发仪上60℃以下减压蒸干,称重,干浸膏用30%乙醇超声溶解,转移至10 mL容量瓶中,并用30%乙醇定容至刻度,摇匀。按照“1.2.1.6”项下样品测定方法进行含量测定。
1.2.2.2 不同溶剂提取所得浸膏和总黄酮的得率 根据浸膏得率和测定的黄酮提取率,应用SPASS19.0统计软件进行数据分析。
1.2.3 提取方法的选择
1.2.3.1 提取过程
1.2.3.1.1 恒温水浴振荡器提取过程 精确称取柴胡地上部分粗粉1.000 g,置入100 mL具塞三角瓶中,加入体积分数55%乙醇溶液25.0 mL,室温浸泡20 min,在恒温水浴振荡器上,室温振荡浸渍16 h,减压抽滤,滤液在旋转蒸发仪上60℃以下减压蒸干,干浸膏用30%乙醇超声溶解,转移至25 mL量瓶中,用30%乙醇定容至刻度,摇匀,平行做4个样,按照“1.2.1.6”项下样品测定方法进行含量测定。
表1 不同溶剂提取所得浸膏和总黄酮的得率(n=3,±s,%)

表1 不同溶剂提取所得浸膏和总黄酮的得率(n=3,±s,%)
项目浸膏得率总黄酮提取率35%乙醇13.090±0.441 0.793±0.070 45%乙醇13.920±0.598 0.945±0.007 55%乙醇13.600±0.583 1.120±0.043 65%乙醇13.380±0.760 1.080±0.037 75%乙醇11.740±0.680 0.819±0.097 85%乙醇7.520±0.025 0.702±0.036
表2 不同方法提取的浸膏得率及总黄酮提取率(n=4±s,%)

表2 不同方法提取的浸膏得率及总黄酮提取率(n=4±s,%)
项目浸膏得率总黄酮提取率恒温水浴振荡器提取11.960±1.630 1.230±0.093静态热回流提取16.160±1.650 2.220±0.081动态热回流提取16.180±1.840 2.050±0.038超声波辅助提取12.360±1.380 1.400±0.053微波辅助提取14.840±0.671 1.93±0.056
1.2.3.1.2 静态热回流提取过程 精确称取柴胡地上部分粗粉1.000 g,置入250 mL平底烧瓶,加入体积分数55%乙醇溶液25.0 mL,室温浸泡20 min,在普通加热回流装置上,电热套加热回流40 min,冷却,减压抽滤,滤液在旋转蒸发仪60℃以下减压蒸干,干浸膏用30%乙醇超声溶解,转移至25 mL量瓶中,用30%乙醇定容至刻度,摇匀,平行做4个样,按照“1.2.1.6”项下样品测定方法进行含量测定。
1.2.3.1.3 动态热回流提取过程 精确称取柴胡地上部分粗粉1.000 g,置入250 mL平底烧瓶,加入体积分数55%的乙醇25.0 mL,室温浸泡20 min,然后在磁力搅拌器上搅拌加热回流提取40 min,冷却,减压抽滤,滤液在旋转蒸发仪上60℃以下减压蒸干,干浸膏用30%乙醇超声溶解,转移至25 mL量瓶中,用30%乙醇定容至刻度,摇匀,平行做4个样,按照“1.2.1.6”项下样品测定方法进行含量测定。
1.2.3.1.4 超声波辅助提取法提取过程 精确称取柴胡地上部分1.000 g,置入100 mL带塞三角瓶中,加体积分数入55%的乙醇25.0 mL,室温浸泡20 min,在超声波清洗仪上室温超声40 min,减压抽滤,滤液在旋转蒸发仪60℃以下减压蒸干,干浸膏用30%乙醇超声溶解,转移至25 mL量瓶中,用30%乙醇定容至刻度,摇匀,平行做4个样,按照“1.2.1.6”项下样品测定方法进行含量测定。
1.2.3.1.5 微波辅助提取法提取过程 精确称取宁夏六盘山栽培柴胡地上部粗粉1.000 g,置入250 mL具塞三角瓶中,加入体积分数55%的乙醇25.0 mL,室温浸泡55 min(保证样品浸在溶剂中的总时间与其他方法一致),然后再用微波中火提取5 min(提取过程每隔1~2 min停 30 s),冷却,减压抽滤,滤液在旋转蒸发仪上60℃以下减压蒸干,干浸膏用30%乙醇超声溶解转移至25 mL量瓶中,用30%乙醇定容至刻度,摇匀,平行做4个样,按照“1.2.1.6”项下样品测定方法进行含量测定。
1.2.3.2 不同方法提取的浸膏得率及总黄酮提取率 根据浸膏得率和测定的黄酮提取率,应用SPASS19.0统计软件进行数据分析。
2 结 果
2.1 精密度试验 按标准曲线条件下操作方法进行测定,得平均A为0.250 2,相对标准偏差(RSD)为0.866 5%,说明该方法的精密度良好。
2.2 稳定性试验 按标准曲线条件下操作方法进行测定,得平均A为0.247 8,RSD为0.346 7%,说明样品在0~60 min内测定是稳定的。
2.3 重复性测定 按标准曲线条件下操作方法进行测定,得平均A为0.443 2,RSD为1.026%,说明该方法的重现性良好。
2.4 加样回收率测定 平均回收率为99.27%,RSD为1.570%。
2.5 不同溶剂提取所得浸膏和总黄酮的得率 本试验所选6种溶剂对宁夏栽培柴胡地上部分总黄酮的提取率有一定差异,其中55%乙醇提取的总黄酮提取率最高,为(1.120±0.043)%,相应的浸膏得率也较高,为(13.600±0.583)%,因此,在选取方法时,采用55%乙醇为溶剂进行提取。见表1。
2.6 提取方法的选择 本试验所选5种方法对宁夏栽培柴胡地上部分总黄酮的提取率有一定差异,其中静态热回流提取法的总黄酮提取率最高,为(2.220±0.081)%,相应的浸膏得率也较高,为(16.160±1.650)%。见表2。
3 讨 论
本试验通过紫外线检测研究不同浓度乙醇即35%、45%、55%、65%、75%、85%乙醇为提取溶剂对宁夏栽培柴胡地上部分总黄酮提取率的影响,结果发现,55%乙醇对其提取率最高,其次是65%乙醇提取,而其他浓度乙醇对其提取率相对较低,说明宁夏栽培柴胡地上部分的黄酮类化合物极性相对较大,且55%的乙醇对其细胞的穿透能力更强。本试验通过紫外检测研究不同方法即恒温水浴振荡器提取、静态热回流提取法、动态热回流提取法、超声波辅助提取法、微波辅助提取法对宁夏栽培柴胡地上部分总黄酮的提取率的影响,结果发现静态热回流提取法对其提取率最高,其次是动态热回流提取法,而其他提取法对其提取率相对较低,说明宁夏栽培柴胡地上部分的黄酮类化合物在热的溶剂中溶解性更强。本试验首次同时考虑提取溶剂和提取方法对宁夏栽培柴胡地上部分总黄酮提取率的影响,这样使所确定出的提取溶剂和方法更准确、合理。本试验过程中采用了提取之前先用提取溶剂对药材进行浸泡,以便于溶剂更好地穿透药材细胞,充分溶出药材的有效成分。

