布地奈德对哮喘小鼠IL-17表达的影响
张艳霞,王文革
(中国人民解放军空军总医院 儿科,北京100142)
支气管哮喘(简称哮喘)是由各种炎症细胞和细胞组分参与的气道慢性炎症疾病,其发病机制极为复杂,目前尚未完全清楚。哮喘病理变化主要包括3种特征性表现:气道慢性炎症、气流受阻及气道高反应,其中气道慢性炎症被认为是哮喘的本质。近年研究发现[1]在各种免疫反应如自身免疫、宿主防御病原体及炎症反应中,白细胞介素17(IL-17)均参与其免疫调节机制。IL-17可以介导中性粒细胞、嗜酸性粒细胞等炎症细胞在气道中聚集,加重哮喘的气道炎症,从而参与哮喘的发生、发展,也可以抑制炎症,在哮喘的气道中起负性调节作用。目前IL-17在哮喘中起促炎还是抑炎的作用尚未明确。吸入性糖皮质激素(inhaled corticosteroids, ICS)可以减少细胞因子及炎症细胞在气道中的聚集、浸润[2],是长期控制哮喘的有效药物,其中布地奈德为其代表性药物[3]。目前关于布地奈德治疗哮喘作用机制的研究主要涉及通过干预IL-1、IL-10、IL-5、IL-23等细胞因子的表达,而对IL-17表达影响的研究较少。本研究利用哮喘小鼠模型,研究哮喘小鼠中IL-17的表达,经布地奈德干预后,哮喘小鼠IL-17表达的变化。进而探讨IL-17在哮喘发病机制中的作用以及布地奈德控制哮喘的作用机制与IL-17的关系。
1 材料与方法
1.1 主要试剂和仪器
布地奈德混悬液(1 mg/2 ml,LOT320888)购自上海阿斯利康制药有限公司,十二水硫酸铝钾(237086)、卵清蛋白(Ovalbumin, OVA,A5253~250 g,纯度≥98%)购自美国Sigma公司,HE及AB-PAS染色试剂盒购自武汉谷歌生物公司,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)IL-17试剂盒购自美国eBioscience公司,Trizol购自美国Invitrogen公司,氯仿、异丙醇、无水乙醇均购自天津市永大化学试剂有限公司,DEPC水购自北京索莱宝科技有限公司,TIAN Script RT KIT、Super Real Pre Mix Plus(SYBR Green)均购自天根生化科技(北京)有限公司。压缩空气式雾化机购自江苏鱼跃医疗设备股份有限公司。引物序列由上海生工生物工程有限公司设计。
1.2 实验动物
SPF级雌性BALB/c小鼠24只,4周龄,体重(13±1)g,购自北京斯贝福实验动物科技有限公司[SCXK(京)2016-0004],小鼠饲养于中国人民解放军总医院第一附属医院(304医院)实验动物房。其余实验于中国人民解放军空军总医院临床航空医学实验室完成。
1.3 模型复制
复制哮喘小鼠模型,参考文献[4-5]并加以改进。小鼠适应性饲养1周后,经随机数表法分为正常组、哮喘组及布地奈德组,每组8只。哮喘组与布地奈德组每只小鼠分别于饲养的第8、15、22天腹腔注射OVA致敏液0.2 ml[(内含十二水硫酸铝钾1 mg,OVA 100 μg,磷酸盐缓冲液(PBS)0.2 ml)]致敏。正常组小鼠腹腔只注射PBS。哮喘组及布地奈德组分别自饲养的第29天开始以5%OVA溶液雾化激发,正常组以PBS雾化吸入,1次/d,30 min/次,连续激发14 d后,布地奈德组在5% OVA激发前30 min给予布地奈德混合液4 ml(布地奈德混悬液1 mg/2 ml、生理盐水2 ml)雾化吸入30 min。正常组及哮喘组小鼠均同时给予等量的生理盐水。
1.4 取材
小鼠末次给予OVA、布地奈德混悬液雾化吸入后,禁食24 h,24 h后用1%戊巴比妥腹腔注射麻醉,引颈处死后,切开颈部及胸部皮肤,逐层分离组织,充分暴露气管及双肺,于气道的上段做一横向切口,以21 G的注射器针头做气管插管并固定,结扎右肺,将0.3 ml的PBS溶液缓慢灌注左肺并缓慢回抽灌洗液,重复灌洗3次,回收率为80%。将收集的支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)以1 500 r/min,4℃离心10 min,回收上清液置入-80℃冰箱冷冻保存。取右肺-80℃冰箱冷冻保存。
1.5 小鼠肺组织病理切片的制备
收取BALF后,分离小鼠右肺,取约为1.5 cm×1.5 cm×0.2 cm大小的肺组织,将其浸润于4%多聚甲醛中固定48 h,石蜡包埋,行小鼠肺组织切片,厚度约3 μm,行AB-PAS及HE染色,显微镜下观察小鼠肺组织中性粒细胞、嗜酸性粒细胞等炎症细胞浸润情况,同时观察支气管管腔狭窄、气道中杯状细胞增生等典型的哮喘病理学改变。对各组肺组织进行病理学分级评分[6-7],0分:无炎症细胞;1分:少许炎症细胞;2分:炎症细胞形成环状,层厚为1个细胞;3分:大量分布均匀的炎症细胞,或炎症细胞形成环状,层厚为2~4个细胞;4分:大量炎症细胞聚集成团,或炎症细胞成环状,层厚>4个细胞。
1.6 BALF中IL-17表达水平的检测
采用ELISA检测BALF中IL-17的表达水平,具体操作步骤按照试剂盒说明书进行,每个样本和标准品均设2个复孔。
1.7 实时荧光定量聚合酶链反应(qRT-PCR)检测小鼠肺组织中IL-17的表达
IL-17正向引物5'-AAGGCAAATACGGTGGTG TG-3',反向引物 3'-CGCTGAGGAAGTGGGAAAAG-5'。所有cDNA样品分别配置qRT-PCR反应体系。实验操作过程按产品说明书进行:在反应管内依次加入 2×Super Real Pre Mix Plus(10 μl)、正向引物(10 μmol)(0.6 μl)、反向引物(10μmol)(0.6 μl)、cDNA(100 ng)、50×ROX Reference Dye △(0.4 μl),以RNase-Free ddH2O将反应体系调至20 μl。将溶液混合后,短暂离心,将制备好的标准品和检测样本上机进行PCR反应。PCR反应条件为95℃ 15 min;95℃10 s,58℃ 30 s,72℃ 30 s,共 40个循环。
1.8 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,符合方差齐性及正态分布的采用单因素方差分析,不符合的进行Tamhane’s检验,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 OVA激发后小鼠的行为表现
哮喘组以及布地奈德组小鼠激发后均出现不同程度的呼吸急促、喘息、烦躁不安、腹肌痉挛、搔鼻及站立不稳等阳性行为,短时间内可自行缓解。其中布地奈德组的哮喘症状较哮喘组症状明显减轻。正常组未见明显的异常表现。
2.2 各组小鼠肺组织病理改变
HE染色中正常组小鼠气道黏膜未见明显的炎症细胞浸润,气管腔光滑,肺泡腔内未见炎症分泌物,无肺泡壁变薄。哮喘组小鼠气道黏膜层可见明显的炎症细胞浸润,以中性粒细胞、嗜酸性粒细胞增生为主,黏膜上皮细胞肿胀,肺泡腔内可见炎症细胞浸润,肺泡壁变薄,气道管腔变窄。经布地奈德雾化吸入后,布地奈德组小鼠气道黏膜可见炎症细胞浸润,黏膜上皮细胞仍有轻微的增厚,但与哮喘组小鼠相比明显减轻,气道管腔狭窄缓解(见图1)。AB-PAS染色中正常组小鼠气道上皮未见杯状细胞,气道平滑肌及基底膜未增厚,哮喘组小鼠气道上皮可见明显的杯状细胞,气道平滑肌及基底膜明显增厚,经布地奈德干预后,布地奈德组小鼠气道上皮仍可见杯状细胞,但比哮喘组相比明显较少,气道平滑肌增厚明显减轻(见图2)。

图1 各组小鼠肺组织病理切片图 (HE×400)
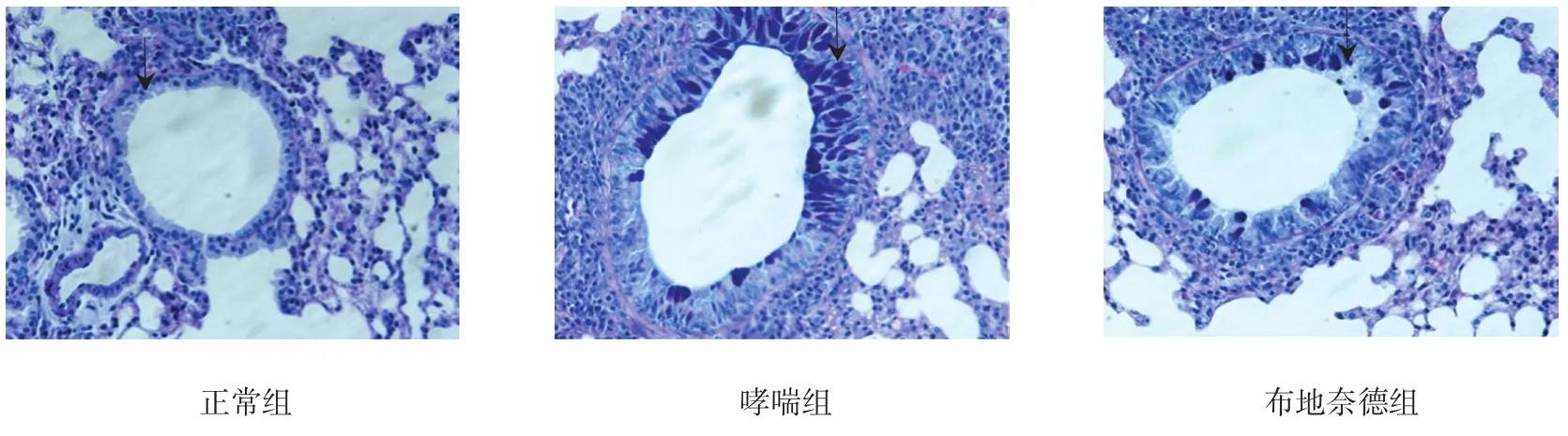
图2 各组小鼠肺组织病理切片图(AB-PAS×400)
2.3 各组小鼠肺组织病理学炎症评分比较
各组小鼠肺组织病理学炎症评分,正常组为(0.000±0.000),哮喘组为(3.625±0.518),布地奈德组为(1.750±0.463),经单因素方差分析,差异有统计学意义(F=105.903,P =0.000);进一步两两比较显示,与正常组比较,哮喘组小鼠肺组织炎症评分增高(t=19.811,P=0.000);与正常组比较,布地奈德组小鼠肺组织炎症评分增高(t=10.693,P=0.000);与哮喘组比较,布地奈德组小鼠肺组织炎症评分降低(t=-6.355,P=0.000)。
2.4 各组小鼠BALF中IL-17细胞因子的表达比较
ELISA法检测各组BALF中IL-17表达,正常组为(12.175±4.322)pg/ml,哮喘组为(58.750±10.026)pg/ml,布地奈德组为(29.522±8.900)pg/ml,经单因素方差分析,差异有统计学意义(F=67.020,P =0.000);进一步两两比较显示,与正常组比较,哮喘组中IL-17表达升高(t=12.496,P=0.000);与正常组比较,布地奈德组小鼠中IL-17的表达升高(t=6.252,P=0.000);与哮喘组比较,布地奈德组中IL-17的表达降低(t=-6.848,P=0.000)。
2.5 各组小鼠肺组织中IL-17 mRNA的表达比较
qRT-PCR目的基因的扩增曲线,见图3。qRTPCR目的基因的熔解曲线,见图4。
qRT-PCR检测各组小鼠肺组织中IL-17 mRNA表达,正常组为(0.935±0.152)pg/ml,哮喘组为(6.898±1.559)pg/ml,布地奈德组为(3.613±0.681)pg/ml,经单因素方差分析,差异有统计学意义(F=73.390,P =0.000);进一步两两比较显示,与正常组比较,哮喘组中IL-17 mRNA表达升高(t=11.671,P=0.000);与正常组比较,布地奈德组小鼠中IL-17 mRNA的表达升高(t=11.619,P=0.000);与哮喘组比较,布地奈德组中IL-17 mRNA的表达降低(t=-5.372,P=0.000)。

图3 目的基因的扩增曲线

图4 目的基因的熔解曲线
3 讨论
Th17细胞是近年来新发现的一种新型的CD4+T细胞,一种独立于Th1和Th2以外的辅助性T细胞。其特征性细胞因子为IL-17和IL-17F,IL-17F主要在黏膜防御反应中起作用[8]。IL-17不仅可参与肿瘤、免疫性疾病,而且还与许多炎症疾病有关。研究显示[9]IL-17可以通过肿瘤坏死因子、IL-1的协同作用,放大炎症效应,进而参与哮喘等炎症疾病的发生、发展。IL-17具有很强的募集中性粒细胞以及促进多种细胞释放炎症因子的作用[10]。哮喘是一种气道慢性炎症,有研究证明在哮喘患者肺组织、BALF、痰和血清中IL-17表达明显增高[11-12]。但是IL-17在哮喘的肺组织中起抑制炎症的作用。本研究发现,哮喘小鼠BALF中IL-17的表达及肺组织中IL-17 mRNA表达较正常组均增高,并且哮喘组的气道中嗜酸性粒细胞及中性粒细胞与正常组比较有所增多,杯状细胞亦增多。进一步说明IL-17与哮喘的发生发展有着密不可分的关系。
ICS是目前应用最广泛也是最有效的长期控制、预防哮喘发作的首选药物,其治疗哮喘的作用已成为国际共识[13],其中布地奈德是ICS中最常用的一种,抗炎效果好,雾化吸入的布地奈德可以局部、直接作用于气道黏膜[14],局部抗炎作用强,可以有效地减少全身不良反应,更好地控制哮喘患者的气道炎症及降低呼吸道阻力,进而缓解哮喘患者的呼吸困难、喘息等症状,以及缩短咳嗽持续的时间。本研究发现哮喘组小鼠的BALF中IL-17表达及肺组织中IL-17 mRNA表达均升高,气道中炎症细胞及杯状细胞增多,经布地奈德干预治疗后,降低哮喘小鼠肺中IL-17的表达,以及气道中炎症细胞减少。本研究提示IL-17在哮喘的发生、发展中有一定的作用,而布地奈德的干预可以降低IL-17的表达,减少炎症细胞在气道中聚集,减轻哮喘小鼠肺部气道炎症。
综上所述,致敏小鼠在反复的抗原激发后,哮喘组小鼠的气道中炎症细胞聚集,杯状细胞增多,炎症评分较正常组、布地奈德组均高,BALF中IL-17表达及肺组织中IL-17 mRNA表达均升高。而经布地奈德干预后,与哮喘组比较,哮喘小鼠的气道炎症减轻,炎症评分降低,BALF中IL-17表达及肺组织中IL-17 mRNA表达降低。本实验结果表明,IL-17可以促进炎症细胞在气道中聚集,引起气道炎症,参与哮喘的发生、发展,同时也表明布地奈德可抑制IL-17的合成、分泌,从而减轻气道炎症,进一步揭示抑制IL-17分泌是布地奈德控制哮喘的作用机制之一。

