基质金属蛋白酶3-1612基因多态性与急性缺血性脑卒中的关系*
李永芳,李艾帆,张玉超,姜晓蕊,崔传举,袁树华,贺颖,郑红
(1.河南大学附属郑州市第一人民医院 神经内科,河南 郑州 450000;2.河南大学附属郑州市第一人民医院 优生遗传室,河南 郑州 450000;3.郑州大学基础医学院医学遗传与细胞生物学系,河南 郑州 450001)
近年来,很多研究表明,基质金属蛋白酶(matrix metalloproteinases, MMPs)参与了急性缺血性脑卒中(acute ischemic stroke, AIS)过程中的炎症反应及继发脑损伤[1]。MMPs是一族在细胞外基质降解及再塑中发挥重要作用的锌离子依赖的中性蛋白酶家族,研究表明其在动脉粥样硬化过程中发挥着重要作用[2-3],而动脉粥样硬化又在AIS发病程过程中扮演重要角色[4],因此笔者推测MMPs可能通过参与动脉粥样硬化过程从而在AIS发挥作用。MMP-3是MMPs家族中重要成员,可激活多种MMPs的生物活性[5],笔者推测MMP-3启动子-1612(5A/6A)基因多态性可能是AIS的易感因素。本研究旨在通过基因测序技术,探讨MMP-3启动子基因多态性与AIS的关系并探讨其机制,从而为AIS的遗传易感基因提供理论依据。
1 资料与方法
1.1 一般资料
随机选取2015年4月-2016年7月郑州市第一人民医院神经内科住院并且确诊的AIS患者300例及同期住院的健康个体300例,其性别、年龄均与AIS组相匹配。根据第4届脑血管病学术会议的修订的诊断标准,AIS的诊断经临床检查(体征、病史、CT/MRI)确诊。所有研究个体之间无血缘关系。所有参与个体均已签署知情同意书,并获得郑州市第一人民医院伦理委员会的批准。AIS根据TOAST分型[6],本室将其分为5个亚组:大动脉粥样硬化型(LAA)、小动脉闭塞型(SAO)、心源性栓塞型(CE)、其他明确病因型(SODE)及其他不明原因型(SUE)亚组,分别研究其与MMP-3基因多态性相关程度。排除标准:癫痫、癌症、出血性脑血管病及肝肾功能不全者、慢性炎症、帕金森症及综合征。
1.2 基因型判定
1.2.1 标本采集及DNA的抽提 抽取所有研究患者的晨起空腹静脉血3 ml,将其置EDTA-Na2抗凝管中,并放置于-20℃冰箱保存备用。本实验提取DNA所用试剂为TIANGEN血液基因组DNA提取试剂盒。
1.2.2 SNaPshot多重单碱基延伸反应 PCR引物序列参照文献设计,由生工生物工程(上海)有限公司合成。MMP-3-1612正向引物:5'-TTCTCCATTCCT TTGATGGGGGAAAGA-3',反向引物:5'-TTATCTGTT GGGCTCCACTGTTTCTTCC-3'。MMP-3-1612反应条件:95℃ ×5 min,95℃ ×5 min,95℃ ×30 s,54℃ ×30 s,72℃×40 s,共35个循环,72℃×7 min,4℃保存。应用限制性内切酶Tth111Ⅰ在65℃孵育24 h,经琼脂糖凝胶电泳鉴定其基因型。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较采用独立样本t检验,计数资料及各组间的等位基因频率和基因型频率的比较采用χ2检验,本实验采用SHEsis软件进行Hardy-Weinberg遗传平衡检验,采用非条件Logisitic回归分析,所得的相对风险度()及95%CI对疾病发生的相对危险度及相关程度进行研究,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般临床资料比较
本研究对两组的年龄、性别等基本信息、危险因素及临床检验资料进行比较。研究结果显示,AIS组与对照组之间在性别、年龄构成方面差异无统计学意义(P>0.05)。对两组之间危险因素研究发现,AIS组危险因素如高血压、糖尿病、冠状动脉粥样硬化性心脏病(简称冠心病)患者的比例与对照组比较,差异有统计学意义(P<0.05),AIS组均高于对照组。两组间的生化指标如血糖、低密度脂蛋白、同型半胱氨酸在两组间差异有统计学意义(P<0.05)。见表1。
2.2 MMP-3-1612位点的凝胶电泳结果
野生型6A/6A基因型含有120 bp 1个条带;5A/6A基因型含有120 bp和97 bp 2个条带;5A/5A基因型者,只含有97 bp 1个条带。见图1。

表1 两组一般临床资料比较(n =300)
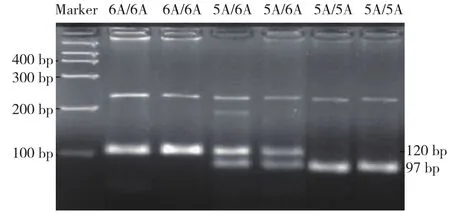
图1 MMP-3-1612电泳图
2.3 MMP-3-1612位点多态性分型结果
运用SHEsis软件检测发现,MMP-3基因位点-1612多态性基因型分布在AIS组和对照组中处于Hardy-Weinberg平衡(P=0.837和0.103),具有群体代表性。MMP-3-1612的基因型和等位基因频率分布结果显示,AIS组中的5A/5A基因型数目与对照组比较,差异有统计学意义(P<0.05),AIS组高于对照组。在隐性模式中,AIS组中的5A/5A基因数目与对照组比较,差异有统计学意义(P<0.05)AIS组高于对照组。见表2。
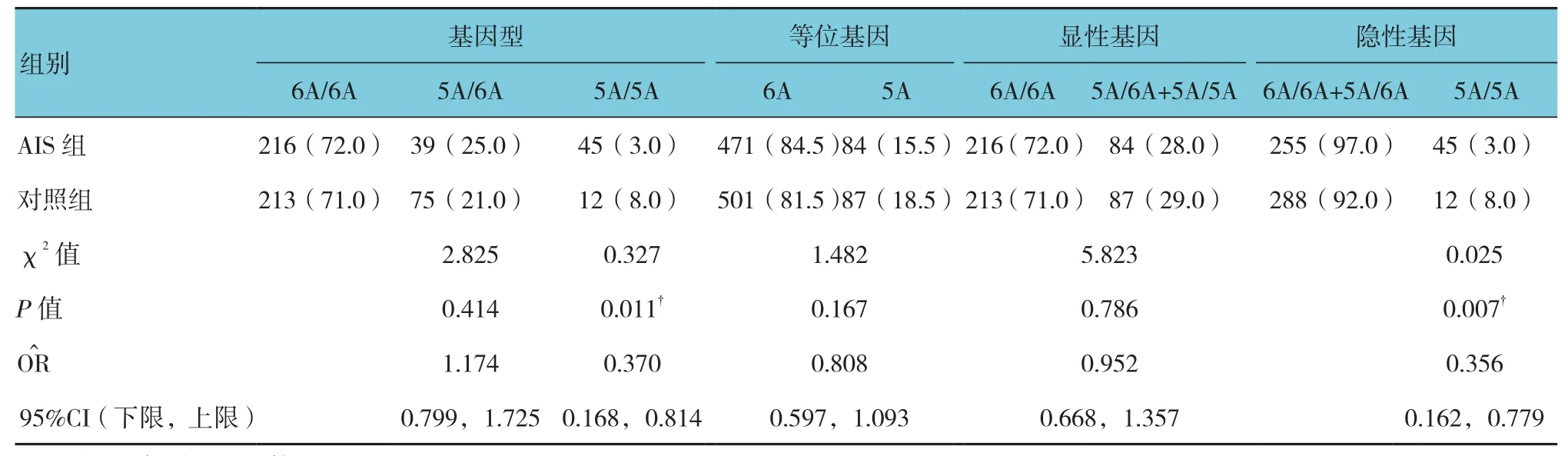
表2 基因型频率与等位基因频率在两组间的比较 例(%)
2.4 MMP-3-1612位点多态性与AIS亚型的相关性
根据TOAST分型法[6],将AIS组分为LAA组(104例)、SAO组(156例)、CE组(20例)、SODE组(5例)、SUE组(15例),分别研究MMP-3-1612位点与不同亚型的相关性,其中SODE型分别为烟雾病2例,凝血功能障碍3例。结果显示5A/5A基因型数目在LAA组比较,差异有统计学意义(P<0.05),基因型数目有升高。见表3。
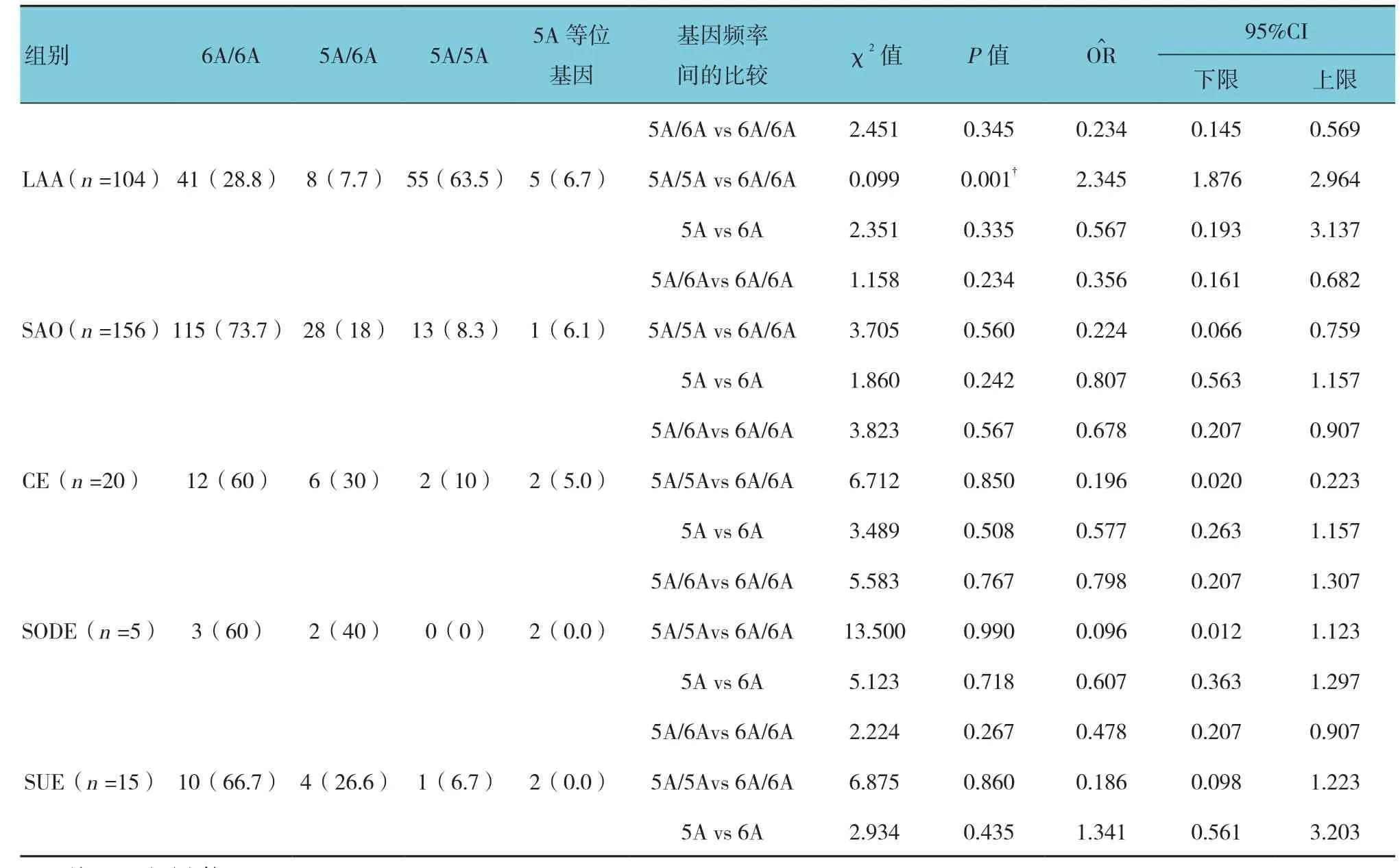
表3 AIS各亚型基因型频率与等位基因频率比较 例(%)
2.5 MMP-3-1612位点多态性基因型与脑梗死的关系
以MMP-3-1612基因多态性、低密度脂蛋白、血糖、高同型半胱氨酸、高血压、糖尿病、冠心病为自变量,以脑梗死为因变量,采用Logistic回归模型进行多因素分析,结果显示MMP-3-1612基因多态性、低密度脂蛋白升高、血糖升高、高同型半胱氨酸、高血压、冠心病、糖尿病均可增加LAA亚型的发病风险。见表4。
2.6 MMP-3-1612位点测序结果
为检验SNaPshot微测序技术分型结果的准确性,本实验随机抽取3种基因型的部分样本进行测序。结果显示,SNaPshot微测序技术的基因分型结果与测序结果完全一致。见图2。
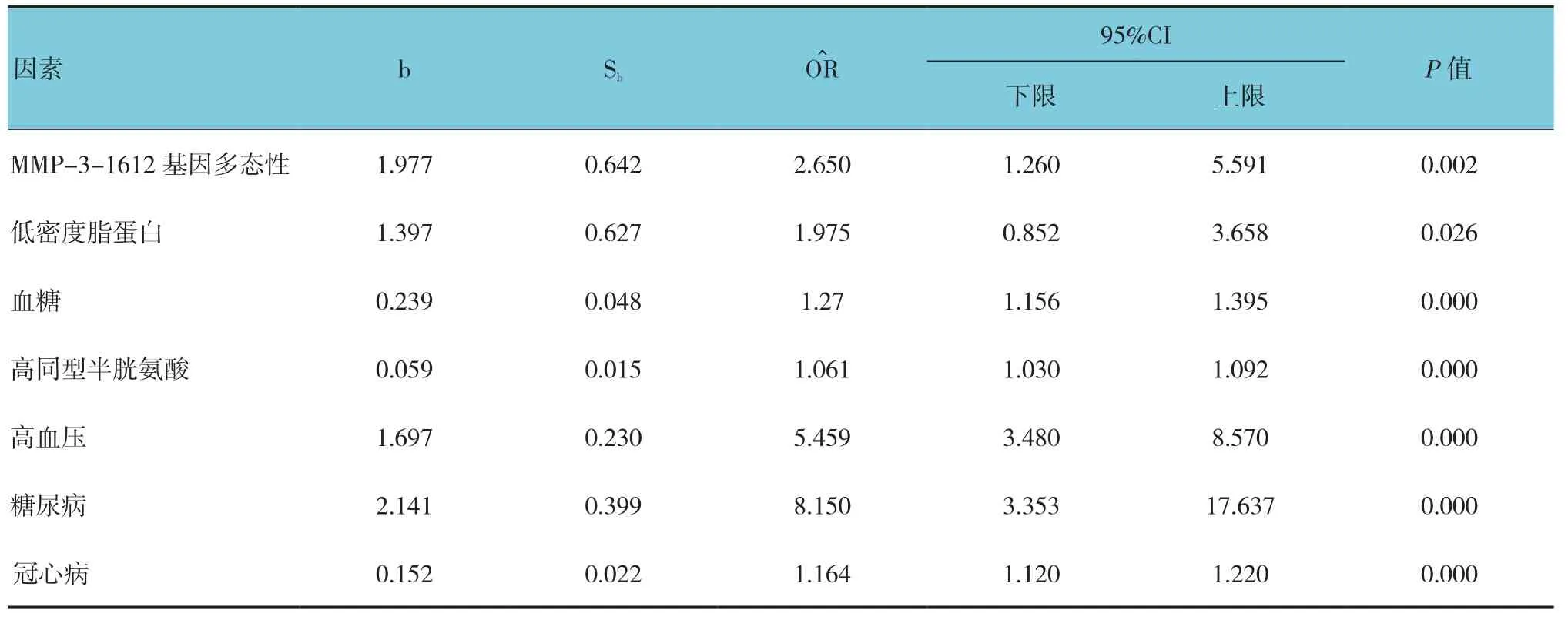
表4 MMP-3-1612位点的Logistic多因素回归分析
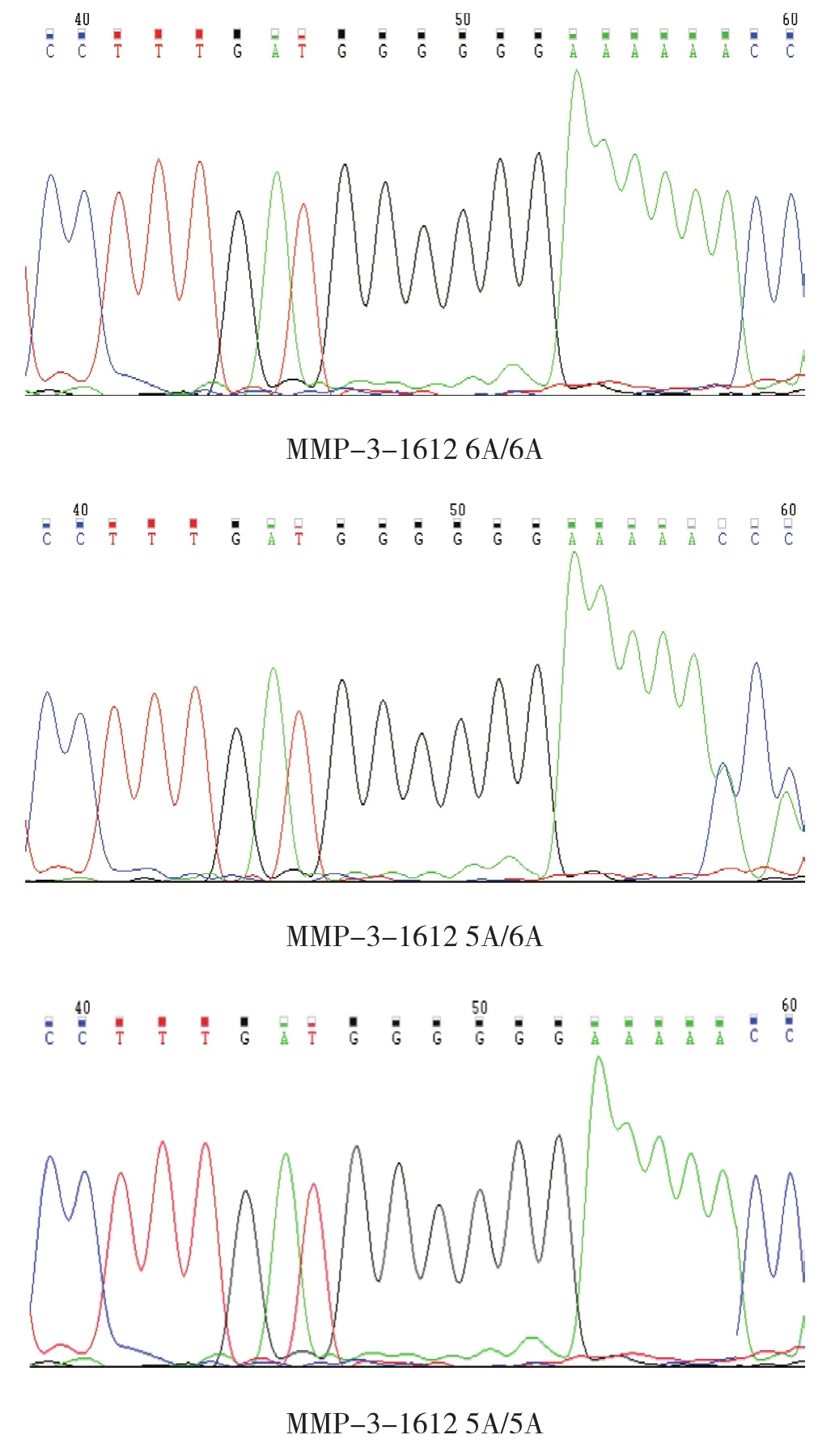
图2 MMP-3-1612位点基因型测序图
3 讨论
缺血性脑卒中的发生与环境因素和多个遗传因素相关,基因变异也是缺血性脑卒中的重要发病因素之一。研究已经表明脑血管疾病发生与年龄、性别、遗传因素有关,且与高血压、吸烟、糖尿病、高血脂症、冠心病、高同型半胱氨酸血症等有直接相关性[7]。、本项研究性别、年龄相匹配的AIS组与对照组比较发现,AIS组的血糖、高密度脂蛋白水平、同型半胱氨酸和对照组比较差异有统计学意义,且AIS组高血压、糖尿病、冠心病患者发病率较对照组增加,这与上述AIS的发病机制及危险因素的研究结果相符。在缺血性脑卒中预防中,可注意控制血压、血糖、血脂、同型半胱氨酸等危险因素,从而减少缺血性脑卒中的发生。
MMPs在组织修复、细胞迁移、血管生成、组织形态形成及生长过程中扮演重要角色,生理条件下,MMPs与金属蛋白酶特定组织抑制剂之间保持平衡,如果平衡破坏可能导致一系列病理过程,如动脉粥样硬化,MMPs具有降解基质蛋白作用,可导致斑块破裂、出血形成血栓,可影响缺血性脑卒中发病过程[2-3]。MMP-3是MMPs家族重要成员,它具有广泛的底物特异性,可降低Ⅱ、Ⅳ和Ⅸ型胶原蛋白、纤维结合蛋白、胶质、蛋白聚糖、板层、和弹性蛋白活性,也可激活其他的MMPs,如胶原酶、基质裂素和明胶酶-B,对结缔组织重塑至关重要[8-9]。
国外的研究如BETON等[10]和GHILARDI等[1]研究发现MMP-3启动子5A/6A等位基因的6A基因与动脉粥样硬化关系密切,其表达增加可加速动脉粥样硬化进程。而FLEX等[11]研究MMP-3启动子基因多态性发现,缺血性脑卒中患者与年龄性别匹配的对照组比较,MMP-3启动子5A/5A基因型在病例组中高于对照组,考虑5A等位基因与急性缺血性脑卒中关系密切,是急性缺血性脑卒中危险因素。国内的研究如黄小亚等[12]研究发现急性动脉硬化型脑梗塞患者MMP-3水平增加,MMP-3启动子5A等位基因可能为急性动脉硬化型脑梗死的遗传易感基因。本研究在调整传统危险因素后,Logistic回归分析显示,MMP-3-1612基因多态性可增加脑梗死的发病风险,提示MMP-3-1612位点基因突变与急性缺血性脑卒中相关。并且研究发现AIS组5A/5A基因型个体数目较对照组增加,认为携带5A/5A基因型的个体可能增加患缺血性脑卒中的发病风险,这与FLEX等[11]和黄小亚等[12]的研究结果一致,而与国外研究不一致,考虑与种族差异有关。分析原因,推测可能由于MMP-3-1612 5A/5A基因导致MMP-3基因转录水平增高,增加了斑块裂解,导致动脉粥样斑块转化为小且更容易破裂的斑块,从而增加急性缺血性脑卒中发生的概率。
马爱军等[13]研究认为,MMP-3-1612血清水平在LAA型脑卒中急性期升高,且5A等位基因携带者(5A/5A+5A/6A)患LAA型脑卒中的风险大于6A/6A基因型携带者,认为MMP-3-1612基因多态性与LAA型脑卒中易感性相关,而本研究对AIS组各亚型进行分析时同样发现,LAA型脑梗死5A/5A基因型数目增加。而LAA型为大动脉粥样硬化型,动脉粥样硬化为发病主要原因,同样证实5A/5A基因可能通过参与动脉粥样硬化过程从而增加急性缺血性脑卒中风险,但因亚组样本有限,仍需大样本研究证实。
本实验结果发现5A/5A基因型可能为急性缺血性脑卒中的遗传危险因素,可能成为急性缺血性脑卒中预防的重要靶点。但由于缺血性脑卒中是一种复杂的疾病,由多个微效易感基因及环境因素共同累加作用,且其危险因素与糖尿病、冠心病等存在重叠,可能会对实验结果产生干扰。本研究急性缺血性脑卒中的易感基因,样本含量较小,有必要在以后研究中扩大样本,进行多位点,并进一步研究不同地区和不同种族的人群进行验证,也可进一步从mRNA和蛋白水平进行更深入的研究,从而更深入的研究及探明该基因对急性缺血性脑卒中发生的作用及其机制,从而为急性缺血性脑卒中的基因水平治疗提供更可靠的理论依据。

