GREB1基因多态性与老年骨质疏松性骨折的相关性研究
郑繁荣 吕鹏飞 唐冲 侯晓飞 张昆 刘正 张清华 栗剑 张光武
北京大学首钢医院骨科,北京 100144
骨质疏松症(osteoporosis,OP)的特征表现为骨量降低,骨微结构破坏,骨强度下降及骨折风险增加[1]。骨质疏松症包括原发性骨质疏松症和继发性骨质疏松症。原发性OP分为绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)、老年骨质疏松症(senile osteoporosis,SOP)和特发性骨质疏松症(idiopathic osteoporosis,IOP)。其中SOP为70岁以后发生的骨质疏松症,又称为Ⅱ型骨质疏松症。人口老龄化已出现在全球许多国家,我国亦不例外。相关资料显示,2014年,中国60岁上的老年人口已突破2亿,预计到2050年左右老年人口将达到全国人口总数的1/3。而相关资料统计显示,SOP及其引发的骨质疏松性骨折(osteoporotic fracture,OF)数量高于心脑血管病及乳腺癌的总和。SOP除了危害老年人的身体健康之外,还严重影响其心理,造成严重的经济负担和社会负担,故全社会应高度重视SOP及其引发的问题。
研究SOP的相关机制对预防SOP及OF的发生具有重要意义。SOP及OF的发生由遗传因素和环境因素共同作用所致,其中遗传因素决定了60%~80%的峰值骨量。自Morrison等[2]于1994年首次提出应用维生素D受体等位基因预测骨密度(bone mineral density,BMD)之后,各国学者相继发现许多其他候选基因。Hegarty等[3]于近期发现乳腺癌雌激素调控基因1(growth regulation by estrogen in breast cancer 1,GREB1)的基因多态性与高加索人群骨密度相关,而目前国内尚未有针对该基因与骨量或骨折风险的相关性研究。故本文就GREB1基因rs10929757、rs5020877位点多态性与SOP的相关性进行研究,对该基因与OF风险的相关性进行探讨。
1 资料与方法
1.1 研究对象
1.1.1一般资料:研究对象来自 2016 年1月至2017 年7月北京大学首钢医院骨科病房、老年干部病房的226例患者。骨折组(骨质疏松性骨折)100例,均为椎体骨折患者,其中男性37例,女性63例;年龄70~94岁,平均(76.190±5.208)岁。对照组(无骨质疏松同时无骨折)126例,其中男性46例,女性80例;年龄70~90岁,平均(75.318±4.300)岁。本研究通过医院伦理委员会批准,研究对象均签署知情同意书。
1.1.2纳入标准:根据原发性骨质疏松症诊疗指南,腰椎或髋部1处及以上部位T≤-2.5SD则定义为骨质疏松。T≤-2.5SD且发生骨折的患者为骨折组。腰椎或髋部所有部位T均>-2.5SD的患者为对照组,两组患者年龄≥70岁;理解本研究的目的及要求并签署知情同意书。
1.1.3排除标准:伴随严重合并症;合并影响骨代谢疾病,包括甲状旁腺功能亢进、甲状旁腺功能减退、垂体疾病等;近1年应用双膦酸盐类药物;近6个月使用影响骨代谢药物,包括骨化三醇、雌激素、活性维生素D、降钙素、类固醇激素等。
1.2 研究方法
1.2.1骨密度测定:受试者取仰卧位,应用双能X线骨密度仪(QDR-4500;Hologic,Inc.,Waltham,MA,USA)测量髋部和腰椎骨密度值。
1.2.2SNP分型:所有患者清晨空腹时采集静脉血2 mL,置于EDTA 抗凝管中,存于-80 ℃冰箱等待提取DNA。外周血白细胞DNA提取采用酚/氯仿法,提取后存于-20 ℃冰箱。IGF-1基因rs2229765、rs35767位点引物由上海生物工程技术有限公司合成。rs10929757位点上游引物:5′-GCATCTAGGTGGTAGCCGAG-3′,下游引物:5′-GCTCACACCTCAGGGAAAGC-3′;rs5020877位点上游引物:5′-TCTCTCTTTCAGGAGCACTTTC-3′,下游引物:5′-AGAAAGATTCAGCCTTTCCTCT-3′。应用Snapshot技术进行基因分型。核心反应体系包扩测序酶、荧光标记的 ddNTP、紧挨多态位点5′-端不同长度的延伸引物、包含SNP位点的PCR产物模板。通过反应,引物延伸一个碱基即终止,再经测序仪检测,根据峰的移动位置确定该延伸产物对应的SNP位点,根据峰的颜色可得知掺入的碱基种类,从而确定该样本的基因型。
1.3 统计学处理
2 结果
2.1 两组患者的基本情况
两组研究对象在性别、年龄和体质量指数上差异无统计学意义(P>0.05)。两组各部位BMD值比较,骨折组均低于对照组,差异有统计学意义(P<0.01)。详见表1。
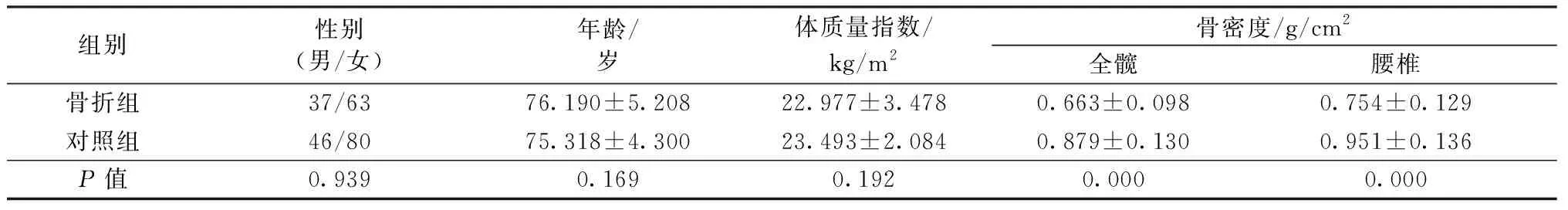
表1 两组患者一般情况比较
2.2 两组患者在rs10929757位点等位基因频率和基因型频率比较
两组患者等位基因和基因型均符合遗传学Hardy-Weinberg定律(P>0.1)。骨折组C、A等位基因频率分别为49.0%、51.0%,对照组C、A等位基因频率分别为51.6%、48.4%,两组比较差异无统计学意义(P>0.05)。骨折组CC、CA、AA基因型频率分别为23.0%、52.0%、25.0%,对照组CC、CA、AA基因型频率分别为23.8%、55.6%、20.6%,两组比较差异无统计学意义(P>0.05)。
2.3 两组男性患者在rs10929757位点等位基因频率和基因型频率比较
两组男性患者等位基因和基因型均符合遗传学Hardy-Weinberg定律(P>0.1)。骨折组C、A等位基因频率分别为36.5%、63.5%,对照组C、A等位基因频率分别为52.2%、47.8%,两组比较差异有统计学意义(P<0.05)。骨折组CC、CA、AA基因型频率分别为13.5%、45.9%、40.5%,对照组CC、CA、AA基因型频率分别为28.3%、47.8%、23.9%,两组比较差异无统计学意义(P>0.05)。
2.4 两组女性患者在rs10929757位点等位基因频率和基因型频率比较
两组女性患者等位基因和基因型均符合遗传学Hardy-Weinberg定律(P>0.1)。骨折组C、A等位基因频率分别为56.3%、43.7%,对照组C、A等位基因频率分别为51.2%、48.8%,两组比较差异无统计学意义(P>0.05)。骨折组CC、CA、AA基因型频率分别为28.6%、55.6%、15.9%,对照组CC、CA、AA基因型频率分别为21.3%、60.0%、18.8%,两组比较差异无统计学意义(P>0.05)。
2.5 两组患者在rs5020877位点等位基因频率和基因型频率比较
两组患者等位基因和基因型均符合遗传学Hardy-Weinberg定律(P>0.1)。骨折组G、A等位基因频率分别为6.9%、93.1%,对照组G、A等位基因频率分别为6.3%、93.7%,两组比较差异无统计学意义(P>0.05)。由于GG基因型仅有1例,且GA型少于AA型,故将GG型与GA型合并计算。骨折组GG+GA、AA基因型频率分别为12.0%、88.0%,对照组GG+GA、AA基因型频率分别为11.9%、88.1%,两组比较差异无统计学意义(P>0.05)。
2.6 两组男性患者在rs5020877位点等位基因频率和基因型频率比较
两组男性患者等位基因和基因型均符合遗传学Hardy-Weinberg定律(P>0.1)。骨折组G、A等位基因频率分别为10.1%、89.9%,对照组G、A等位基因频率分别为7.0%、93.0%,两组比较差异无统计学意义(P>0.05)。骨折组GG+GA、AA基因型频率分别为16.2%、83.8%,对照组GG+GA、AA基因型频率分别为13.0%、87.0%,两组比较差异无统计学意义(P>0.05)。
2.7 两组女性患者在rs5020877位点等位基因频率和基因型频率比较
两组女性患者等位基因和基因型均符合遗传学Hardy-Weinberg定律(P>0.1)。骨折组G、A等位基因频率分别为5.0%、95.0%,对照组G、A等位基因频率分别为6.0%、94.0%,两组比较差异无统计学意义(P>0.05)。骨折组GG+GA、AA基因型频率分别为9.5%、90.5%,对照组GG+GA、AA基因型频率分别为11.3%、88.7%,两组比较差异无统计学意义(P>0.05)。
2.8 rs10929757位点不同基因型患者骨密度比较
在rs10929757位点,总体、男性和女性患者中不同基因型患者骨密度值比较差异无统计学意义(P>0.05),见表2。
2.9 rs5020877位点不同基因型患者骨密度比较
在rs5020877位点,总体、男性和女性患者中不同基因型患者骨密度值比较差异无统计学意义(P>0.05),见表3。

表2 rs10929757位点不同基因型患者骨密度比较(g/cm2)
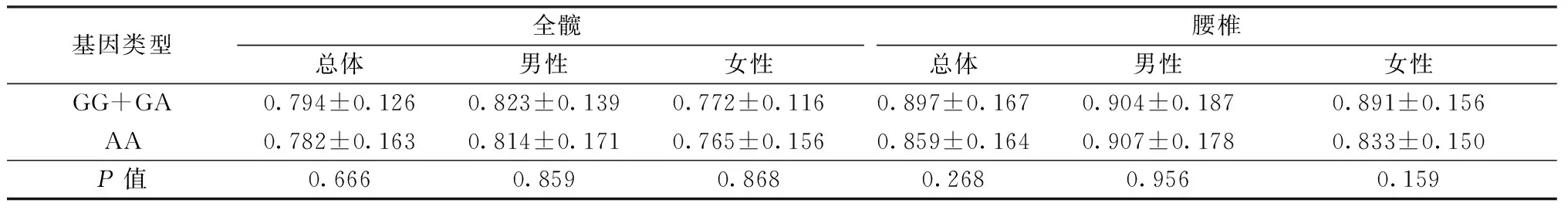
表3 rs5020877位点不同基因型患者骨密度比较(g/cm2)
3 讨论
据估计,2010年中国在OF的花费接近100亿美元,预计2035年增加1倍,而2050年将达到254亿美元[4]。并且OF患者术后仍有较高的再骨折风险[5]。因此,应积极研究OP和OF的发生机制,并对其危险因素进行干预,以降低OF造成的相关医疗费用。种族、高龄、绝经后女性、OF家族史为OP的不可控危险因素,不健康的生活方式、体质量指数过低等为可控危险因素。为尽可能减少混杂因素干扰,本研究纳入患者年龄均大于70岁,并人为控制性别比例及体质量指数,使两组研究对象具有可比性。临床上将BMD检查作为诊断OP的金标准,已有大量研究证实了相关基因与BMD的相关性[6-7]。故本研究以BMD检查结果分组,将全身1处及以上部位出现T≤-2.5SD且发生骨折的患者定为骨折组,将全身无1处部位出现T≤-2.5SD且无骨折的患者定为对照组。
国内外许多研究显示,女性在绝经后发生OP及OF的风险随绝经年限增加而呈现出明显增高的趋势[8-9]。雌激素水平是女性BMD的主要影响因素。正常女性BMD在30岁左右达到峰值,在围绝经期平缓下降;而在绝经后,由于雌激素水平明显降低,使得成骨细胞活性绝对下降,破骨细胞活性相对增强,于是血钙水平明显增加。在负反馈作用下,甲状旁腺激素的分泌受到抑制。由于维生素 D 的内分泌系统主要受甲状旁腺激素调节,故维生素 D的合成随之受到影响[10-11]。而维生素D作为影响钙离子吸收的因素之一[12],其降低将造成钙离子在消化道内吸收减少,进一步造成骨形成减少,骨吸收增加,导致BMD迅速下降。随着绝经年限的增加,机体各脏器功能亦逐渐减弱,细胞衰老造成雌激素分泌逐年减少,进一步减少维生素D和钙离子的吸收,骨吸收和骨形成失衡愈发显著,发生OF的概率随即增加[13]。因此,鉴于绝经后女性为OP的独立危险因素,本研究亦根据性别进行了亚组分析。
GREB1基因是一种激素反应性基因,亦为雄激素、雌激素信号通路中常见的靶基因[14]。该基因定位于2p25.1,由雌激素诱导产生作用,并直接由雌激素受体调控其表达[15]。在雌激素受体阳性的乳腺癌细胞中,GREB1的表达与月经周期内的雌激素水平密切相关[16]。GREB1基因的cDNA有至少3个不同的非编码5’端外显子,而这些外显子的转录依赖雌激素的调控,提示存在多个雌激素诱导型启动子。GREB1亦可调控雄激素,雄激素受体反应元件又可促进GREB1的表达,而抑制GREB1可阻断雄激素所诱导的组织生长[17]。雌激素和雄激素都可调节骨重建使骨结构保持完整。
Hegarty等[3]对477个无血缘关系的绝经后女性的研究发现,在rs10929757位点,A等位基因频率为38%,A等位基因携带者具有更高的股骨颈部BMD值。本研究中,在rs10929757位点,在总研究对象中和男性人群中,发现骨折组A等位基因频率均大于对照组。此外,在两组男性患者的比较中,骨折组为63.5%,对照组为47.8%,差异具有统计学意义(P<0.05)。两组患者在总体和各亚组中各基因型比较差异均无统计学意义(P>0.05)。在总体、男性和女性患者中分别比较该位点不同基因型患者BMD值,发现男性A等位基因携带者具有更低的全髋部和腰椎部BMD值,而女性A等位基因携带者具有更高的全髋部BMD值,女性AA型具有更高的腰椎BMD值,但以上结果均无明显差异,这可能与样本量少有关。本研究说明老年男性在rs10929757位点A等位基因携带者椎体OF风险更高,该基因位点多态性存在性别差异和种族差异。
Hegarty等[3]同时对来自229个家庭的508个成员的研究发现,在rs5020877位点,G等位基因频率为9%,G等位基因携带者具有更高的腰椎和股骨颈部BMD值。本研究中除男性骨折组的G等位基因频率(10.1%)以外,其余均低于Hegarty研究的结果。两组患者在总体和亚组中GG、GA基因型和AA型的比较差异均无统计学意义(P>0.05)。在总体、男性和女性患者中分别比较该位点不同基因型患者BMD值,发现G等位基因携带者无论男女均具有较高的髋部BMD值,女性G等位基因携带者具有更高的腰椎BMD值,但差异均无统计学意义(P>0.05),增加样本量可能出现显著区别。因此,本研究未发现rs5020877位点基因多态性与老年OF相关。
综上所述,本研究提示老年男性在rs10929757位点A等位基因携带者椎体OF风险更高,未发现rs5020877位点多态性与老年OF的相关性。然而,本研究具有以下局限性:首先,样本量较小,代表性不足,未能进行家系研究进一步证实相关性,这可能是造成某些阴性结果的原因;其次,未能综合比较不同骨折类型、合并症、生活方式、环境以及雌激素水平等因素;此外,GREB1基因影响骨量的分子机制仍需进一步阐明。因此,下一步需扩大样本量,并进行更广泛和深入的研究,进一步探讨OP的发生机制,为预防OF提供理论基础。

