衰老骨髓间充质干细胞中端粒短缩与成骨能力下降相关性研究
林源 陶天遵 陶树清 王声雨 李超
哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 150081
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)经常被用作组织工程学的种子细胞,很容易从成人的骨髓中获得,具有多能性,如分化为软骨细胞、成骨细胞和成肌细胞[1],可作为骨骼修复的主要来源[2],通过细胞丢失和新细胞生成替代之间的严格平衡,人体的组织、器官可以保持稳态[3-4]。然而,随着衰老和退行性疾病,这种平衡逐渐下降,导致组织完整性和功能受损,同时损伤的是再生能力降低[5]。因此,随着衰老,BMSCs的功能和数量下降导致BMSCs修复骨骼和维持骨骼稳态的能力受损[6-8]。以往众多研究已经证实,细胞的衰老过程总是伴随着端粒的缩短[9]。氧化应激和细胞多次传代均是诱导BMSCs衰老的有效途径,但其诱导衰老机制尚不清楚。
在干细胞中,ATM激酶的短缺可能导致端粒的缩短[10]。Lee等[11]发现,一种PARP1的强抑制剂Olaparib可以促进ATM激酶的活化,进而维持端粒长度。本研究拟通过实验观察氧化应激、多次传代及Olaparib对BMSCs端粒长度的影响,以及端粒长度变化与BMSCs增殖和分化能力的相关性。
1 材料和方法
1.1 动物模型选择及细胞的原代培养
选取30只3月龄、重量250~300 g的雄性SD大鼠,游离双侧股骨,暴露髓腔,用培养液进行冲洗。将冲出的细胞收集在含有5%CO2的培养箱中,37 ℃孵育3 d,然后置换培养液。之后,每3 d更换溶液,并使用倒置相差显微镜观察细胞生长的变化。
1.2 实验设计及分组
为了研究氧化应激对细胞的影响,将其分为3组,即对照组、100 μmol/L H2O2-2H组(细胞用100 μmol/L H2O2处理2 h)和100 μmol/L H2O2-4H组(细胞用100 μmol/L H2O2处理4 h)。处理后的细胞培养24 h后进行形态学观察、β-半乳糖苷酶染色、细胞增殖检测、端粒长度测定和碱性磷酸酶活性检测。
为了检测传代次数对BMSCs衰老、增殖和分化的影响,将细胞分为4组(P2、P4、P8和P16),当细胞传代至特定代时进行细胞形态观察、β-半乳糖苷酶染色、检测细胞增殖,并测量端粒长度和碱性磷酸酶活性。
为了检测端粒长度对BMSCs衰老、增殖和分化的影响,将细胞分为4组,即对照组、100 μmol/L H2O2-4H组、3 μmol/L Olaparib-24H组(细胞用3 μmol/L Olaparib处理24 h)和100 μmol/L H2O2-4H+3 μmol/L Olaparib组(Olaparib在加入H2O2之前2 h添加到BMSCs中,与H2O2作用4 h后,再使用Olaparib处理细胞 24 h)。
1.3 试剂和抗体
研究中涉及的动物饲养和动物实验均经动物实验伦理委员会的批准。β-半乳糖苷酶试剂盒(碧云天);细胞培养用试剂:DMEM、胎牛血清(FBS)和0.25%胰蛋白酶(Gibco,Grand Island,NY,USA);CCK-8(Cell Counting Kit-8,Dojindo,日本);碱性磷酸酶试剂盒(南京建成科技有限公司)。
1.4 细胞形态学观察
用100 μmol/L H2O2溶液处理BMSCs 2 h和4 h后,培养24 h,在倒置显微镜下观察细胞形态,检测扁平肥厚细胞的数量及其在整体细胞中的占比。
1.5 CCK-8分析
将2 000个细胞接种到96孔板的孔中以温育过夜。用新鲜的DMEM-F12培养基替换原始培养基,然后培养2周,在此期间每3 d更换一次培养基。此后,将96孔板的每个孔中的培养基换成100 μL DMEM/F12培养基,然后向每个孔中加入10 μL反应剂。再将细胞在37 ℃培养箱中孵育1 h,使用酶标仪检测OD450值。
1.6 β-半乳糖苷酶染色
将BMSCs在6孔板中培养,使用β-半乳糖苷酶的固定液在室温下固定15 min,然后使用PBS洗涤3次。然后使用β-半乳糖苷酶染色溶液将BMSCs染色12 h。染色后,将细胞置于倒置显微镜下观察视野中总细胞中被扩增200倍的阳性细胞的比例。
1.7 端粒长度分析
使用高纯度PCR模板制备试剂盒(德国柏林罗氏公司)分离BMSCs的基因组DNA,并使用分光光度法检测浓度以及DNA的纯化。为了分析端粒长度,使用限制性酶I(New England Biolabs,Ipswich,MA,USA)来消化提取的20 μg DNA,然后使用0.8%的琼脂糖凝胶在60 V的恒定电压下电泳16 h分离上面的DNA。首先将凝胶中的DNA转移到由标准柠檬酸钠-盐酸缓冲液填充的毛细管中,然后转移到阳离子尼龙膜(Osmonics,Minnetonka,MN,USA)上,接着孵育14 h。将尼龙膜用柠檬酸钠缓冲液洗涤3次后,将尼龙膜在120 ℃下加热30 min。 然后将膜末端的限制性片段与地高辛标记的端粒(Roche,Berlin,Germany)的寡核苷酸探针杂交。使用缓冲液洗脱额外游离的地高辛标记的探针,然后用脱脂奶堵塞膜以覆盖由非特异性抗体传播的位点。将地高辛与碱性磷酸酶的特异性抗体和CDP-Star(Roche,Berlin,Germany)化学发光底物用于检测地高辛探针的强度。将具有地高辛抗性的抗体溶液(Roche,Germany)用于孵育30 min。用缓冲液洗涤膜后,将CDP-Star加到含有面朝上的DNA的表面上并均匀铺展在整个表面,在无光情况下温育5 min。然后,在暗室进行显色,用Image QuantTM RT ECLTM处理获得图像,并使用Telometric 1.2软件计算端粒长度。
1.8 碱性磷酸酶的活性分析
在6孔板中培养的细胞(1×105/孔)使用含有10% v/v FBS、0.1 μmol/L地塞米松,50 mg/L抗坏血酸和10 mmol/L β-甘油磷酸钠的成骨诱导培养基进行成骨诱导培养。培养14 d后,分析碱性磷酸酶的活性。
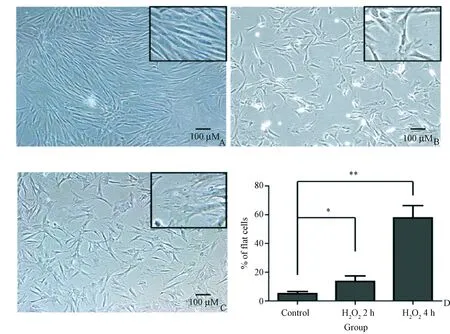
图1 H2O2溶液对骨髓间充质干细胞形态的影响。A:对照组;B:100 μmol/L H2O2-2 h组;C:100 μmol/LH2O2-4 h组,倒置相差显微镜下的细胞;D:平和松散状老年细胞在各组中的百分比。*P<0.05,**P<0.01,n=6。
收集上述步骤中的BMSCs后,使用0.05% triton和超声技术(冰浴,150 W,3 s间隔)进行细胞裂解。然后,根据试剂盒(南京建成科技有限公司)说明,使用酶标仪(BMG,Labtech,Ortenberg,德国)在405 nm波长处检测碱性磷酸酶。
1.9 统计学处理
不同组之间通过方差分析进行比较,并且使用SPSS 15软件进行统计分析。如果方差分析的差异具有统计学意义,应用Bonferroni校正进行成对比较。P<0.05表明差异有统计学意义。
2 结果
2.1 氧化应激对BMSCs形态的影响
为了验证氧化应激是否会导致间质干细胞的衰老,本研究使用100 μmol/L H2O2溶液对细胞进行处理。分别孵育2 h和4 h后,将细胞培养24 h,然后在倒置显微镜下进行形态学观察。结果显示,对照组的BMSCs表现为规则的梭形(图1 A),而用H2O2溶液处理的BMSCs中,尤其是用H2O2溶液处理4 h的BMSCs中,扁平状、分布稀疏的老年细胞数量显著增加(图1B、1C,P<0.05)。与对照组相比,扁平状、分布稀疏的BMSCs在所有细胞中的比例在用H2O2溶液处理2 h后可增加到57.85%,表明氧化应激可加速BMSCs的衰老(图1D)。
2.2 氧化应激导致BMSCs快速衰老,增殖减少,端粒长度缩短,碱性磷酸酶活性降低
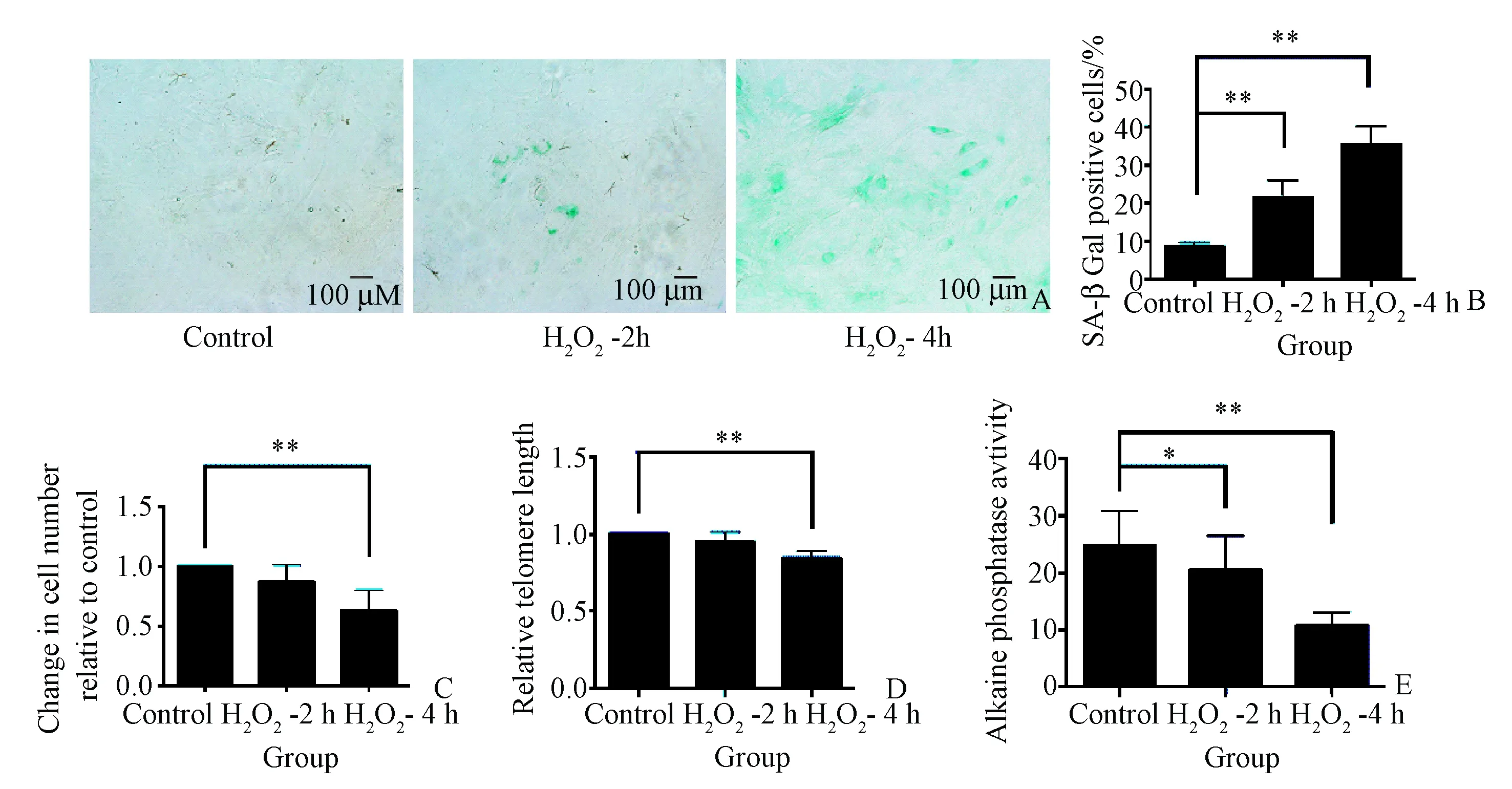
图2 H2O2溶液对骨髓间充质干细胞的衰老、增殖、端粒长度及碱性磷酸酶活性的影响。A:β-半乳糖苷酶染色;B:β-半乳糖苷酶染色阳性细胞的百分比;C:细胞增殖CCK-8检测;D:端粒长度检测;E:细胞内碱性磷酸酶活性。*P<0.05,**P<0.01,n=6。
β-半乳糖苷酶染色是检测细胞衰老的经典方法。用H2O2溶液处理BMSCs后,BMSCs在β-半乳糖苷酶染色阳性率明显增加。细胞核周围有天蓝色颗粒(图2 A、2B,P<0.05)。这代表了β-半乳糖苷酶染色的阳性结果。CCK-8分析显示,H2O2溶液处理后,BMSCs的增殖减少,OD值低于对照组(图2C),其中100 μmol/L H2O2-2H组和100 μmol/L H2O2-4H组分别为对照组的87.17%和63.17%。在100 μmol/L H2O2-4H组中,端粒长度比对照组缩短约16%(图2D,P<0.05);在细胞分化方面,BMSCs中碱性磷酸酶活性显著降低(图2E,P<0.05),表明氧化应激不仅加速了细胞的衰老,而且降低了成骨分化能力。
2.3 过度传代导致BMSCs快速衰老,增殖减少,端粒长度缩短,碱性磷酸酶活性降低
随着传代次数的增加,β-半乳糖苷酶染色的BMSCs阳性率随着传代次数的增加而增加。 P8组和P16组BMSCs的阳性率分别比P2组提高了21.2%和35%(图3 A、3B,P<0.05)。 细胞的增殖能力也随传代次数增多出现减弱。P8组和P16组BMSCs增殖能力显著下降(图3C)。 P16组BMSCs的端粒长度比P2组缩短约9%(图3D,P<0.05),但P8组、P4组和P2组的端粒长度比较没有显著缩短。与用H2O2溶液处理的细胞类似,P16组BMSCs的碱性磷酸酶活性也显著降低(图3E,P<0.05),表明细胞的成骨分化能力随着传代数量的增加而减弱。
2.4 抑制端粒长度缩短可缓解氧化应激引起的细胞衰老和分化能力下降
本研究发现Olaparib可降低由H2O2溶液引起的β-半乳糖苷酶染色阳性率的增加(图4 A,P<0.05),表明Olaparib可缓解BMSCs的衰老,并增强其增殖能力(图4B,P<0.05)。为了证实端粒长度对细胞衰老和细胞分化能力的影响,本研究使用PARP1抑制剂Olaparib激活ATM激酶以抑制端粒长度的缩短。与单独使用H2O2溶液4 h相比,Olaparib+H2O2溶液可显著抑制端粒长度的缩短(图4C,P<0.05)。碱性磷酸酶的活性测定显示,应用Olaparib组可以增加H2O2溶液导致降低的碱性磷酸酶活性,增强细胞成骨分化能力(图4D,P<0.05)。
3 讨论
本研究通过观察细胞形态、β-半乳糖苷酶染色和细胞增殖情况发现,H2O2溶液引起的氧化应激可以加速BMSCs的衰老。氧化应激一直是诱导细胞衰老的常用模型,并且已经证实用H2O2溶液处理软骨细胞和成纤维细胞可以诱导衰老[12],这表明BMSCs的衰老与体细胞一样可以由氧化应激引发。然而,H2O2处理后的BMSCs仍能增殖,这与软骨细胞增殖停滞不同。此外,BMSCs的衰老诱导需要使用100 μmol/L H2O2处理4 h,而软骨细胞仅需要2 h的处理便出现显著衰老,这表明对氧化应激,BMSCs显示出比体细胞更好的耐受性。

图3 不同代次的BMSCs衰老程度、增殖能力、端粒长度和碱性磷酸酶活性比较。A:β-半乳糖苷酶染色;B:β-半乳糖苷酶染色中阳性细胞的百分比;C:由CCK-8检测到的细胞增殖;D:检测端粒长度;E:细胞中碱性磷酸酶的活性。*P<0.05,**P<0.01,n=6。
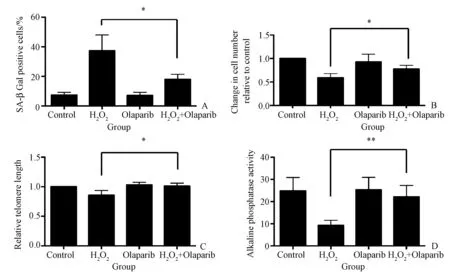
图4 端粒长度短缩后BMSCs的衰老、增殖、端粒长度和碱性磷酸酶活性受到抑制。A:β-半乳糖苷酶染色阳性的百分比;B:细胞增殖CCK-8检测;C:端粒长度检测;D:细胞内碱性磷酸酶活性。*P<0.05,**P<0.01,n=6。
另外,本研究发现细胞传代次数的增加可以引起BMSCs的衰老、增殖能力降低、端粒长度缩短和成骨分化下降。与H2O2的作用机理类似,在细胞体外培养过程中,培养箱中高浓度的氧气可引起细胞内活性氧(reactive oxygen species,ROS)的积累,激活应激信号通路,从而通过氧化应激导致细胞衰老[13]。因此,为了抑制或延缓体外培养细胞的衰老,应该在培养箱中保持低浓度的O2[14]或加入抗氧化剂[15]。端粒长度与细胞衰老相关,而氧化应激可以改变端粒末端长度。以往研究表明,氧化应激可以促进软骨细胞和成纤维细胞中端粒的缩短[12],本研究发现氧化应激在BMSCs中也起到相似的作用。然而,一些研究报道称H2O2的短期刺激不能引起成纤维细胞端粒长度缩短[16],表明端粒长度缩短是在染色体复制中逐渐诱导出现的。因此,为了消除过度短时间培养的影响,本研究安排了使用H2O2刺激细胞后培养两周后对端粒长度进行分析。通常认为,由氧化应激引起的DNA破裂是介导端粒缩短的作用机制,其中端粒中的重复片段比非重复片段更易受到氧化应激的攻击。例如,由于ROS的攻击,GGG的重复序列经常发生破裂[17]。DNA双链断裂可以同时阻止细胞增殖并促进自我修复系统。因此,本研究发现,随着细胞衰老的进展,细胞增殖能力逐渐减弱。由于单链断裂修复的效率相对较低,而DNA中单链断裂可能导致端粒缩短[18]。Saeed等[19]发现端粒酶是维持端粒长度和端粒消耗的关键因素,端粒酶基因缺失可导致BMSCs成骨分化功能紊乱,导致细胞衰老。一种PARP1的强抑制剂Olaparib可以促进ATM激酶的活化,进而维持端粒长度[11]。本研究选择了Olaparib进行干预,来抑制BMSCs中端粒长度的缩短。发现Olaparib不仅可以抑制细胞的衰老,还可以增强细胞增殖和成骨分化,可作为端粒对BMSCs衰老和细胞功能影响的充分证据。Olaparib主要通过增加ATM激酶的活性来维持端粒的长度。在哺乳动物细胞中,活化的ATM激酶可以通过促进端粒相关蛋白TRF1的磷酸化来激活端粒体的功能,从而维持端粒的长度[20]。本研究发现,由H2O2或过量传代引起的细胞衰老可能导致碱性磷酸酶(成骨分化的标志物)的活性降低,并且通过抑制端粒长度的缩短延缓衰老可以部分地反转碱性磷酸酶活动的降低。在笔者以前的实验中还发现,随着供体年龄的增加,BMSCs的成骨分化能力下降,这与本研究的结果一致[21]。随着年龄的增加,BMSCs的质量和数量的下降也被证实[22]。因此,分析干细胞的增殖及成骨能力下降与端粒短缩有相关性。
综上,本研究发现氧化应激和传代次数的增加可以引起BMSCs的端粒短缩,进一步导致干细胞衰老、成骨分化能力降低。因此,抑制端粒缩短不仅可以减少BMSCs衰老,促进干细胞增殖,还可以增加BMSCs的成骨分化能力,为骨质疏松等衰老性疾病提供新的治疗方向。

