超声波处理对西瓜汁品质的影响
郑炯,龚瑜,曾瑞琪,张甫生
1(西南大学 食品科学学院,重庆,400715) 2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715)
鲜榨果蔬汁又可以称为非浓缩果汁,其口感、风味和营养成分与新鲜水果非常接近,鲜榨果蔬汁因其品质高、纯天然、营养丰富且加工少的特点受到广泛消费者的青睐[1]。但鲜榨果蔬汁的水分活度高、营养物质丰富,微生物极易在其中繁殖,营养物质降解变形从而导致鲜榨果蔬汁的感官品质与营养价值降低[2]。为了延长鲜榨果蔬汁的货架期,保证鲜榨果蔬汁的安全性、感官性能以及功能性质,热加工技术被用于鲜榨果蔬汁的处理中,但经过热处理的鲜榨果蔬汁通常会有蒸煮味从而影响产品的食用口感,同时热处理会引起果蔬汁中的维生素、类胡萝卜素以及酚类物质等营养成分的损失[3-4]。因此,探索非热力加工技术已成为鲜榨果蔬汁领域中的研究热点。
超声波是一种频率高于20 kHz,超越人类听觉上限的机械波,因其对营养和活性因子的破坏率低、能耗小、操作简单的特点已被广泛应用于活性物质的提取[5-8],大分子物质的改性[9-11]以及食品品质的检测[12-13]。超声波技术在果蔬汁领域中的应用已日趋广泛,其应用于鲜榨果蔬汁的加工不仅可避免由热加工所造成的风味及营养成分的缺失,同时也能达到减灭酶活性的作用[14-17]。
采用热力加工方式处理西瓜汁,西瓜中易挥发的热敏物质在加热过程中会产生浓重的蒸煮味并引起絮凝沉淀和颗粒悬浮,从而影响西瓜汁的食用品质,为突破这一瓶颈,不少学者利用超高压技术[18]、果蔬汁间的复配[19]以及高压二氧化碳技术[20]等方法处理西瓜汁,均发现能较好地避免热加工带来的弊端。目前利用超声波技术处理西瓜汁的研究报道还较少, 因此为探究超声波处理对鲜榨西瓜汁品质的影响,本文以西瓜汁为研究对象,经超声波处理后,考察其相关酶活性及理化性质的变化情况,以期为超声波技术在果蔬汁加工中的应用提供实验支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
早春红玉西瓜,购买于重庆市北碚天生丽街永辉超市。
1.1.2 试剂
聚乙烯吡咯酮(PVPP),NaH2PO4、Na2HPO4、邻苯二酚、H2O2、愈创木酚、NaOH、酚酞、草酸、KIO3、可溶性淀粉、KI、抗坏血酸、NaHCO3、2,6-二氯靛酚溶液、没食子酸、Folin-Ciocalteu试剂、NaCO3、甲醇、无水乙醇(均为分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
FA2004A电子分析天平,上海精天电子仪器有限公司;C91T榨汁机,九阳股份有限公司;JY96-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;722可见分光光度计,上海右一仪器有限公司;5810R型冷冻离心机,美国艾本德公司;DDS-608智能电导率仪,成都世纪方舟科技有限公司;WTY手持折光仪,深圳市科鑫化玻仪器有限公司;DV2TRV黏度计,美国Brookfield公司;UltraScan PRO型测色仪,美国HunterLab公司。
1.3 方法
1.3.1 西瓜样品的处理
用无菌刀取可食部位至瓜皮不见红色,利用榨汁机制备鲜榨西瓜汁,四层纱布过滤取汁。空白对照组:取50 mL西瓜汁置于250 mL三角瓶中,在室温下放置备用。实验对照组:取50 mL西瓜汁于250 mL三角瓶中置于90 ℃的恒温水浴锅中加热2 min,处理完后立即置于冰水浴中冷却至常温。超声波处理参照程新峰[21]的方法并有所改动。取50 mL西瓜汁置于100 mL烧杯中,将烧杯放置于超声波细胞破碎室内,将直径为2 cm的探头伸入样品中约3~5 cm,使用恒低温水浴,保持样品温度处于室温,放好样品后将细胞破碎室密封。设置超声波处理功率为100、200、300 W,每个功率分别进行10、20和30 min处理,超声处理时工作时间5 s,休息5 s。超声处理后将西瓜汁转移到250 mL三角瓶中,置于室温下待测。
1.3.2 测定项目
1.3.2.1 多酚氧化酶(PPO)的活性测定
取20 mL西瓜汁,加入1% PVPP,4 ℃下放置1 h,在4 ℃、10 000 r/min下离心20 min后, 取上清液备用。取含有0.1 mol/L邻苯二酚的pH为6.0的磷酸缓冲液2.4 mL,加入0.6 mL上清液,反应3 min后,在25 ℃,420 nm的波长下测定其吸光值并且每隔30 s记录1次,取开始的线性部分用于计算。
一个PPO酶活性单位定义为1 mL西瓜汁中1 min 内吸光值得变化0.001个单位。通常用相对酶活表示为:
(1)
式中:A表示处理后样品PPO活力;A0表示对照组样品PPO活力。
1.3.2.2 过氧化物酶(POD)的活性测定
取10 mL西瓜汁加入0.01 g/mL PPVP,在 4℃、10 000 r/min下离心20 min,取上清液备用。取pH 值为6.0的磷酸缓冲液2.7 mL,0.05 mL 的体积分数为0.5%的H2O2,0.2 mL体积分数为2%的愈创木酚和0.05 mL上清液。反应 3 min后,在25 ℃、470 nm的波长下测定吸光度值,每隔30 s记录1次,取开始的线性部分用于计算。POD的相对酶活可表示为:
(2)
式中:A表示处理后样品POD活力;A0表示对照组样品POD活力。
1.3.2.3 可溶性固形物(TSS)的测定
采用手持折光仪测定,打开盖板后用擦镜纸擦净棱镜,先用蒸馏水进行校正,然后将待测样品滴于棱镜表面,轻轻合上盖板后将进光板对准光源,通过目镜读数,结果以 % 表示。
1.3.2.4 可滴定酸(TA)的测定
取5 mL西瓜汁样品于100 mL的容量瓶中定容,用新煮沸过并冷却的蒸馏水定容,定容后将样品转移到250 mL三角瓶中,滴3滴酚酞指示剂,用0.05 mol/L NaOH溶液滴定至溶液呈浅红色,且30 s内不褪色。TA按l L西瓜汁中所含可滴定酸含量表示:
(3)
式中:V1表示消耗的NaOH标准液的体积,mL;c表示NaOH标准液的摩尔浓度,0.05 mol/mL;V2表示样品的体积,mL;0.064表示折算系数,以柠檬酸计。
1.3.2.5 电导率的测定
采用DDS-608智能电导率仪测定,测定前先对电导率仪进行校正,测定时,吸取25 mL样品于50 mL的烧杯中,将电极置于待测样品中,稳定后进行读数。
1.3.2.6 色泽的测定
色差仪开机后,用黑白板进行校正,校正结束后开始测定待测样品的L*、a*、b*值,每个样品测6次,并计算ΔE值,其中L*表示明度;-a*表示绿色,+a*表示红色;-b*表示蓝色,+b*表示黄色,用ΔE表示总色差。规定ΔE值<1.5表示差异较小;在1.5和3.0之间表示存在明显的差异;ΔE值>3表示存在极显著差异[22]。ΔE的计算公式如下:
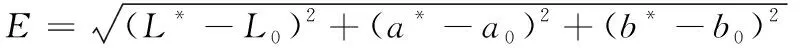
(4)
式中:L*、a*、b*表示处理后样品的测定值;L0、a0、b0表示对照组样品的测定值。
1.3.2.7 黏度的测定
参考田政等[23]的方法并稍有改动,用布氏黏度计测定西瓜汁的黏度,将处理好的样品静置于25 ℃恒温水浴中,选择3号转子,设置转速为60 r/min,在25 ℃条件下测定西瓜汁黏度,稳定后(约30 s)读数,记录西瓜汁黏度。
1.3.2.8L-抗坏血酸(AA)含量的测定
采用国标2,6-二氯靛酚法[22]进行测定,结果以每100 g西瓜汁所含L-抗坏血酸毫克数表示。
1.3.2.9 总酚含量测定
采用Folin-Ciocalteu法[24],称取10 g西瓜汁置于烧瓶中用甲醇溶液提取60 min后于2 000 r/min冷冻离心15 min,取上清液0.2 mL置于25 mL试管中,加入1.0mL Folin-Ciocalteu试剂,充分振荡摇匀,避光放置5 min,加入质量浓度200 g/L的Na2CO3溶液0.8 mL混匀,定容后于30 ℃下放置30 min,然后于765 nm波长下测定吸光值。总酚含量以每100 g西瓜汁中所含没食子酸质量表示(mg/100g)。
没食子酸标准曲线的绘制:精确称取0.011 0 g没食子酸标准品,蒸馏水溶解于100 mL的容量瓶中定容,该标准溶液的浓度为0.11 mg/mL。准确吸取0、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL待测液并加入1.0 mL Folin-Ciocalteu试剂,充分振荡摇匀,避光放置5 min,加入质量浓度200 g/L的Na2CO3溶液0.8 mL混匀,定容后于30 ℃下放置30 min,然后于765 nm波长下测定吸光值。以吸光度和没食子酸质量浓度求得回归方程。所得回归方程:Y=87.301X-0.001,方程中:Y为吸光度,X为质量浓度,R2=0.999 9。
1.4 数据处理
本实验所有测试重复3次,实验结果以“平均值±标准差”表示。使用Origin 9.0进行相关图表的绘制,应用SPSS 11.5统计软件,对数据进行方差分析,使用Duncan法比较平均值之间的差异性,p<0.05表示有显著性差异,p<0.01表示差异极显著。
2 结果与分析
2.1 超声波处理对PPO和POD活性的影响
图1为经过热处理与超声波处理后,西瓜汁中PPO的残留活性。与空白对照组相比,热处理组与超声波处理组的西瓜汁PPO活性有显著下降(p<0.05),热处理组的PPO活性降低至约为对照组的55%,PPO酶活性得到显著抑制。西瓜汁经超声波处理后,PPO酶活性的下降程度与超声波处理时的功率和时间有关。当超声波功率为100 W时,PPO酶活性被抑制的程度较低,随着超声波时间的延长,PPO活性逐渐下降,但仍高于热处理组。随着超声波功率的加大,PPO酶活性继续下降,当在200 W功率下超声处理30 min后,西瓜汁中PPO下降程度与热处理组相同,而当超声波功率增长至300 W时,只需处理20 min即可达到与热处理相同的减灭酶活的效果,在300 W超声波处理西瓜汁30 min后,PPO活性已降低至约为对照组的40%,且显著低于热处理组(p<0.05),这可能是由于较大强度的超声波产生的冲击或射流对PPO酶的二级结构产生了较大的影响,导致酶的构象发生变化,从而降低了酶的活性[25]。
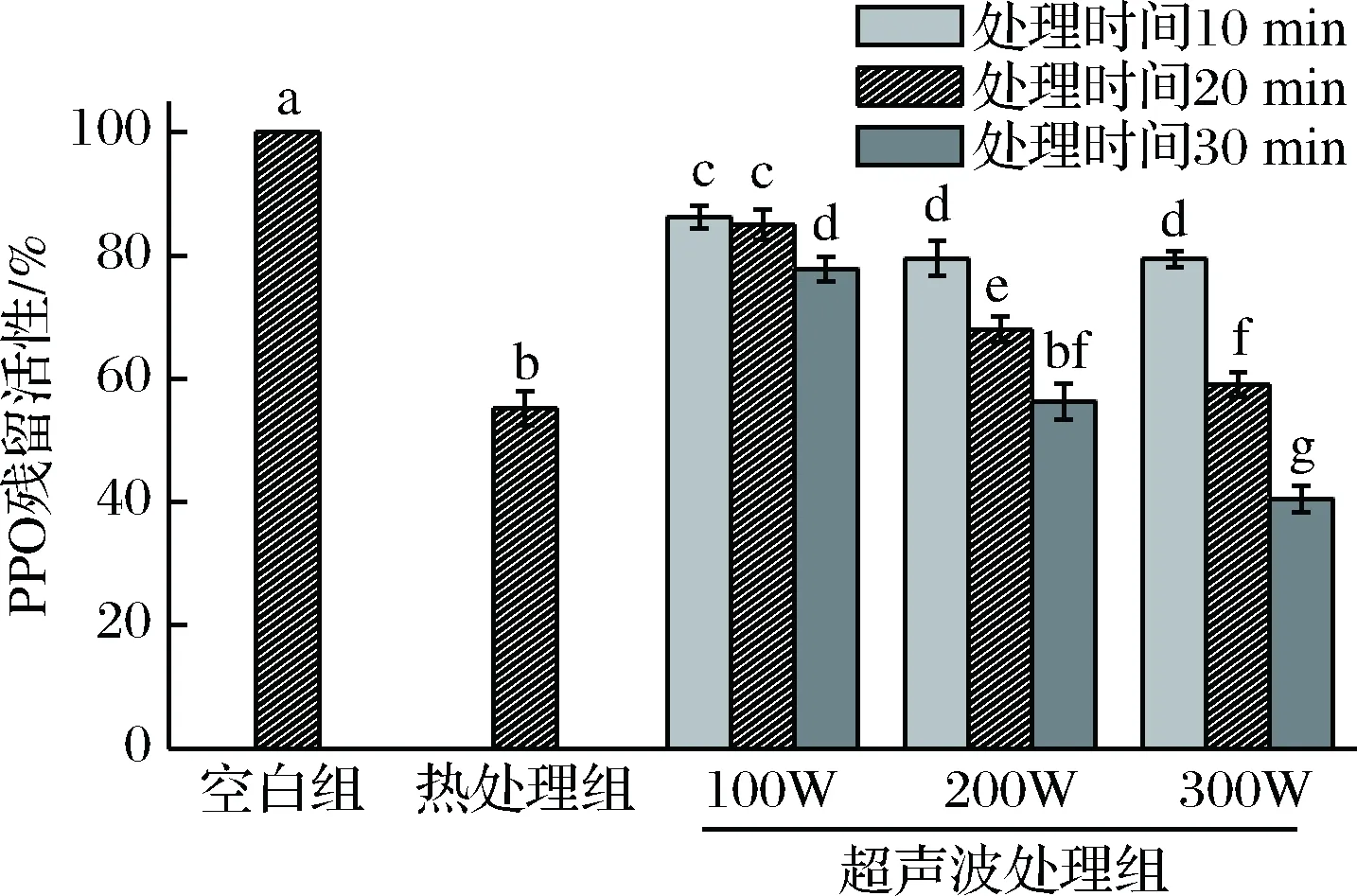
图1 超声波处理对西瓜汁PPO残留活性的影响Fig.1 Effect of ultrasound l treatments on residua1 PPOactivity in watermelon juice
图2为经过热处理和超声波处理后,西瓜汁中POD的残留活性。由图2可以看出,经热处理和超声波处理后,POD酶活性有不同程度的降低,西瓜汁经热处理后POD活性保持为对照组的60%左右。超声波处理后,POD活性较对照组有所下降,但仍高于热处理组,仅在300 W超声波下处理30 min后,西瓜汁中POD的活性降低至与热处理组相同。超声波处理对西瓜汁中POD活性的影响较小,这可能是由两方面的原因造成。一方面,超声波处理后,西瓜汁中PPO活性降低,由PPO分解产生的H2O2减少,使得POD的活性降低,另一方面,超声波可导致酶分子的能量增加,引起酶分子构象的微小变化,使其超微结构更加柔顺,从而增强其活性[26]。这两方面对POD活性的影响效果相反,从而导致超声波对POD活性的影响较小。目前普遍认为超声波在较低强度的超声作用下,超声强度同酶活力呈正相关,随着强度的增大,酶逐渐被激活,强度越高,酶的催化活力越高,只有进一步加大强度,酶才能变性失活,强度越高,失活率越高[27]。

图2 超声波处理对西瓜汁POD残留活性的影响Fig.2 Effect of ultrasound treatments on residua1 PODactivity in watermelon juice
2.2 超声波处理对TSS、TA及电导率的影响
表1为超声波处理对西瓜汁TSS、TA及电导率的影响。

表1 超声波处理对西瓜汁TSS、TA及电导率的影响Table 1 Effects of ultrasonic treatment on watermelonjuice TSS, TA and conductivity
TSS和TA是影响果蔬汁口感的重要因素,从表中可知,本实验中空白对照组的TSS和TA分别为8.8%和0.96 mL/L(以柠檬酸计),而热处理和超声波处理对西瓜汁的TSS含量和TA含量并没有显著性影响(p>0.05),表明热处理与超声波处理对西瓜汁的酸甜程度不造成显著性影响。BHAT[28]、ADEKUNTE[29]、TIWARI[22]等分别对柑橘果汁、红葡萄汁和橙汁等果蔬汁进行超声处理后,均发现超声波对果蔬汁的TSS、TA没有显著性影响,与本实验结果一致。
电导率可表示果蔬汁中离子的多少和渗透压的大小,其数值越大,离子含量越多,渗透压越大。从表1可以看出,随着超声波作用功率的加大及时间的延长,西瓜汁的电导率逐渐增加。超声波可作用于西瓜汁的微小细胞,使其中的小分子物质或离子释放,使得西瓜汁中的离子含量增加,电导率升高。同时,在进行超声波处理时,超声波的金属变幅杆伸入西瓜汁中,有可能导致少量金属离子溶解,从而使得西瓜汁离子含量增加电导率升高。
2.3 超声波处理对西瓜汁色泽的影响
果蔬汁的色泽是评价其感官品质的重要指标,保持天然的色泽有助于吸引消费者。表2为超声波处理对西瓜汁色泽的影响。与空白对照组相比,西瓜汁经过加热处理后,其L*值增加,ΔE大于3,表明西瓜汁经过高温处理后的色泽与天然色泽存在极为显著的差异(p<0.01),这与钟烈洲[30]对苹果汁热处理后色泽变化的研究结果一致。西瓜汁的a*值与b*值在处理前后均保持正值,而经过热处理后西瓜汁a*值和b*值有所升高,这可能是由于热处理引起了西瓜汁的褐变,热处理使花色苷类物质氧化降解从而导致西瓜汁偏向红色和黄色的程度更强[31]。

表2 超声波处理对西瓜汁色泽的影响Table 2 Effect of ultrasound treatments on color attributes of watermelon juice
经过超声波处理的西瓜汁,L*值几乎没有变化,仅在300 W功率下处理30 min后稍有增加,但变化值仍不显著。超声波处理后的西瓜汁ΔE均小于1.5,a*值和b*值与对照组的差异也不大,色泽变化小,超声处理后西瓜汁的色泽与天然色泽保持相近。超声波处理西瓜汁时,降低了西瓜汁中能引起酚类物质氧化的酶的活性,对西瓜汁的酶促褐变在一定程度上起到抑制作用。超声波作用于西瓜汁时,会因为其机械搅拌作用对西瓜汁进行脱气[32],从而降低西瓜汁中的氧溶解量,在后期西瓜汁的放置过程中,由于氧含量降低,褐变反应程度下降,色泽基本保持不变。
2.4 超声波处理对西瓜汁黏度的影响
图3为超声波处理对西瓜汁黏度影响的柱状图。由图3可知,热处理和超声处理均能在一定程度上增加西瓜汁的黏度,与对照组相比,热处理的黏度增长了近60%。超声波对西瓜汁黏度的影响也与其功率及作用时间有关。由图3可知,西瓜汁的黏度随着超声波功率的增加而逐渐增加,当超声波功率固定时,超声时间越长,西瓜汁黏度越大。与热处理组相比,超声波可显著改变西瓜汁的黏度(p<0.05),在超声功率为100 W时,处理西瓜汁30 min即能达到与热处理相同的黏度变化情况,随着超声波功率的继续增加和时间的延长,西瓜汁黏度增加的程度迅速增大,当在200 W功率的超声波下处理30 min后,西瓜汁的黏度与热处理组相比增长了约40%,而在300 W功率下处理30 min后,西瓜汁黏度约增长55%,黏度几乎增长为对照组的2倍。
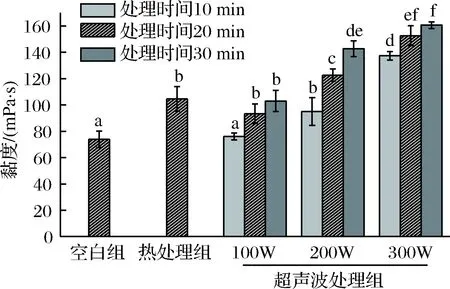
图3 超声波处理对西瓜汁黏度的影响Fig.3 Changes viscosity of watermelon juice duringultrasound treatments
果蔬汁黏度的增加有助于物质的悬浮,而果胶则是果蔬汁中维持颗粒悬浮,保持一致性的主要物质。果胶会在果胶酯酶和多聚半乳糖醛酸酶的作用下降解,而使得果汁的黏度降低,甚至导致果汁的分层。热处理能钝化果汁中的内源酶,使得果胶的分解程度降低,因而热处理组西瓜汁的黏度较对照组有所提高。超声波处理能使果胶酯酶受到机械损伤,其活性大大降低,果胶分解受到限制,从而使得果汁能在悬浮稳定的同时也保持较高的黏度[14]。与热处理组相比,超声处理后西瓜汁的黏度增加,WU等[33]认为这主要是因为超声波处理可改变果汁粒径的分布,减小果汁颗粒的大小,从而增加小颗粒的数量并导致表面张力增加,而使得果汁黏度升高。
2.5 超声波处理对AA和总酚含量的影响
AA和多酚是果蔬汁中重要的营养物质,多酚又是果蔬汁中色素的主要成分,而酚类色素的降解又往往与AA有密切联系,AA通过与氧化物质结合而起到保护多酚物质的作用[31]。图4表明了超声波处理对西瓜汁中AA含量的影响情况,当西瓜汁经过热处理后AA的含量几乎减少了60%,热处理对AA具有显著的破坏性,这主要是由于AA对热具有较强的敏感度。西瓜汁经过超声波处理后,AA含量会随着超声波功率的加大和时间的延长逐渐降低,但降低的程度较小,当用300 W超声处理30 min后,AA含量也仅降低了10%,AA的损失率远远低于热处理组,超声波作用于西瓜汁后,西瓜汁中自由基的含量增加因而减少了AA被氧化的机率,在超声波处理西瓜汁的过程中伴随着机械搅拌作用,降低果汁中的溶氧量也使得AA氧化的程度下降。这一结果与RAWSON[34]用超声波处理西瓜汁后测定AA含量得到的结论一致。
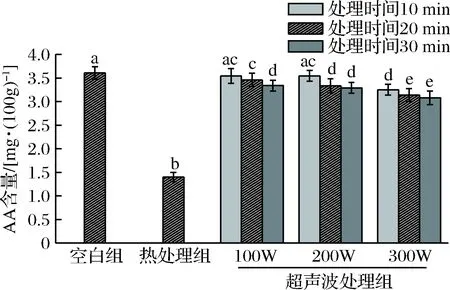
图4 超声波处理对西瓜汁中AA含量的影响Fig.4 Changes in AA content of watermelon juiceduring ultrasound treatments
图5表明超声波处理对西瓜汁中总酚含量的影响情况。热处理对多酚物质也有较强的破坏性,经热处理后多酚含量也呈现大幅下降。与热处理组相比,超声波处理则能较好地保留多酚物质,但不同超声波处理的功率和时间对多酚含量的影响呈现出无规则变化,超声波处理后多酚含量在原含量周围上下浮动,增加超声处理功率和延长处理时间后,多酚含量仍处于较稳定的水平,由此可以认定超声波处理对多酚物质基本不产生影响。出现此种情况的原因可能是由于超声波能在较大程度上保留AA,而AA对多酚的保护作用使得多酚几乎不受到破坏,同时氧含量的降低也为多酚的稳定存在提供了有利条件。而在BHAT等[28]对柑橘类果汁的研究中还发现,较低功率的超声波处理能增加多酚的含量,据推测这可能是因为低功率的超声波对多酚具有萃取的作用。

图5 超声波处理对西瓜汁中总酚含量的影响Fig.5 Changes in total phenols content of watermelonjuice during ultrasound treatments
3 结论
低功率的超声波处理西瓜汁可有效降低果汁中PPO和POD酶活性,且失活率与超声波功率及处理时间呈正相关,在较大程度上抑制了西瓜汁由于酶引起的氧化褐变。超声波对西瓜汁的TSS和TA等理化性质没有显著性的影响,超声后西瓜汁的TSS和TA几乎保持不变,但西瓜汁的电导率会随超声功率的增强及作用时间的延长而增加。超声波处理后的西瓜汁与对照组相比色差较小,能在较大程度上保留天然的色泽,保持良好的感官品质。同时,超声波处理可以维持西瓜汁的黏度,从而使西瓜汁保持较好的饮用口感,并且能较好地保留西瓜汁中的营养成分,对AA和多酚的破坏性小,可最大程度地维持西瓜汁的商品价值。

