pH调节法提取三种贝类分离蛋白及其组成、特性分析
薛高瞻,张凯,郑尧,郑惠娜,周春霞,高加龙,秦小明,章超桦
(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,国家贝类加工技术研发分中心(湛江),广东 湛江,524088)
自2002年以来,中国的水产养殖一直处于世界领先地位[1]。近年来随着人工繁殖和工程技术的不断发展,中国贝类水产养殖生产量持续增加。中国每年生产大约1 200~1 300万t各种贝类(约占渔业水产养殖总产量的28%),占世界水产养殖总产量的60%[2-3]。我国水产品加工仍处于起步阶段,特别是贝类加工更为落后,即使是生产和出口量较大的主要经济贝类,大多也处于初加工阶段,产品形式单一、高附加值产品比例低[4-5]。因此,贝类高附加值集约加工和综合利用问题已成为水产贝类加工行业的制约瓶颈。
pH调节法提取动物蛋白是20世纪90年代末新兴的一种技术,该方法是利用蛋白质在不同pH条件下溶解度不同的原理,首先在碱性条件下将肌肉中的蛋白质溶解,去除不溶物,再调 pH至蛋白质的等电点沉淀蛋白[6]。已有许多研究报道采用pH调节法从鱼肉,鸡肉、牛肉、兔肉中有效提取回收高质量的蛋白质[7-8]。pH调节法是一种从动植物提取分离蛋白的有效技术,提取的分离蛋白可作为一种优良的膳食补充剂,也可用作生产重组产品的粘合剂、分散剂、乳化剂、即食产品等,同时其能够与其他蛋白质的相互作用保留凝胶形成能力[9-12]。分离蛋白的组成和特性在食品加工和产品研发过程中十分重要[13]。海洋贝类是海产蛋白质的重要来源,具有高蛋白、低脂肪的特点。目前,大部分研究主要采用酶解方法[14-15],采用pH调节法制备贝类分离蛋白及其组成和特性分析的相关研究较少。我国贝类蛋白资源丰富,但是加工利用程度低,高附加值产品少。因此,本文采用pH调节法从3种经济养殖贝类:扇贝、文蛤和鲍鱼肌肉中提取制备3种贝类分离蛋白,确定碱提和酸沉最佳pH,进一步分析3种贝类分离蛋白的组成和特性,研究结果为贝类分离蛋白作为高品质营养蛋白质基料应用于保健食品生产工业中提供理论基础数据。
1 材料与方法
1.1 材料与试剂
墨西哥湾扇贝(Argopectenirradiansconcentricus)、文蛤(MeretrixmeretrixLinnaeus)和皱纹盘鲍(Haliotisdiscushannai)购于广东省湛江市东风市场。采用泡沫箱包装,3种贝类鲜活贮运至实验室,立即去壳去内脏、清洗干净,将贝肉分装于保鲜密封袋中,-20 ℃储存备用。聚丙烯酰胺凝胶电泳试剂盒和蛋白质标准品购于上海碧云天生物科技有限公司(中国上海市);其他化学品和试剂均为分析纯。
1.2 仪器与设备
pH-25数显pH酸度计,上海康仪仪器有限公司;UXZ200H岛津托盘电子分析天平,日本岛津公司;Milli-Q Biocel超纯水系统,美国 Millipore 公司;T18 basic高速分散机,德国IKA公司;Sigma 3K3离心机,德国 Brawn Biotech International公司;日立835-50型高速氨基酸分析仪,日本日立公司;EVO 300 PC紫外可见分光光度计,美国 Thermo Fisher Scientific公司; DYCZ-24 EN电泳槽,北京六一仪器厂;DYY-2C电泳仪,北京六一仪器厂;凝胶成像仪,美国 Bio-Rad公司;204-DSC,德国 Netzsch 公司。
1.3 实验方法
1.3.1 最佳碱溶及酸沉pH的确定
参考CHEN等[16]提取分离蛋白方法并略加修订。整个提取过程在冰浴中进行。首先按1∶3(g∶mL)将贝肌肉分散在预冷(4 ℃)的超纯水中,采用1 mol/L NaOH将溶液的pH分别调节至8.0、9.0、10.0、11.0、12.0和13.0。 然后采用高速均质机,13 000 r/min条件下均质3 min,冰浴条件下搅拌30 min后,10 000 r/min,4 ℃离心15min,分别收集沉淀和上清液,上清液用100 mL容量瓶定容后采用Folin-酚蛋白定量试剂盒测定碱提取液吸光值,对照标准曲线(Y=0.001 4X+0.010 1)计算出蛋白质含量,确定最佳碱溶pH值。在最佳碱溶pH条件下提取蛋白溶液,然后分别加入1 mol/L HCl使最佳碱溶上清液的pH分别调至3.9、4.4、4.5、4.8、5.1、5.4、5.7和6.0保持30 min,然后以10 000 r/min, 4 ℃离心20 min。上清液采用100 mL容量瓶定容,然后采用Folin-酚蛋白定量试剂盒测定上清液吸光值,对照标准曲线计算出蛋白质含量,确定最佳酸沉pH值。最后收集沉淀调节pH至中性,冷冻干燥备用。
1.3.2 三种贝类分离蛋白的制备
根据上述3种贝类最佳碱溶酸沉pH进行SPI、CPI和API的制备,制备工艺流程如下:
贝肌肉→打浆→称量→按1∶3(g∶mL)比例加入预冷超纯水→1 mol/L NaOH调节至最佳碱溶pH值 →高速分散机匀浆3 min(冰浴)→4 ℃下搅拌30 min→10 000 r/min,4 ℃离心15 min→取上清液→ 1 mol/L HCl调节至最佳酸沉pH值→10 000 r/min,4 ℃离心20 min→取沉淀→冷冻干燥→密封保存备用。
1.3.2 分离蛋白基本组成分析
粗蛋白含量测定,凯氏定氮法GB/T5009.5—2003[17];水分含量测定,直接干燥法 GB 5009.3—2010[18];脂肪含量测定,索氏抽提法GB/T 5009.6—2003[19];灰分含量测定,马弗炉法GB 5009.4—2010[20]。
1.3.3 分离蛋白溶解性分析
参考ADEBIYI等[21]的方法测定蛋白质的溶解性。称取3种贝类分离蛋白各10 mg分散在10 mL水溶液中,采用1 mol/L NaOH或HCl调节pH为2.0~12.0。室温下磁力搅拌器搅拌20分钟后,10 000×g离心10 min。 然后采用Folin-酚蛋白定量试剂盒测定碱提取液吸光值,对照标准曲线测定上清液中的蛋白质含量。
1.3.4 分离蛋白DSC分析
参考DA ROCHA等[22]方法并略加修改,将大约10~15 mg的冻干蛋白质样品放置于样品铝盘中,以5 ℃/min的速率从20 ℃加热至120 ℃测定样品DSC曲线,使用密封的空盘作为参考。
1.3.5 分离蛋白氨基酸组成分析
称取样品数毫克,加入2 mL 5.7mol/L HCl,置于110 ℃烘箱内水解24 h,然后除去过量的HCl,加缓冲溶液稀释到一定体积,摇匀。色氨酸的测定则采用5 mol/L NaOH进行碱水解。采用氨基酸自动分析仪分析,上机条件:流动相为专用缓冲液PI-1、2、3、4(分别为Ph 2.2、3.3、4.0、6.4柠檬酸钠缓冲液),流速0.225 mL/min,温度25 ℃,上样量50 μL[21]。
1.3.6 分离蛋白SDS-PAGE分析
采用SDS-PAGE电泳进行蛋白质组成成分测定;浓缩胶浓度为5%,分离胶浓度为12%,采用R-250考马斯亮蓝进行染色检测[23]。
1.3.7 数据分析
实验数据采用Microsoft Excel(Microsoft Corporation,USA)作图,SPSS 22.0 (SPSS Inc.,USA) 进行方差(ANOVA)显著性(p<0.05)分析。
2 结果与分析
2.1 最佳碱溶酸沉pH的确定
大多数蛋白质在中性和碱性pH下带负电,通常等电点(pI)在pH 4~6。然而,不同来源的蛋白质可能存在一定差异性[24-27]。为了获得3种贝类肌肉蛋白的最佳碱溶及酸沉pH值,分别在不同碱性pH (9~13)和酸性pH(3.6~5.7)条件下比较了碱性提取液的蛋白提取量和酸沉上清液的蛋白残留量,见图1,结果表明,随着pH值的增加,3种贝肌肉碱提取液中的蛋白质含量呈上升趋势,在pH 12和pH 13提取液中蛋白的含量达到最大值,并且这2种pH条件下,提取液蛋白含量没有显著性差异(p<0.05),考虑到蛋白质变性及碱液的使用量,选择pH 12为3种分离蛋白提取的最佳碱溶pH,进行下一步酸沉实验。图1结果显示,扇贝和文蛤酸沉上清液中的最低蛋白质残留率均处在pH 4.5~5.1,并且在pH 4.5、4.8和5.1之间没有显著性差异(p<0.05)。鲍鱼酸沉上清液中的最低蛋白质残留率在pH 4.8。因此,扇贝、文蛤和鲍鱼酸沉淀的最适pH分别为5.1、5.1和4.8。

图1 不同pH条件下3种贝类肌肉碱溶蛋白提取量及酸沉蛋白残留率比较Fig.1 The comparison of protein extraction and residues from three shellfish muscles under different pH conditions注:图中不同字母标注表示具有显著性差异(p<0.05)。
2.2 SPI、CPI和API的基本组成分析
表1结果显示3种贝类分离蛋白的基本组成分析,SPI的粗蛋白含量最高,达到(87.3±2.3)%(干基),API达到(86.7±1.4)%(干基),CPI达到(80.86±1.7)%(干基);而CPI的总脂肪含量较高,达到(8.9±1.3)%(干基),SPI和API的总脂肪含量较低,分别为(4.5±0.9)% (干基)和(4.8±0.8)%(干基)。3种分离蛋白的灰分含量分别为CPI (5.8±0.6)%(干基),API (4.5±0.9)%(干基)和SPI (4.0±0.3)%(干基)。研究报道pH调节法提取蛋白可以显著降低回收蛋白质中脂质的含量[28-29]。然而,表1结果显示,3种贝类分离蛋白物中脂质的保留率相对较高。与鱼类相比,贝类含有较高的磷脂[30],与罗非鱼分离蛋白相比较,贝类分离蛋白的脂肪保留率较高[31]。磷脂由于两性特征具有乳化作用,与水和蛋白质产生相互作用。在蛋白提取过程中,由于蛋白质在接近其等电点的沉淀过程中重折叠,所以脂质可能在酸性pH沉淀期间被包埋在重折叠蛋白的内部。
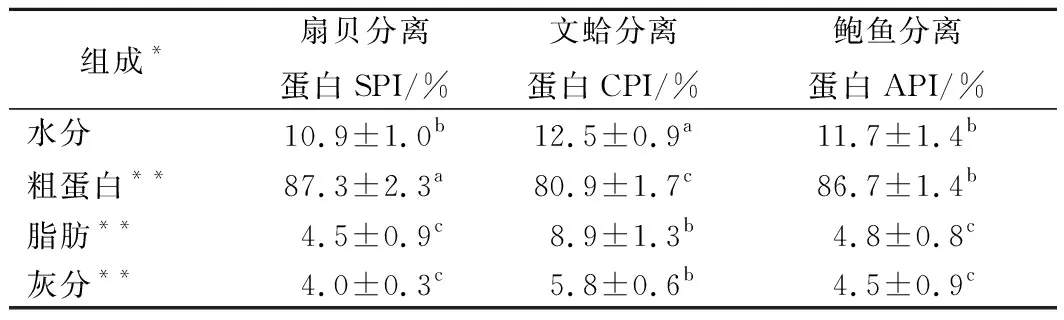
表1 三种贝类分离蛋白基本组成分析(n=3)Table 1 Basic composition of the three shellfish proteinisolates (n=3)
注:*表中同一行数值不同字母标注表示具有显著性差异(p<0.05),**干基计。
2.3 SPI、CPI和API的溶解性分析
大多数蛋白质在等电点附近溶解性最差。蛋白质的溶解性对于其在食品工业中的应用是至关重要的。因此,图2比较了pH 2.0~12.0条件下3种贝类分离蛋白的溶解性,3种贝类分离蛋白均显示为抛物线形溶解曲线,在pH 4.0~5.5时溶解性最差,在酸性和碱性pH范围内,pH 2.0和pH 12.0条件下,3种贝类分离蛋白分别达到最大蛋白质溶解度。比较这3种贝类分离蛋白的溶解性曲线,结果表明,CPI的溶解性最好。pH调节法提取蛋白过程中,随着蛋白提取溶液的pH值下降或增加,蛋白净电荷增加,增强了蛋白静电排斥从而有利于蛋白质不发生折叠。采用此法回收的水产蛋白表现出表面疏水性和—SH基团的增加,从而使提取的分离蛋白溶解性下降。因此,pH调节法提取蛋白质过程中,蛋白质发生了pH诱导折叠现象[32],有研究报道采用糖基化改性等方法可以改善扇贝分离蛋白的功能特性[33]。

图2 pH 2.0~12.0 三种贝类分离蛋白溶解性比较分析Fig.2 The comparative analysis on solubility of the threeshellfish proteins isolates under pH 2.0-12.0
2.4 SPI、CPI和API的氨基酸组成分析
3种贝类分离蛋白的氨基酸组成分析结果见表2。
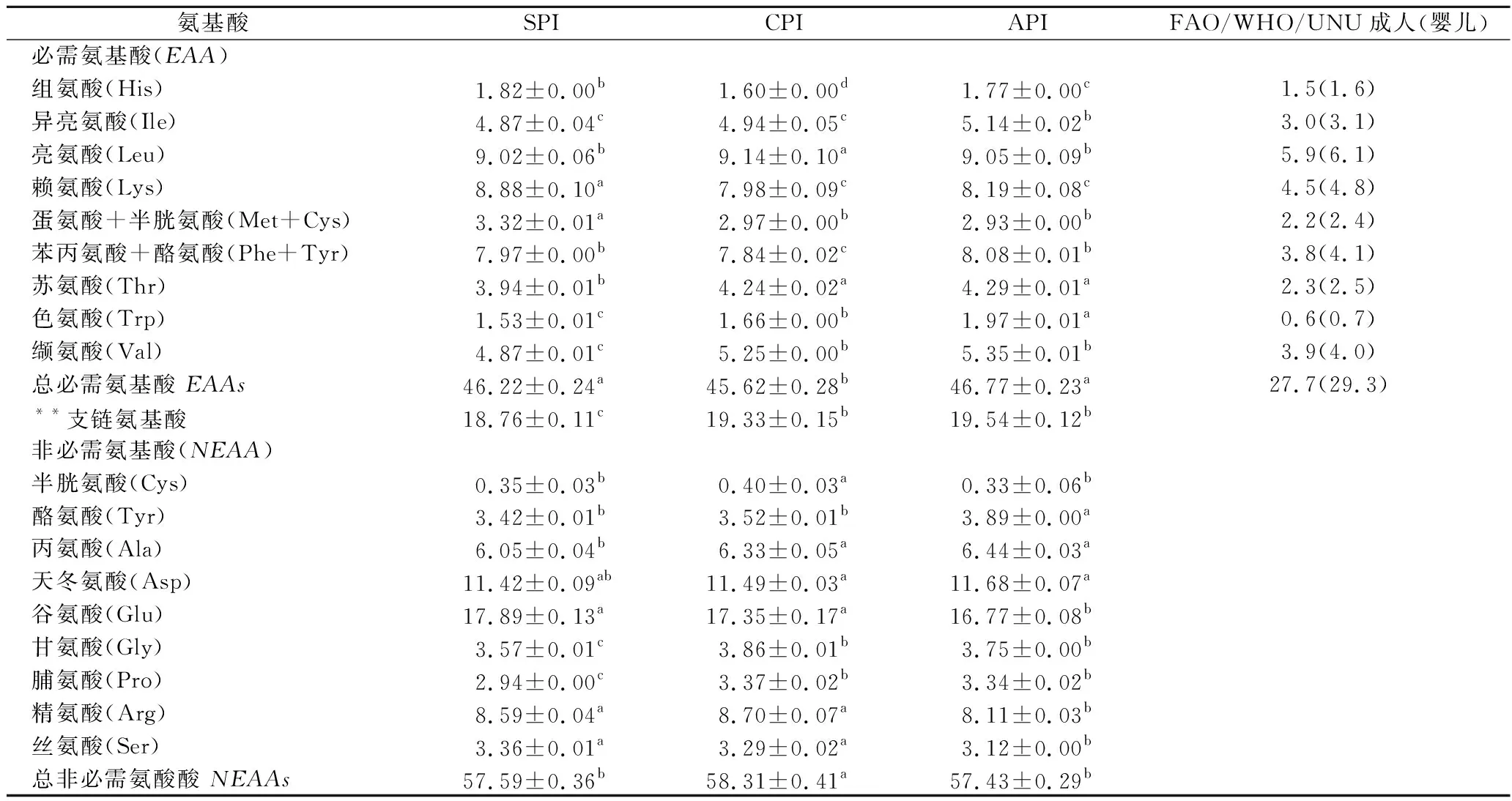
表2 三种贝类分离蛋白氨基酸组成分析 n=3 单位:g/100 g(蛋白)
*同一行中不同字母上标表示具有显着性差异(p<0.05).**支链氨基酸:异亮氨酸+亮氨酸+缬氨酸
3种贝类分离蛋白均富含天冬酰胺和谷氨酸,并且必需氨基酸含量接近(分别为46.22%,45.62%和46.77%),与相关鱼类分离蛋白研究中报道的氨基酸组成含量差异不大[31]。根据FAO/WHO/UNU建议,3种贝类分离蛋白中所有必需氨基酸的含量符合成人和婴儿的氨基酸要求。与推荐的FAO氨基酸模式相比,色氨酸为限制性氨基酸,其次是甲硫氨酸+半胱氨酸和组氨酸。支链氨基酸具有独特的生理功能,可以消除或减少肝性脑病的症状,改善营养状况和疲劳障碍[34]。CPI和API的支链氨基酸含量分别为19.33%和19.54%,SPI的支链氨基酸水平稍低,为18.76%。
2.5 SPI、CPI和API的DSC热稳定性分析
DSC可用于表征大分子如蛋白质中的结构转变特性。蛋白质的折叠涉及分子内作用键的破坏,主要是非共价键,蛋白质变性及结构发生变化在DSC曲线中表现出吸热过程[35]。为了验证加热过程中3种贝类分离蛋白的高级结构变化,对3种贝类分离蛋白进行DSC分析。结果如图3所示,3种分离蛋白的DSC曲线均显示了1个主要的吸热峰,表明在20~110℃发生了蛋白质变性。API、CPI和 SPI的主要吸热峰分别集中在63、61和57 ℃。研究结果表明,SPI在DSC热分析过程中比API和CPI更容易展开。SPI的较易变性与其蛋白质分子中较低的键能有关,这可能是由于pH调节过程中蛋白质中高级结构发生破坏引起的,而这种变性与蛋白质分子的解折叠或聚集的结构变化有关[36]。

图3 三种贝类分离蛋白DSC分析曲线Fig.3 DSC analysis curves of the three shellfish protein isolates
2.6 SPI、CPI和API的SDS-PAGE分析
通过SDS-PAGE分析3种贝类分离蛋白蛋白质组成,同时比较了经过β-巯基乙醇还原处理与未经过β-巯基乙醇还原处理的样品组成差异,结果见图4,未经β-巯基乙醇处理样品,3种贝类分离蛋白条带主要集中在4个范围(200,97,44和38 kDa),而经β-巯基乙醇处理样品,主要集中在200,97,44,38和18 kDa,其中97kDa和44 kDa条带由于β-巯基乙醇处理,使蛋白质二硫键的减少而有所增加。大多数水溶性蛋白质在酸沉处理过程中被去除,因此,pH调节法所获得的分离蛋白主要由肌原纤维蛋白组成。肌原纤维蛋白质由肌球蛋白重链(MHC)、轻链、肌动蛋白和α-辅肌动蛋白等组成。MHC和肌动蛋白分别出现在200 kDa和44 kDa。结果表明,3种贝类分离蛋白富含MHC、MLC和肌动蛋白。然而,鱼肉和贝类肌肉蛋白组成之间存在明显差异性,贝类肌肉含有形成粗丝的核心蛋白副肌球蛋白,并集中在97 kDa[37]。提取过程中NaOH和HCl溶液的浓度同时影响提取分离蛋白的形态,导致肌原纤维蛋白的降解,从而使MHC的含量下降[38]。相关研究显示pH调节过程中,酸性或碱性pH条件下,分离蛋白对内源性蛋白酶高度敏感,贝类肌肉中富含蛋白酶,因此,图谱中22 kDa、18 kDa和16 kDa等小分子蛋白条带可能是蛋白提取过程中,由于蛋白酶降解所产生[39]。
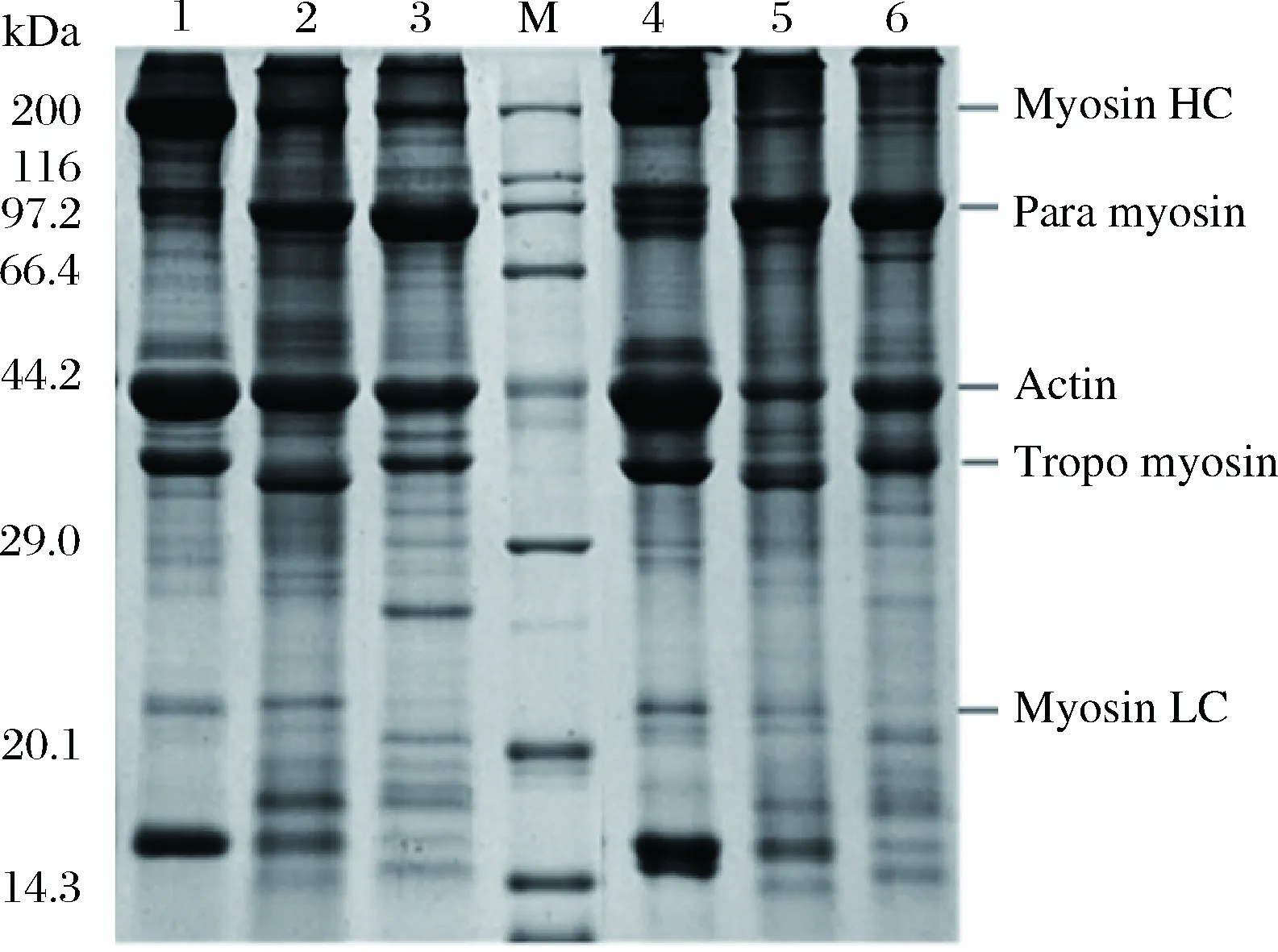
图4 三种贝类分离蛋白SDS-PAGE图谱Fig.4 SDS-PAGE of the three shellfish protein isolates注:泳道1~3: SPI,CPI,API (β-巯基乙醇还原处理),泳道4~6: SPI,CPI,API(无β-巯基乙醇还原处理),M:蛋白分子量量标准
3 结论
pH调节法可有效提取水产动物肌肉中的营养蛋白质。上述研究结果表明采用此方法提取的3种贝类分离蛋白SPI、CPI和API的粗蛋白含量均高于80%(干基),热变性温度分别在57.0、63.6和61.6 ℃;氨基酸分析结果表明:3种贝类分离蛋白是高质量氨基酸的良好来源,根据FAO/WHO/UNU建议,3种贝类分离蛋白必需氨基酸的含量符合成人和婴儿的氨基酸需求,研究结果为贝类分离蛋白作为高品质营养蛋白基料应用于保健食品生产工业中提供理论基础数据,并为进一步加工利用贝类资源开发贝类高附加值新型产品提供有效途径。

