一种快速检测婴幼儿配方奶粉中阪崎克罗诺杆菌的方法
王蕊,杨鑫焱,陈思涵,潘瑞丽,吴霜,满朝新,姜毓君
(东北农业大学 食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨,150030)
黄色阴沟肠杆菌曾在1980年被更名为阪崎肠杆菌[1],阪崎肠杆菌则在2008年被重新命名并被划分为克罗诺杆菌属[2]。克罗诺杆菌属菌株已在水、肉、蔬菜、茶叶、牛奶以及婴幼儿配方奶粉等多种食源性制品中被发现[3]。1958年,英国有2名新生儿因感染了克罗诺杆菌而死亡,这是世界上第1例报道的由克罗诺杆菌属导致的疾病,由此越来越多的人开始关注致病菌和婴幼儿配方奶粉之间的关系[4-5]。因此发展一个高特异性,灵敏的快速检测阪崎克罗诺杆菌的方法对降低克罗诺杆菌属菌株的污染风险尤为重要[6]。
婴幼儿配方奶粉中阪崎克罗诺杆菌传统的检测过程包括前增菌、选择性培养基增菌、分离显色和生化鉴定等步骤,全过程需3~7 d才能得出结果[7]。与传统方法相比,聚合酶链式反应(polymerase chain reaction,PCR)技术是细菌检测技术中的里程碑[8-9],它具有灵敏度高,特异性强,自动化操作以及耗时短等优点,广泛应用于细菌检测中[10-11]。然而,PCR技术在实际检测一些复杂的基质如牛奶中的致病菌时,基质中的脂肪和蛋白质会对PCR产生强烈的抑制作用[8-9],因此在PCR反应前进行样品的分离是十分必要的。样品分离方法中的免疫磁分离技术因其在食品检测中的巨大潜力而被广泛应用[12-14],但是此技术需要特异性的抗体。而抗体面临制备难度大、成本高等缺点,同样限制了免疫磁分离技术的应用。
本研究中,氨基磁珠通过氢键作用和静电相互作用,可非特异性直接吸附体系中存在的微量脱氧核糖核酸(deoxyribonucleic acid,DNA)。使用磁捕获技术结合PCR技术对目标菌株DNA进行特异性扩增,可以实现对阪崎克罗诺杆菌的检测。此方法不需要使用抗体,原材料制备简单,成本低廉,且前处理时间短(1~3 h),克服了传统方法前增菌时间过长(3~5 d)的弊端。此外,本研究在特异性试验中不仅验证了常见的食源性致病菌,同时也针对阪崎克罗诺杆菌的新分类验证了克罗诺杆菌属内的7株致病菌。综上所述,本研究将氨基磁珠吸附DNA技术与PCR技术结合,实现了对婴幼儿配方奶粉中阪崎克罗诺杆菌灵敏、快速以及高特异性的检测。
1 材料与方法
1.1 材料与试剂
胰蛋白胨大豆肉汤液体培养基(TSB),胰蛋白胨大豆肉汤固体培养基(TSA),青岛高科园海博生物技术有限公司;氨基磁珠,洛阳惠尔纳米科技有限公司;Triton X-100,美国Sigma-Aldrich公司;EDTA,苯酚-氯仿-异戊醇溶液,北京索莱宝科技有限公司;蛋白酶K,天根生化科技有限公司;PCR引物,北京诺赛基因组研究中心;PCR Master Mix,上海生工生物工程股份有限公司。
1.2 仪器与设备
ZHWY200B恒温培养振荡器,上海智城分析仪器制造有限公司;3K15台式冷冻离心机,美国Sigma-Aldrich公司;DK-98-1型电热恒温水浴锅,天津市泰斯特仪器公司;Mastersizer2000激光粒度仪,英国马尔文仪器有限公司;Veriti梯度PCR仪,赛默飞世尔科技;KQ-500DE型数控超声波清洗仪,昆山市超声仪有限公司;DYY-10C 型电泳仪,上海安亭科学仪器厂。
1.3 方法
1.3.1 菌株的培养
本研究采用阪崎克罗诺杆菌(ATCC29544)作为体系优化及灵敏度验证菌株,将其接种于TSB培养基中,在37 ℃,150 r/min的条件下培养12 h,即得到处于对数生长期的阪崎克罗诺杆菌菌液,用于后续试验。同时本研究采用4株阪崎克罗诺杆菌及13株非阪崎克罗诺杆菌的菌株进行特异性实验,这些菌株均参照美国模式培养物寄存库(American Type Culture Collection, ATCC)官方网站上所提供的方法进行活化、培养和保藏。
1.3.2 氨基磁珠的活化
氨基磁珠活化过程按照说明书中所述:使用前将磁珠悬浮液充分混匀,取100 μL磁珠悬浮液(含磁珠1 mg),磁分离弃上清;加入1 mL PBS(0.01 mol/L,pH值7.4)洗涤磁珠2次,磁分离弃上清;再加入200 μL PBS,使磁珠充分分散悬浮均匀;在上述200 μL 磁珠悬浮液中,加入800 μL质量分数为25%的戊二醛,室温条件下,在样品混合仪上振荡活化1 h;磁分离,弃上清;用1 mL PBS清洗活化的磁珠3次;最终将活化的磁珠分散在200 μL PBS中,即得到活化的磁珠悬浮液。
1.3.3 氨基磁珠吸附检测体系中DNA
DNA在待测体系中被释放的过程参考文献并做出适当修改[8,15-16]:取10 mL待检样品在4 ℃以6 000×g的转速离心20 min后,将沉淀重悬于含有质量浓度为5%的Triton X-100的500 μL三羟甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA,TE)缓冲液(10 mmol/L,含有1.0 mmol/L EDTA,pH值9)中,向其中加入30 μL蛋白酶K,在56 ℃条件下孵育30 min后煮沸10 min并迅速冰浴8 min,再通过苯酚-氯仿-异戊醇溶液(体积比25∶24∶1)进行萃取,即可得到粗提的DNA溶液。向粗提的DNA溶液中加入20 μL活化后的磁珠,60 ℃孵育摇动30 min后,经TE buffer清洗3次,重悬于100 μL用于后续检测。
1.3.4 PCR反应体系的建立
本文所引用的PCR引物(5’-CGG GTT ACG CAG GGT TGA-3’; 5’-GCG GTT GCC AGT GAA TAA GAT-3’)曾被验证针对阪崎克罗诺杆菌的PCR检测具有较好的特异性[17]。 PCR反应体系如下:2×PCR Master Mix 12.5 μL,去离子水8.5 μL,引物各1 μL (10 μmol/L)以及DNA模板2 μL。反应循环参数如下:94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸1 min,72 ℃终延伸5 min,其中变性、退火和延伸这3步循环30次。PCR反应结束后取5 μL扩增产物,通过琼脂糖凝胶电泳验证结果。
2 结果与分析
2.1 磁珠粒度分析
利用激光粒度仪对氨基磁珠的粒径分布进行分析,结果如图1所示。磁珠的平均粒径为66.714 μm,聚合物分散性指数为0.762。结果表明实验使用的氨基磁珠粒径分布均匀且分散性良好,磁珠表面基团包被良好。
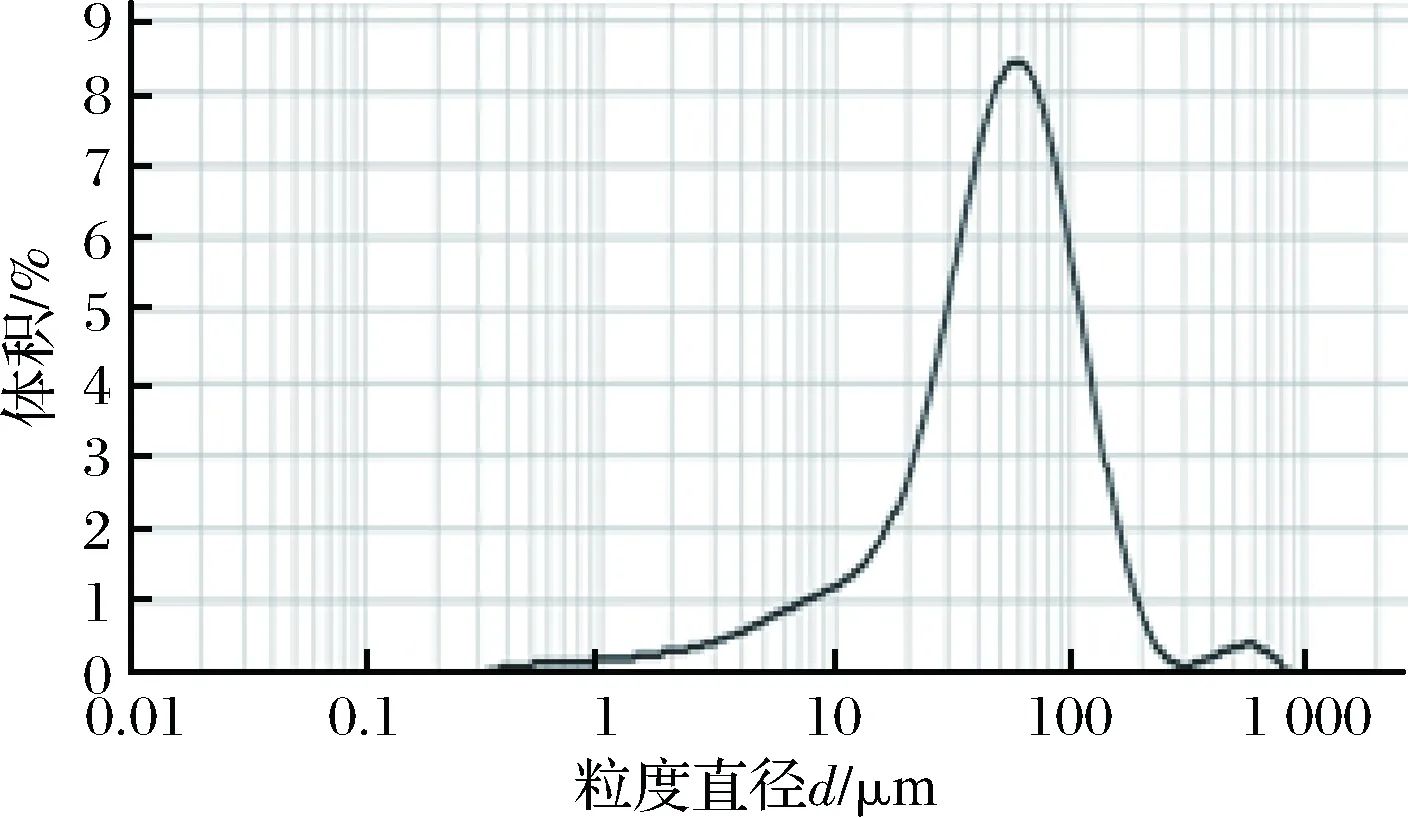
图1 氨基磁珠粒度分布图Fig.1 Distribution of diameter of amino-modifiedmagnetic nanoparticles
2.2 氨基磁珠吸附DNA过程的单因素优化试验
2.2.1 TE缓冲液的pH值优化
本试验基于1.3.3所述的方法,针对其中TE缓冲液的pH值进行了梯度优化,8组试验的pH值分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,再分别对捕获后的DNA进行PCR扩增并通过琼脂糖凝胶电泳观察实验结果。结果如图2所示。
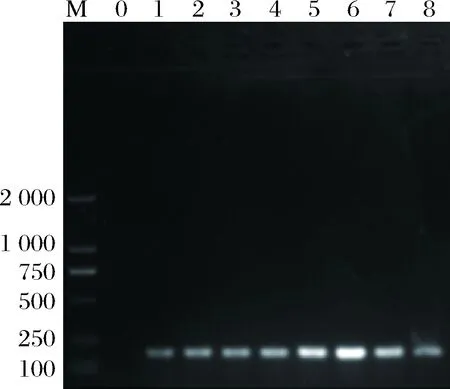
M-DNA Marker D2000;0-阴性对照;1-pH 4;2-pH 5;3-pH 6;4-pH 7;5-pH 8;6-pH 9;7-pH 10;8-pH 11图2 TE缓冲液 pH值的优化Fig.2 Optimization of pH value of TE buffer
当pH ≥10时,电泳条带较暗,表明只有少量DNA结合到氨基磁珠上。静电相互作用是影响氨基磁珠和基因组DNA结合的主要因素,当溶液的pH值比氨基磁珠的等电点(9.6)高时,氨基磁珠表面带负电荷,不能吸引DNA与其结合,因此在pH≥10时只能出现微弱的电泳条带。而当溶液的pH值低于氨基磁珠的等电点时,随着pH值逐渐变小,pH值越来越接近DNA的等电点(4.0),DNA表面的负电荷也逐渐减少,磁珠吸附DNA能力变弱。结果显示当pH越接近等电点时条带越亮,故TE缓冲液的最佳pH值为9。
2.2.2 蛋白酶K添加量的优化
本试验基于1.3.3所述的方法,针对其中蛋白酶K的添加量进行了梯度优化,6组试验的蛋白酶K添加量分别为0、10、20、30、40、50 μL,再分别对捕获后的DNA进行PCR扩增并通过琼脂糖凝胶电泳观察实验结果,结果如图3所示。

M-DNA Marker D2000;0-阴性对照;1-0 μL;2-10 μL;3-20 μL;4-30 μL;5-40 μL;6-50 μL图3 蛋白酶K添加量的优化Fig.3 Optimization of the addition of proteinase K
当蛋白酶K的添加量为30 μL时,电泳条带最亮。当添加量小于30 μL时,基质中的蛋白质不能完全去除,在一定程度上对PCR反应产生抑制作用。而当蛋白酶K添加量大于30 μL时,容易造成蛋白酶K降解不彻底,由于蛋白酶K本身也是一种蛋白质,同样会对PCR反应产生抑制作用,故30 μL为蛋白酶K的最佳添加量。
2.2.3 吸附时间的优化
本试验基于1.3.3所述的方法,针对其中氨基磁珠对目标DNA的吸附时间进行了梯度优化,7组试验的吸附时间分别为0.25、0.5、1、2、3、4、5 h,再分别对捕获后的DNA进行PCR扩增并通过琼脂糖凝胶电泳观察实验结果,结果如图4所示。

M-DNA Marker D2000;1-15 min;2-30 min;3-1 h;4-2 h;5-3 h;6-4 h;7-5 h图4 吸附时间的优化Fig.4 Optimization of the absorption time
在0.25、0.5、1 h的吸附时间里,电泳条带清晰明亮,在大于1 h的捕获时间里条带呈现随着时间增加逐渐变暗的变化规律,产生这一现象的原因可能是过长的吸附时间导致了氨基磁珠的氧化反应。为减少检测时间,同时考虑到奶粉基质的复杂性,最终选择0.5 h为最佳捕获时间。
2.2.4 吸附温度的优化
本试验基于1.3.3所述的方法,针对氨基磁珠对目标DNA的吸附温度进行了梯度优化,6组试验的捕获孵育温度分别为40、50、60、70、80、90 ℃,再分别对捕获后的DNA进行PCR扩增并通过琼脂糖凝胶电泳观察实验结果,结果如图5所示。
在60 ℃的吸附温度下电泳条带最亮,可能原因是适宜的高温诱发了更多双链DNA打开;另一个原因可能是高温促进了氨基磁珠和DNA分子的运动,使磁珠和DNA分子更容易碰撞结合。当温度低于60 ℃时,碰撞结合概率降低,因此条带逐渐变暗,而当温度高于60 ℃,电泳条带随温度升高而变暗,这是由于氨基磁珠在高温条件下发生了氧化反应,造成了部分磁性的损失。因此,最终选择60 ℃为最佳吸附温度。
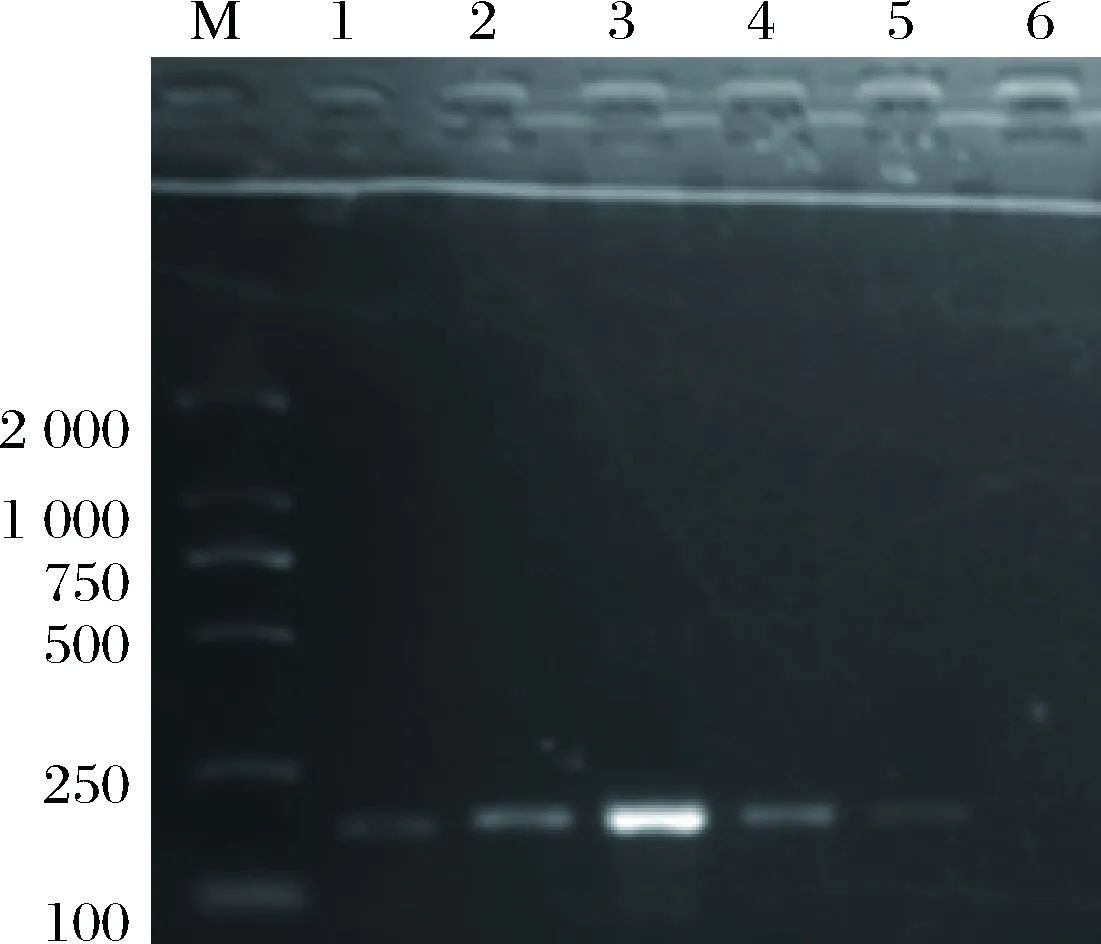
M-DNA Marker D2000;1-40 ℃;2-50 ℃;3-60 ℃;4-70 ℃;5-80 ℃;6-90 ℃图5 吸附温度的优化Fig.5 Optimization of the absorption temperature
2.3 响应面优化实验
2.3.1 实验设计
根据单因素实验结果,选取TE缓冲液pH值、吸附时间、吸附温度3个因素,采用3因素3水平进行响应面设计,实验方案及结果如表1所示。
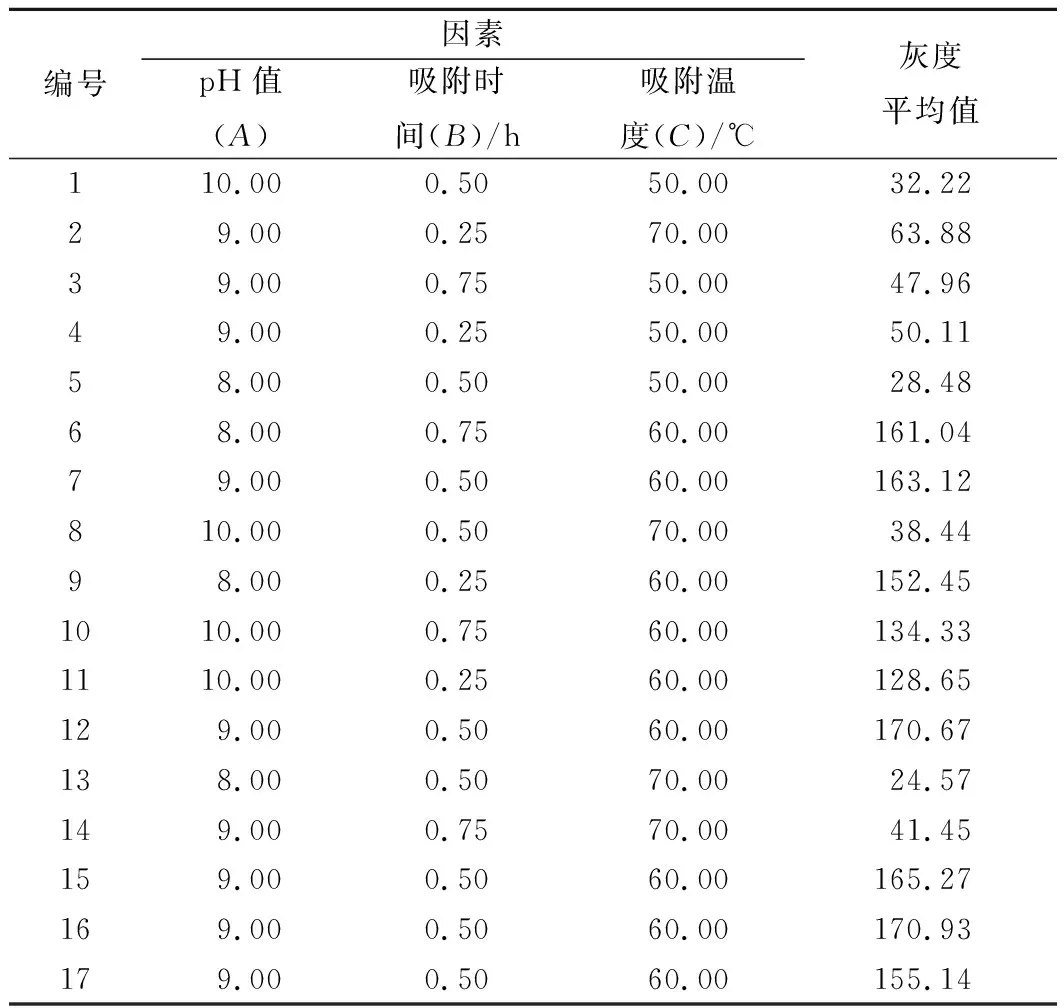
表1 Box-Behnken实验设计与结果Table 1 Scheme and results of Box-Behnken design
2.3.2 回归方程的建立与显著性检验
利用Design-Expert 8.0软件,通过对多项式回归分析,得到的拟合全变量二次回归方程模型为:灰度平均值=165.03-4.11A-1.29B+1.20C-0.73AB+2.53AC-5.07BC-20.42A2-0.49B2-113.68C2。以电泳条带的灰度平均值为响应值的精简模型方差分析见表2,回归模型差异性高度显著。模型相关系数R2=98.40%,说明这种实验方法可靠,使用该方程模拟真实的3因子3水平的分析是可行的。A2和C2对灰度平均值的差异显著,说明pH值和温度是影响磁珠吸附DNA的重要条件。

表2 回归模型方差与分析Table 2 Analysis of variance for the fitted quadraticpolynomial
2.3.3 响应面各因素交互作用分析
利用响应面优化法对磁珠吸附DNA单因素实验结果进行优化,各因素的交互作用如图6~8所示。图6表明pH值和时间的交互作用不显著;图7表明pH值和温度交互作用较弱,与pH值方向比较,温度效应面曲线相对更陡,表明pH值对电泳条带亮度的影响小于温度对电泳条带亮度的影响;图8表明时间和温度交互作用较弱,与时间方向比较,温度效应面曲线相对更陡,表明时间对电泳条带亮度的影响小于温度对电泳条带亮度的影响。对回归模型进行响应面分析,得到磁珠对DNA的最佳吸附条件为pH 8.92、时间0.25 h、温度60.27 ℃,在此条件下,电泳条带最亮。为检验模型预测的准确性,同时考虑到实际操作便利以及牛奶基质的复杂度,以pH 9.0,时间0.5 h,温度60 ℃进行验证,3次平行实验得到的电泳条带灰度平均值为155.34,与理论值166.043接近。因此,响应面法对磁珠吸附DNA条件的优化是可行的。
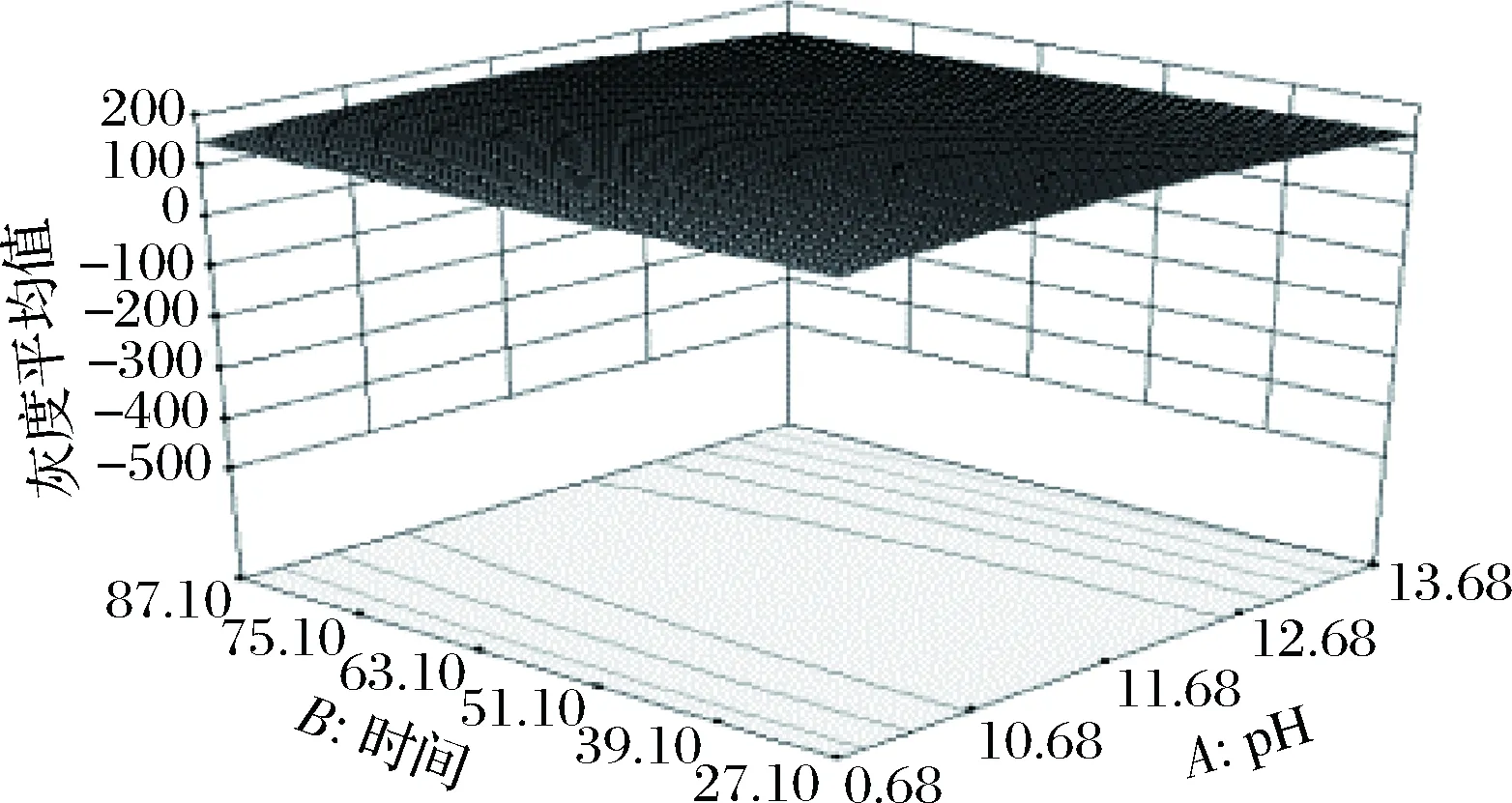
图6 Y=f(A,B)的响应面Fig.6 Response surface of Y=f(A,B)

图7 Y=f(A,C)的响应面Fig.7 Response surface of Y=f(A,C)
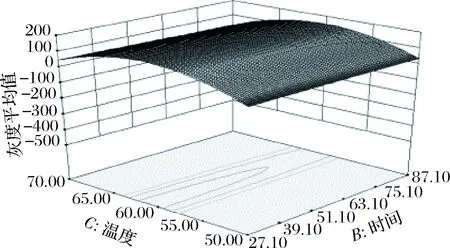
图8 Y=f(B,C)的响应面Fig.8 Response surface of Y=f(B,C)
2.4 婴幼儿配方奶粉中阪崎克罗诺杆菌的检测灵敏度
将10 g婴幼儿配方奶粉(经国标法检测不含有阪崎克罗诺杆菌)溶于90 mL生理盐水中,经梯度稀释后,分别取1 mL不同浓度的菌液,分别加入9 mL婴幼儿配方奶粉稀释液,充分混匀,获得终浓度为105~100CFU/mL的人工污染阪崎克罗诺杆菌的婴幼儿配方奶粉样品。将上述样品用本文所建立的方法检测,结果如图9所示,当人工污染的奶粉样品菌液浓度为102CFU/mL时通过电泳图能看到一条较弱条带,而当菌液浓度为101CFU/mL时电泳图无条带。因此,基于本文所建立的检测方法,婴幼儿配方奶粉中阪崎克罗诺杆菌的检测灵敏度为102CFU/mL。
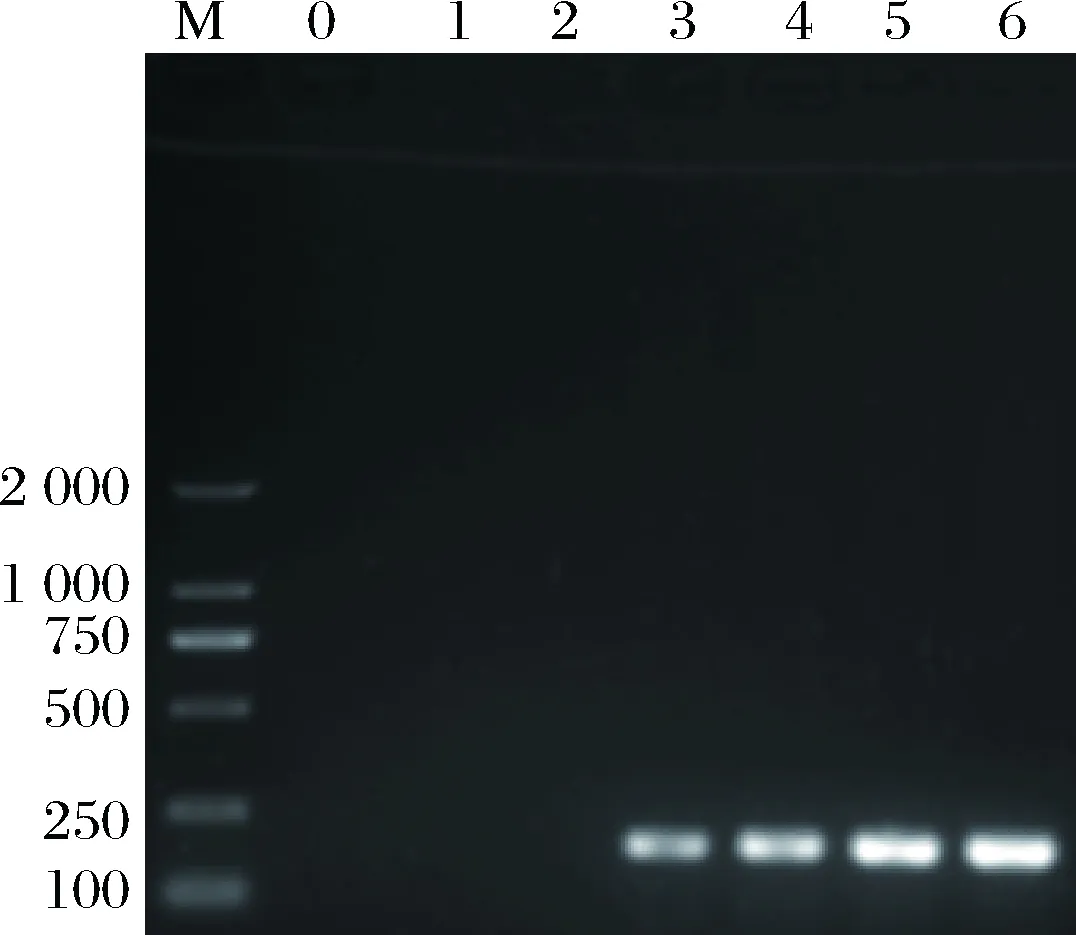
M-DNA Marker D2000;0-阴性对照;1-100 CFU/mL;2-101 CFU/mL;3-102 CFU/mL;4-103 CFU/mL;5-104 CFU/mL;6-105 CFU/mL图9 人工污染奶粉中阪崎克罗诺杆菌的检测灵敏度Fig.9 Detection sensitivity of C. sakazakii incontaminated PIF
2.5 磁珠吸附DNA结合PCR方法的特异性分析
针对4株阪崎克罗诺杆菌以及13株非克罗诺杆菌的菌株进行特异性实验,结果见表3,4株阪崎克罗诺杆菌均能被特异性扩增并呈现阳性结果,而其余13株非阪崎克罗诺杆菌呈现阴性结果,证明该方法特异性良好。
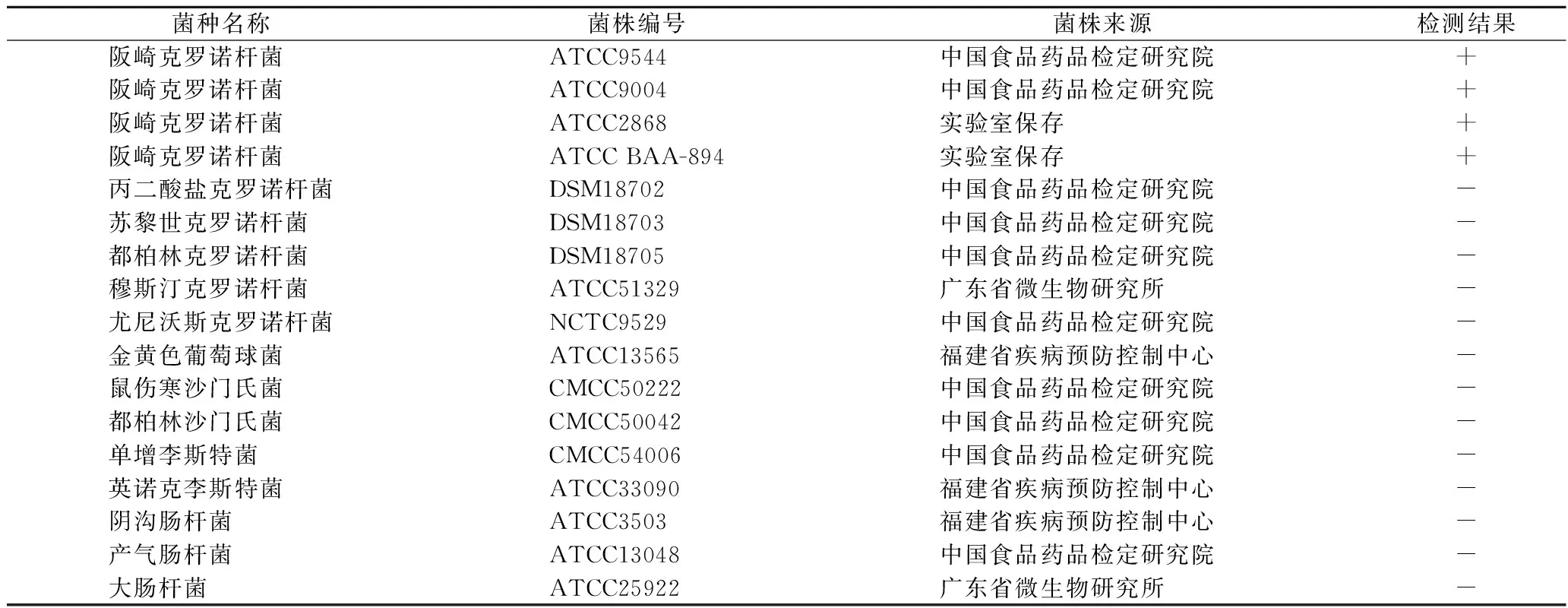
表3 实验用菌株及特异性实验结果Table 3 Bacterial strains used in this investigation and the results of specificity test
注:+, 阳性检测结果; -, 阴性检测结果,下表同。
2.6 抗干扰试验
由于氨基磁珠非特异性捕获DNA的特点,体系中其他干扰菌株的存在可能会影响阪崎克罗诺杆菌的检测,造成假阳性的检测结果。因此,在终浓度为105~100CFU/mL的人工污染阪崎克罗诺杆菌的婴幼儿配方奶粉样品中分别混入107CFU/mL的大肠杆菌和107CFU/mL的穆斯汀克罗诺杆菌,再用本文所建立的方法进行检测。结果如表4所示,克罗诺杆菌属内和属外的干扰菌株DNA均不会对阪崎克罗诺杆菌的检测造成干扰,检测灵敏度与没有干扰菌株时的灵敏度结果保持一致,均为102CFU/mL。由此可知,本文所建立的检测方法抗干扰性强,检测结果不会受到体系中其他菌株DNA影响。
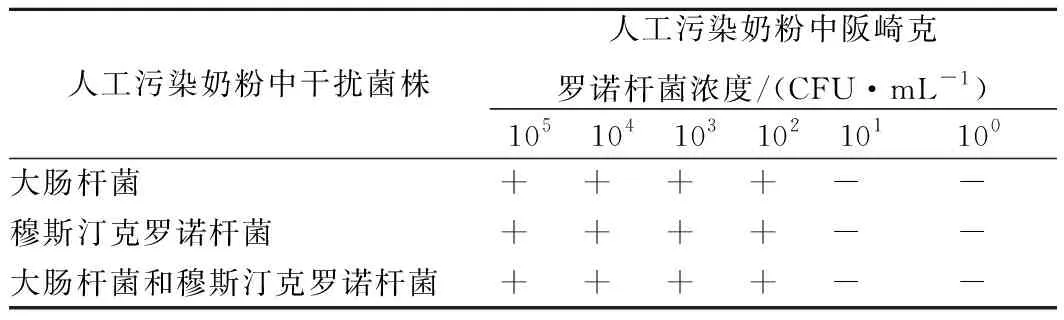
表4 干扰性试验检测结果Table 4 Test results of interference test
3 结论
本文建立了一个快速、灵敏和高特异性的检测方法用于检测婴幼儿配方奶粉中的阪崎克罗诺杆菌。此方法通过氨基磁珠非特异性的吸附和纯化奶粉样品中基因组DNA,再通过PCR特异性扩增并最终通过琼脂糖凝胶电泳观察检测结果。传统的免疫磁珠分离技术需要特异性的抗体,面临抗体制备难度大、成本高等问题。而本文通过氨基磁珠和DNA之间的氢键作用和静电相互作用,使DNA能在复杂的基质中被氨基磁珠直接吸附,避免了抗体的使用,降低了检测成本;同时本试验只需要1~3 h的前处理过程,克服了传统方法的3~5 d前增菌时间过长的弊端。本研究通过优化磁珠吸附过程中的TE缓冲液的pH值、蛋白酶K添加量、吸附时间和吸附温度,提高了检测的效果。在优化条件下,本方法对于人工污染婴幼儿配方奶粉中阪崎克罗诺杆菌的检测灵敏度可达102CFU/mL。此外,本文所建立的检测方法对常见的食源性致病菌及克罗诺杆菌属中非阪崎克罗诺杆菌均无交叉反应,同时阪崎克罗诺杆菌的检测不会受到体系中存在的其他菌株DNA的影响。因此,此方法可以作为一种快速检测婴幼儿配方奶粉中阪崎克罗诺杆菌的有效手段。

