激光辅助孵化对高龄患者Ⅰ、Ⅱ期囊胚移植结局的影响
张莉莉,何驰华,张杨
(长江大学第二临床医学院 荆州市中心医院生殖中心, 湖北 荆州 434020)
囊胚的扩张、孵化程度及囊胚的分级是妊娠结局的重要影响因素。研究报道,临床妊娠率会随着囊胚扩张和孵化程度的增加而增加,也就是说,3-5期囊胚的临床妊娠率显著高于1-2期囊胚,非优质囊胚的临床妊娠率显著降低[1]。在本中心,对多次移植失败的高龄妇女行囊胚培养,发现Ⅰ、Ⅱ期囊胚的形成几率较大,达到43.42%(132/304)。辅助孵化(assisted hatching, AH)应用到人类辅助生殖技术中已有多年,其与激光系统的联合运用取得了良好的效果[2]。Hsieh等研究发现,激光辅助孵化可以显著提高胚胎种植率、妊娠率及分娩率[3]。同时,Blake的研究更是表明激光法还可以显著提高囊胚的孵出率[4]。基于上述研究,对我院生殖中心2015年7月至2017年2月Ⅰ、Ⅱ期囊胚移植81个周期进行了回顾性分析,比较了激光辅助孵化后移植和常规移植患者的囊胚种植率、临床妊娠率和活产率,探讨了激光辅助孵化对Ⅰ、Ⅱ期囊胚种植潜力的影响。
1 资料与方法
1.1 一般资料
研究对象为2015年7月1日至2017年2月17日在我院生殖中心接受冻融胚胎囊胚培养形成Ⅰ、Ⅱ期囊胚的高龄患者(≥35岁)的81个周期。经患者夫妇同意行激光辅助孵化后移植41周期(AH组),其余40周期行常规胚胎移植(常规组)。
激光破膜仪系德国MTG公司生产;Jy-T解冻液购自加拿大Jy公司;囊胚培养基K-SIBM-20由Cook公司生产;胚胎培养基HTF-1026由SAGE公司生产;代血清由SAGE公司生产。
1.2 方法
1) 玻璃化解冻胚胎 玻璃化解冻试剂室温下平衡30min,室温下操作,快速从液氮桶中取出载杆,将胚胎放入T1中停留1~3min,室温下操作,将胚胎转入T2中停留3min,室温下操作,将胚胎转入T3中停留3min。缓慢复温从室温至37℃,将胚胎转入T4中停留3min,将胚胎转入1026 HTF移植液中,并对胚胎进行形态学观察,置入cook三气培养箱继续培养2h后移植。在显微镜下挑出存活胚胎(≥50%完整卵裂球),解冻后的胚胎评分标准同冷冻前,将一部分死亡的卵裂球标记为碎片,含一半以上存活卵裂球的胚胎记为活胚。
2)囊胚培养 将上述解冻后存活的D3胚胎移入囊胚培养液K-SIBM-20中继续培养2d。
3)辅助孵化 移植前1h,AH组采用1.48μm非接触式激光(Annexin laser,德国)薄化透明带。将待移植胚胎置于20倍倒置镜下,选择卵周隙大或者碎片集中的区域,调整激光靶心,形成一个约相当于透明带总长度1/4、深度为透明带总厚度50%~80%的薄化区,将辅助孵出后的胚胎放入培养箱继续培养,待移植。
4)囊胚移植和妊娠结果的判断 囊胚分级:胚胎等级评分按Garnder标准,主要根据囊胚扩张等级和孵出程度、内细胞团、滋养外胚层细胞三个主要方面评分,根据囊腔的扩张孵化将囊胚分为1~6级。1级:囊腔体积<胚胎总体积的1/2;2级:囊腔体积≥胚胎总体积的1/2;3级:囊腔占满胚胎的总体积;4级:囊腔充满整个胚胎,胚胎体积变大,透明带变薄;5级:正在孵出的囊胚,滋养层从透明带逸出;6级:囊胚完全从透明带中孵出。对3~6期的囊胚,内细胞团的评分:A级细胞数量多且排列紧密;B级细胞数量较少且排列松散;C级为细胞数量极少。滋养外胚层细胞评分:A级细胞数量多且结构致密;B级细胞数量不多且结构稀疏;C级细胞数量很少。≥3BB定义为优质囊胚,如有多个囊胚可供移植,一般选择3期以及3期以上囊胚进行移植,但当患者多次移植失败且高龄时或者其仅有1期和2期囊胚时,也可移植非优质囊胚。移植后12d测尿hCG,阳性者移植后4周行超声检查,若子宫腔内见妊娠囊和原始心管搏动即可以确定为临床妊娠。
1.3 统计学分析
2 结果
2.1 两组患者基本情况
两组患者年龄,不孕原因分布,接受IVF治疗的次数,平均移植Ⅰ、Ⅱ期囊胚数,透明带平均厚度及子宫内膜厚度均无统计学差异(P>0.05)(见表1)。
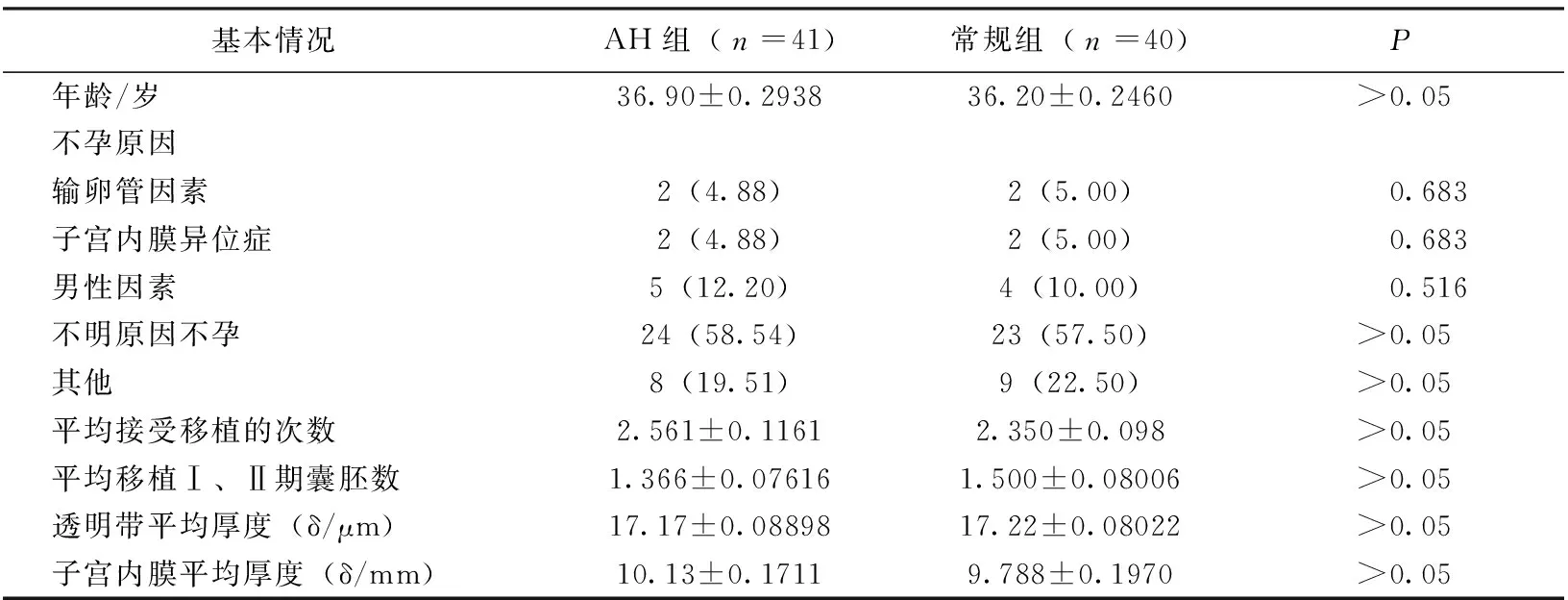
表1 两组患者的基本情况
2.2 两组患者的Ⅰ、Ⅱ期囊胚种植率
AH组患者移植Ⅰ、Ⅱ期囊胚数共计67个,其中着床胚胎数为18个,AH组囊胚种植率为26.87%。常规组患者移植Ⅰ、Ⅱ期囊胚数共计64个,其中着床胚胎数为7个,常规组囊胚种植率为10.94%。 AH组患者Ⅰ、Ⅱ期囊胚种植率明显高于常规组,且有统计学意义(P<0.05)。
2.3 两组患者的临床妊娠率
AH组Ⅰ、Ⅱ期囊胚移植周期数为41例,其中妊娠周期数为14例,AH组临床妊娠率为34.15%。常规组Ⅰ、Ⅱ期囊胚移植周期数为40例,其中妊娠周期数为7例,常规组临床妊娠率为17.50%。 AH组患者临床妊娠率明显高于常规组,且有统计学意义(P<0.05)。
2.4 两组患者的活产率
AH组Ⅰ、Ⅱ期囊胚移植周期数为41例,其中活产分娩周期数为10例,AH组活产率为24.39%。常规组Ⅰ、Ⅱ期囊胚移植周期数为40例,其中活产分娩数为6例,常规组活产率为15.00%。 AH组患者的活产率高于常规组,但无统计学意义(P>0.05)。
3 讨论
囊胚培养技术始于20世纪90年代,随着辅助生殖技术的不断发展,囊胚培养技术也随之不断改进与完善。由于囊胚相对卵裂期胚胎延长了体外培养时间,可在一定程度上对携带有遗传缺陷或低发育潜能的胚胎进行初步筛选和淘汰,而能够发育至囊胚的胚胎具有更高的发育潜能和临床种植能力,可获得更高的临床妊娠率[5]。临床妊娠率随着囊胚的扩张和孵化程度的增加而增加,部分研究虽然没有对不同扩张和孵化程度的囊胚进行临床妊娠率的比较,但也表明了移植评分高的囊胚及卵裂期胚胎可获得更高的临床妊娠率[6~8]。然而,本生殖中心对移植失败2次及2次以上的患者行冷冻胚胎冻融后囊胚培养,最终大部分只形成了Ⅰ期囊胚或者Ⅱ期囊胚(非优质囊胚)。其中AH组41个周期共解冻了155个D3胚胎,形成Ⅰ期和Ⅱ期囊胚共67个;常规组40个周期共解冻了149个D3胚胎,形成Ⅰ期和Ⅱ期囊胚共65个。两组Ⅰ、Ⅱ期囊胚形成率约为43.42%。
1995年Germond等[9]初次运用1.48μm二极管非接触式激光在鼠胚透明带上打孔,建立了安全并有效的胚胎AH程序,随后很多研究也证实了激光法是一种安全有效、操作简便的AH方法[4,10]。激光辅助孵化分为透明带打孔和削薄两种方式,透明带打孔会破坏其对内细胞团的保护。若打孔孔径较小,胚胎孵化不能进行自然薄化而致“8”字型孵化,胚胎将无法完全孵出易发生嵌顿[4];若打孔孔径较大,胚胎提前孵化而致另一相同胚胎的形成,即同卵双生[11]。因此,对孔径大小的把握在透明带打孔的运用中也很关键。另有研究报道,囊胚期采用激光破膜技术进行AH,可避免囊胚的机械性损伤[12]。因为胚胎发育至囊胚时,体积扩张,滋养层细胞与透明带结合较紧,此时的囊胚腔不能耐受外界挤压,若采用机械的AH易造成囊胚腔破裂。另外,囊胚的滋养细胞数目较多且已分化,打孔部位有外滋养层保护,不会伤及到内细胞团,故对胚胎的影响也不大。所以,胚胎位于囊胚期进行AH更加符合生理[13]。迟琳琳等发现,激光破膜技术的AH,有助于胚胎孵化,很大程度增加着床的可能性。针对连续两次或两次以上移植失败的患者,本中心解冻Day3的冷冻胚胎继续培养2d待囊胚形成,并在移植前进行AH,发现激光破膜术有助于提高Ⅰ、Ⅱ期囊胚的种植率和临床妊娠率。目前,年龄是已知的影响体外受精治疗成功率的重要因素之一,随着女性年龄的不断增大,其卵巢储备库卵母细胞数目、质量和贮存能力均在逐步减退[14,15]。本研究中,患者年龄均≥35岁,高龄、胚胎冷冻复苏和体外培养时间较长,三重影响使透明带变硬、弹性变小,进而影响囊胚扩张和透明带破裂导致孵出困难[16]。若对胚胎进行AH,则有助于囊胚的孵出,促使其种植,提高妊娠率。另外,透明带厚度、子宫内膜环境等均可能影响胚胎孵出和种植率。在本研究中,两组患者其他影响因素之间均无显著差异,AH组Ⅰ、Ⅱ期囊胚的种植率为26.87%,临床妊娠率为34.15%,均高于常规组,且具有统计学意义。但最新有研究证明激光法并不能提高临床妊娠率[17],本研究与其不一致,后续需要加大临床样本量,仍需要开展更多的临床对照实验。AH组41周期中活产10例,活产率为24.39%;常规组40周期中活产6例,活产率为15.00%。两组比较无统计学意义。与最新meta分析的结果[17]即AH不能增加胚胎活产率一致,但AH能否提高Ⅰ、Ⅱ期囊胚的活产率并未见报道。 虽然有研究报道激光打孔会提高囊胚的嵌顿率,但本研究中未发现。另外,可能是因为打孔孔径过大,在本研究中,同卵双生发生1例。
综上所述,对于多次移植失败的高龄(≥35岁)患者,激光破膜术有助于提高非优质囊胚的种植率和临床妊娠率,因此对于多次移植失败的高龄患者或者胚胎质量欠缺的患者有必要进行Ⅰ、Ⅱ期囊胚的移植和激光破膜术的应用。本研究存在临床样本量小的特点,未来需要加大样本量,加强研究,以进一步了解辅助孵化与临床结局(活产率)的关系,进而为广大高龄妇女和妊娠结局不良的患者带来福音。

