六味地黄丸在胰岛素抵抗的人脐静脉内皮细胞氧化应激损伤中的作用
于 洋 李 垚 林宇涵
(锦州医科大学生理学教研室,辽宁 锦州 121001)
胰岛素抵抗(IR)是2型糖尿病(T2DM)及其血管并发症发生发展的最重要和最根本原因〔1〕。糖尿病(DM)代谢紊乱时造成的氧化应激(OS)不但是T2DM及血管并发症的重要机制,也是导致IR状态下内皮细胞功能不全(ECD)发病机制中重要的作用环节〔2〕。 “补阴方药之祖”六味地黄丸(LWDHP)具有抗OS、降糖降脂之功效,临床应用其治疗因OS引起的DM取得非凡的效果〔3〕。本实验通过研究LWDHP对IR状态内皮细胞的活性氧(ROS)含量、非(不)对称二甲基精氨酸(ADMA)浓度及相关基因二甲基精氨酸二甲胺水解酶(DDAH)2表达的影响,以期揭示LWDHP对IR的作用及改善机制。
1 材料与方法
1.1细胞株 EA.hy926人脐静脉内皮细胞(HUVEC),中国科学院上海生命科学研究院细胞资源中心。
1.2主要试剂 LWDHP(浓缩丸),北京同仁堂(国药准字Z19993068);DDAH2一抗,鼠抗人甘油醛-3-磷酸脱氢酶(GAPDH)一抗,美国Proteintech Group公司;辣根过氧化物酶(HRP)标记的羊抗兔、羊抗鼠IgG二抗,Cell Signaling Technology公司;RT-PCR试剂盒,TaKaRa公司;软脂酸(PA),Sigma公司;二甲双胍(MET),上海生工生物工程有限公司;ADMA的酶联免疫吸附实验(ELISA)检测试剂盒,上海酶联生物科技有限公司;ROS检测试剂盒、DCFH-DA荧光探针,碧云天生物技术有限公司;其他试剂均为国产分析纯。
1.3LWDHP中药组含药血清的制备 SPF级SD大鼠〔辽宁长生生物技术有限公司,许可证号:SCXK(辽)2010-0001〕,体质量300~350 g,雌雄各半。标准环境下适应性喂养3 d后,按随机数字法分为两组,34只为正常对照组,18只为LWDHP中药组。中药组给予LWDHP粉末水溶液(生药质量浓度为15 g·kg-1·d-1)灌胃,3 ml/次/只,2次/d;正常对照组给予等体积的生理盐水,连续灌胃5 d。第6天于末次给药1~2 h后10%水合氯醛腹腔麻醉,1.5 ml/只,打开腹腔,腹主动脉采血,血液自然凝固分离血清,56℃水浴灭活30 min,过滤除菌,分装,封口,-80℃保存备用。
1.4ELISA法检测细胞培养基中ADMA浓度 调整细胞密度为0.5×105个/ml接种到96孔培养板中,分为正常对照组、模型组(PA组)、LWDHP中药组(2.5%、5.0%、10.0%含药血清)、MET组,于37℃、5% CO2的孵育箱中培养。待细胞90%生长融合后,正常对照组、PA组和MET组加入无血清的DMEM培养基及空白血清(终浓度为20%);LWDHP中药组加入LWDHP含药血清,终浓度分别为2.5%、5.0%、10.0%,另以空白血清将血清终浓度补充为20%;MET组加入MET使其终浓度为2 mmol/L,继续培养干预保护24 h。加入PA使其终浓度为400 μmol/L,孵育1 h后,再加入胰岛素使其终浓度为50 nmol/L,PA作用细胞24 h后,收集各组培养基。按照ADMA浓度检测试剂盒的步骤进行操作,用酶标仪在450 nm波长下测定OD值,通过标准曲线计算样品中ADMA浓度。
1.5细胞内ROS检测 6孔培养板接种HUVEC,当细胞贴壁生长至70%~80%融合度,药物处理同1.4,用磷酸盐缓冲液(PBS)洗涤细胞3次,然后加入10 μmol/L DCFH-DA,培养箱内孵育30 min,每隔3~5 min颠倒混匀一次,使探针和细胞充分接触。用无血清DMEM培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。使用多功能酶标仪在488 nm激发波长、525 nm发射波长下检测荧光强度。
1.6RT-PCR测定细胞DDAH2 mRNA的表达 将细胞按5×105个/ml 密度接种到25 cm2培养瓶内,分成正常对照组、PA组、5% LWDHP含药血清治疗组、MET组。各组细胞药物处理同1.4,收集细胞,提取细胞总RNA。随后用RT-PCR 试剂盒进行逆转录及聚合酶链反应。β-actin上游引物序列:5′-ACACGAAAGCAATGCTATCACCTC-3′,下游引物序列:5′-TGACAGCAGTCGGTTGGAGCGA-3′,扩增片段长度153 bp。反应条件为94℃ 2 min,94℃ 30 s,60℃ 30 s,72℃ 1 min,72℃ 5 min,40个循环。DDAH2上游引物序列:5′-TTCTCCACCAACTCTGTCCTC-3′,下游引物序列:5′-CAACCGCTCGGATTTCTTA-3′,扩增片段长度124 bp。反应条件:退火56℃,32个循环。通过凝胶成像系统以DDAH2条带光密度值和对应的β-actin条带光密度值的比值表示DDAH2 mRNA的表达量。
1.7Western印迹测定细胞DDAH2蛋白表达 细胞分组同1.6,加药处理同1.4,收集细胞提总蛋白。调整各组的蛋白质上样量(40 μg),进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,转膜,5%脱脂奶粉37℃水浴震荡封闭1 h,加入DDAH2一抗(1∶500稀释),4℃过夜。含吐温-20的Tris缓冲液(TBST)清洗3次,5 min/次,HRP标记IgG二抗(1∶2 000稀释),TBST清洗4次,5 min/次,37℃水浴震荡2 h,二氨基联苯胺(DAB)显色,扫描条带,以GAPDH作为内参,DDAH2和GAPDH蛋白表达强度进行灰度比值显示DDAH2相对表达量。
1.8统计学方法 使用SPSS20.0软件进行单因素方差分析后进行组间LSD分析。
2 结 果
2.1各组细胞培养基中ADMA浓度测定 模型组ADMA浓度〔(7.61±0.55)μmol/L〕明显增高,与正常对照组〔(3.57±0.32)μmol/L〕比较差异有统计学意义(P<0.01)。2.5% LWDHP含药血清组的ADMA浓度〔(7.18±0.44)μmol/L〕降低不明显,与模型组差异无统计学意义(P>0.05),5.0%和10.0% LWDHP含药血清和MET能显著降低ADMA浓度,分别为(5.96±0.27),(5.73±0.35),(5.96±0.47)μmol/L,与模型组比较差异有统计学意义(P<0.01)。
2.2各组细胞内ROS含量的检测 模型组细胞内ROS含量(70.26±1.61)明显增高,与正常对照组(20.69±1.34)比较差异有统计学意义(P<0.01)。2.5% LWDHP含药血清组的ROS含量(68.25±0.55)降低不明显,与模型组比较差异无统计学意义(P>0.05),5.0%和10.0% LWDHP含药血清和MET能显著降低ROS含量(分别为52.58±0.66,54.47±0.97,56.50±1.10),与模型组比较差异有统计学意义(P<0.01)。
2.3LWDHP对细胞DDAH2 mRNA表达的影响 与正常对照组(0.476 2±0.000 1)比,PA组(0.335 6±0.001 1)细胞内DDAH2 mRNA的表达量显著降低(P<0.01)。与PA组比,5% LWDHP含药血清组(0.458 8±0.000 7)和MET组(0.577 2±0.000 6)细胞内DDAH2 mRNA表达量明显升高(P<0.01),说明 LWDHP预处理可以促进PA诱导的EA.hy926细胞内DDAH2 mRNA的表达量。见图1。
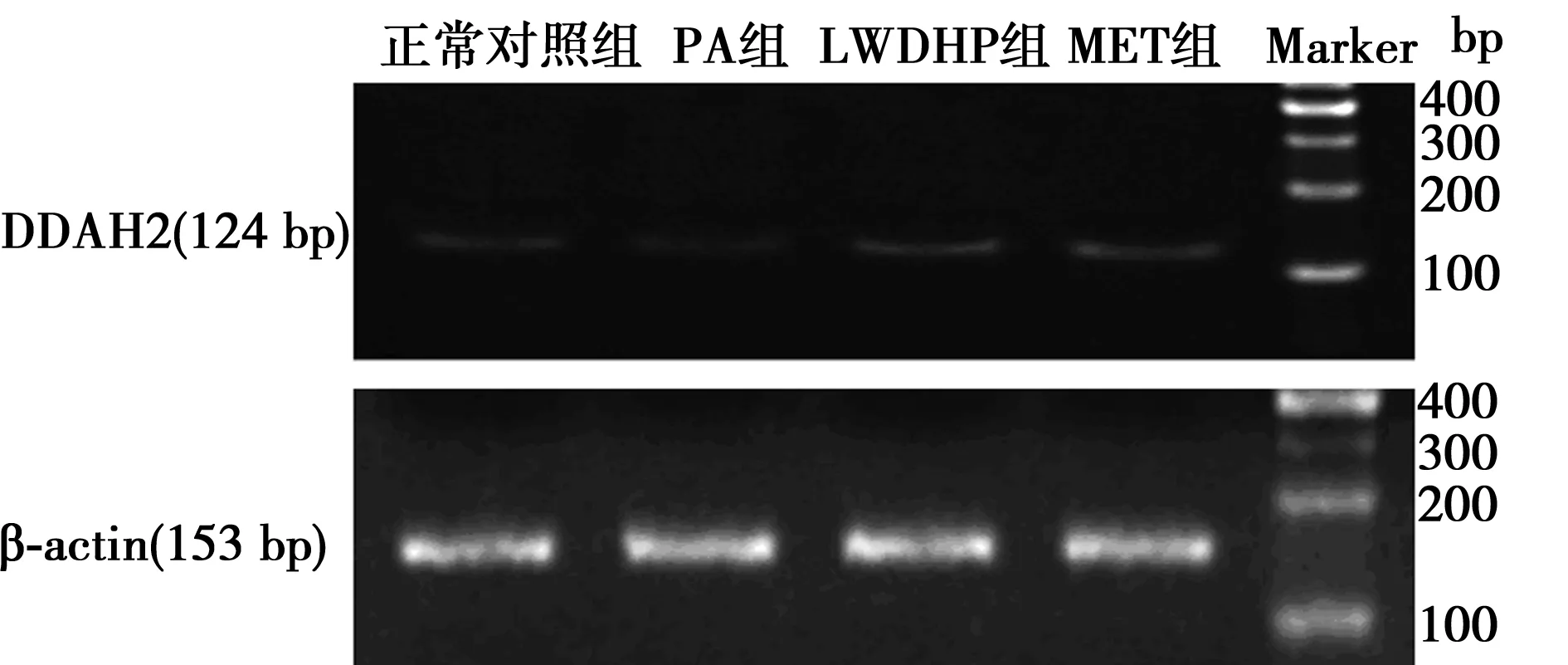
图1 各组细胞DDAH2 mRNA表达的比较
2.4LWDHP对细胞DDAH2 蛋白表达的影响 与正常对照组(0.286 6±0.000 4)比较,PA组(0.110 9±0.000 3)细胞内DDAH2蛋白的表达量显著下降(P<0.01)。5% LWDHP含药血清组(0.350 4±0.000 7)和MET组(0.271 9±0.000 3)与PA组比较,细胞内DDAH2蛋白表达量均升高(P<0.01),意味着 LWDHP同样也可以促进PA诱导的EA.hy926细胞内DDAH2蛋白的表达。见图2。

图2 各组细胞DDAH2 蛋白表达的比较
3 讨 论
IR是指各种原因使胰岛素作用的靶器官或靶组织对内源性或外源性胰岛素的敏感性及反应性下降,葡萄糖摄取和利用的效率下降,机体代偿性分泌过多胰岛素产生高胰岛素血症。目前认为DM的病理发病基础之一是IR〔4〕。有学者提出“共同土壤学说”,即OS是IR、DM和心血管疾病的共同发病基础,目前已经成了不争的事实。而且在OS导致的疾病中,与IR及DM的关系一直是国内外学者研究的热点〔5〕。
有学者认为IR引起的ECD会导致内皮细胞(EC)产生更多的ROS〔6〕。有实验已经证明PA损伤HUVEC后,细胞裂解液中的抗氧化酶总超氧化物歧化酶(SOD)活性下降,氧自由基最重要的终产物之一丙二醛(MDA)含量增高,ROS产生的关键酶NADPH 氧化酶(NOX)4 mRNA和蛋白的表达量明显升高〔7〕。本实验研究也证明了PA损伤HUVEC造成IR状态后,细胞内ROS含量明显增高,就说明IR会使EC严重受损,膜的完整性被破坏,更加证明了PA可通过NOX4诱导EC产生ROS,从而对细胞造成氧化损伤。
ADMA是一种广泛存在于组织和细胞中的天然氨基酸,近几年已经成为一种新的心血管疾病的危险因子。临床实验研究表明,T2DM患者在内皮依赖性血管舒张功能减弱的同时会有ADMA水平升高,而且ECD的严重程度与血浆中ADMA水平呈正相关,就能够推测ADMA可能是IR与DM及其血管并发症发生的一种强大的而且独立的评价血管ECD一种新的危险预测因子〔8〕。90%以上的ADMA是在DDAH2的作用下降解失活的,生成胍氨酸、二甲基或单甲基,经肾脏排出体外。因此,DDAH2活性大小对调节ADMA的水平起着关键性作用,那么导致DDAH2活性降低的因素均可引起ADMA浓度增加〔9〕。本实验中在PA损伤HUVEC后,检测到细胞培养基中ADMA浓度明显增高,细胞内DDAH2 mRNA和蛋白的表达量显著降低,推测损伤的EC中ADMA-DDAH2代谢轴存在异常,说明ECD时造成的OS反应导致了DDAH2下降,从而增加了ADMA浓度,进一步加重OS反应。
气虚阴亏是DM 发生的基本病因病机,LWDHP是滋补气阴两虚的传统名方,临床上用以治疗DM显现出明显的优势〔10〕。有学者对LWDHP清除自由基、抗氧化的作用进行了研究,发现LWDHP能提高睡眠剥夺大鼠血清SOD活性,加速自由基清除〔11〕。本实验研究表明LWDHP含药血清能显著降低ROS含量,同时促进细胞内DDAH2 mRNA和蛋白的表达,从而降低ADMA的含量,证明LWDHP含药血清能降低PA对HUVEC的氧化损伤程度,抑制OS反应,增强抗氧化作用,有助于改善受损血管EC功能。

