脊髓自噬功能激活与大鼠2型糖尿病神经病理性疼痛的关系*
朱雅冰, 贾改丽, 陆嘉辉, 张茂表, 李 军, 曹 红
(温州医科大学附属第二医院麻醉科, 浙江 温州 325027)
根据国际糖尿病联盟(IDF)统计,至2015年全球大约有4.15亿糖尿病患者,2040年将达到6.42亿,其中2型糖尿病患者占90%以上[1]。糖尿病周围神经病变是糖尿病最常见的并发症之一,发病率高达50%[2],其中30%以上的患者会出现糖尿病神经病理性疼痛 (diabetic neuropathic pain,DNP)[3-5],临床上表现为自发性疼痛、痛觉过敏和异常性疼痛[1],严重影响患者的生活质量。自噬作为一种清除细胞内衰老蛋白和损伤细胞器的保护性机制,被认为参与2型糖尿病的形成[6]。最近研究表明,大鼠脊髓自噬激活参与腹腔单次注射STZ诱导的1型糖尿病神经病理性疼痛模型的形成[7]。虽然1型糖尿病和2型糖尿病所产生的神经性疾病在症状上十分相似,但其机制有本质的差别[8,9]。脊髓自噬是否参与2型糖尿病神经病理性疼痛尚未见报道,因此本研究采用高糖高脂饮食复合腹腔注射小剂量STZ诱导2型糖尿病神经病理性疼痛模型,通过检测自噬标记物在2型糖尿病神经病理性疼痛中的表达,探讨自噬在2型糖尿病神经病理性疼痛中的作用。
1 材料和方法
1.1 主要试剂
抗LC3抗体,抗P62抗体,抗GFAP抗体,抗OX-42抗体,抗DAPI抗体购于Abcam公司;抗Beclin-1抗体,抗P62抗体购于CST公司;抗NeuN抗体购于Millipore公司;Alexa Fluor®546驴抗小鼠IgG,Alexa Fluor®488驴抗兔IgG 购于Invitrogen公司。
1.2 动物模型制备及分组
雄性清洁级SD大鼠,体重(120~160) g,购自温州医科大学实验动物中心。按照随机数字表法[10],将大鼠分为C组 (普通饲料喂养,n=18),D组 (高糖高脂饲料喂养,n=42)。实验开始及饲养第8周测体重、空腹血糖。第8周末,采大鼠尾静脉血测胰岛素水平并计算胰岛素敏感指数;测大鼠的机械缩足阈值 (mechanical withdrawal threshold,MWT) 和热缩足潜伏期(thermal withdrawal latency,TWL),记作基础值。第9周,D组大鼠按35 mg/kg的剂量单次腹腔注射STZ,3 d后血糖稳定且≥16.7 mmol/L则认为2型糖尿病模型大鼠造模成功,第11周再次测定大鼠MWT和TWL,数值降至基础值80%以下者为2型糖尿病神经病理性疼痛大鼠[11-13],记为DNP组;数值未降至基础值80%以下者为2型糖尿病无神经病理性疼痛大鼠,记为DA组。
1.3 胰岛素测定及胰岛素敏感性指数计算
采大鼠尾静脉血1 ml,4℃离心30 min取上清液,使用双抗体夹心ELISA法制作标准曲线,测量样本胰岛素浓度,计算胰岛素敏感指数 (insulin sensitivity index,ISI)。ISI=1/(空腹血糖×空腹胰岛素浓度),由于此值系非正态分布,故取其自然对数[14]。
1.4 行为学测试
分别于注射STZ前、注射STZ 2周后及确定分组后第3、7、14天,测定机械缩足阈值 (MWT) 和热缩足潜伏期 (TWL)。测定在安静环境下进行,测定时间固定在8:00-16:00。
1.4.1 机械缩足阈值测定 参照文献方法[15]使用IITC-2390型触觉测痛仪 (Electronic Von Fery, IITC公司,美国) 测定MWT:待大鼠安静后,垂直刺激大鼠后趾,单次刺激时间≤1 s,间隔10 s。大鼠出现抬足或舔足行为为阳性反应,记录此时的刺激强度值,测定5次,除去最大值与最小值,计算其余3次的平均值作为其MWT。
1.4.2 热缩足潜伏期测定 将大鼠置于透明玻璃箱中,安静后用IITC336甩尾足底测试仪 (IITC公司,美国) 测定TWL。使用测试仪的光源照射后趾,记录从照射到出现大鼠抬足或舔足等回避行为的时间间隔,双足各测定5次,每次测量间隔5 min,去除最大值和最小值,计算其余3次的平均值作为其TWL。
1.5 脊髓背角微管轻链相关蛋白(LC3)、Beclin-1和P62检测
各时间点行为学测定结束后,每组随机抽取6只大鼠,5%水合氯醛麻醉,取大鼠L4~L6节段脊髓,加入裂解液研磨,超声处理5 min~3次,4℃离心30 min,使用BCA法测定上清液蛋白质浓度。用8%胶浓度作SDS-PAGE分离上样缓冲液,转移到孔径0.45 μm PVDF膜上,常温封闭2 h。加入抗LC3 (1∶1 000,Abcam)、抗Beclin-1 (1∶500,CST)和抗P62 (1∶1 000,CST)单克隆抗体,4℃过夜。室温下用TBST洗10 min×3次,加入HRP标记的羊抗兔二抗,室温孵育2 h,用TBST洗10 min×3次。使用DNR Miro Chemi化学发光法曝光、拍照,采用Quantity One软件分析,以与内参β-actin吸光度的比值反映LC3-I、LC3-II、Beclin-1和P62的表达水平。
1.6 免疫荧光
5%水合氯醛 (350 mg/kg,Sigma) 麻醉分组7 d DNP组大鼠,用0.9%氯化钠溶液200 ml心脏冲洗后,用20℃含4%多聚甲醛的0.01 mol/L的PBS 400 ml灌注。在L4~L6脊髓膨大处,取长约2 cm的脊髓组织,置4℃含4%甲醛的0.01 mol/L的PBS中固定4~8 h,依次放于10%、20%、30%蔗糖溶液中脱水12 h。OTC包埋剂包埋脊髓组织,于-20℃恒温冰冻切成10 μm厚切片,用0.01 mol/L PBS清洗20 min×3次。在37℃恒温箱中用封闭液 (含0.3% Triton、3%驴血清、0.01 mol/L PBS) 封闭1 h,将抗P62抗体 (1∶100) 分别与抗GFAP抗体 (1∶1 000)、抗OX-42抗体 (1∶200) 和抗NeuN抗体 (1∶500) 于4 ℃孵育12 h,常温下复温1 h,用0.01 mol/L PBS在摇床上清洗10 min×3次。加Alexa Fluor® 546 驴抗小鼠IgG、Alexa Fluor®488驴抗大鼠IgG (1∶1 000) 置37 ℃恒温箱中避光孵育2 h,用0.01 mol/L PBS清洗10 min×3次,DAPI (Abcam) 染色5 min,再次用0.01 mol/L PBS清洗10 min×3次,荧光猝灭剂封片,荧光显微镜下观察切片、Image-Pro Plus 软件分析。
1.7 统计学处理
2 结果
2.1 大鼠血糖、胰岛素和胰岛素敏感性指数
实验8周后,与C组相比,D组大鼠的体重明显增加 (P<0.05,图1);血糖升高,但尚未达到糖尿病诊断标准(≥16.7 mmol/L);大鼠空腹胰岛素水平增加 (P<0.05),胰岛素敏感性指数(ISI)下调 (P<0.05,表1),提示出现胰岛素抵抗。D组大鼠在注射STZ 3 d后,血糖明显上升(P<0.05,表1)


2.2 痛阈变化
与C组、DA组比较,DNP组第3、7和14天时MWT降低,TWL缩短 (P<0.05),且C组与DA组比较差异无统计学意义(图2)。表明部分2型糖尿病大鼠出现触痛异常和热痛过敏。
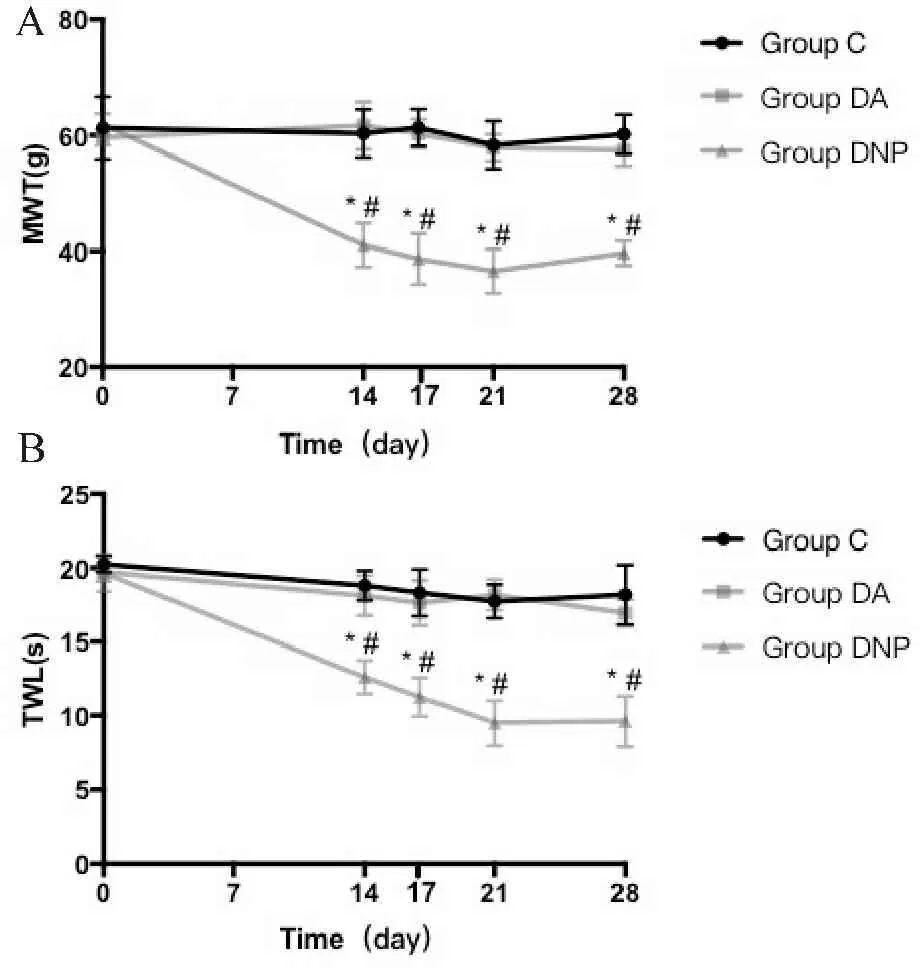
Fig.2Mechanical withdrawal threshold and thermal withdrawal latency of rats in the three groups at different observation points

Note: The ‘0’ on the abscissa represents the base value, ‘14’ means on the 14th day after STZ injection; ‘17’, ‘21’ and ‘28’ mean on the 3rd, the 7th and the 14th day after grouping respectively
*P<0.05vsC group;#P<0.05vsDA group
2.3 脊髓背角LC3、Beclin-1和P62表达
Western blot结果显示,与C组相比,DA组LC3-II水平明显增高 (P<0.05),表明自噬体合成增加,但DA组P62、Beclin-1水平与C组相比无明显差异。与C组相比,DNP组LC3-II、Beclin-1水平明显增高 (P<0.05),并且P62表达下降 (P<0.05),表明DNP组大鼠脊髓自噬功能激活。同时发现,DNP组大鼠LC3-II水平较DA组明显增高且差异有统计学意义 (P<0.05),表明DNP组大鼠自噬水平可能比DA组大鼠高。LC3-I的表达量在三组大鼠之间无明显改变 (P>0.05,图3)。


GroupFasting blood glucose (mmol/L)0 week8th weekend3 d after STZ injectionInsulin levels (mIU/L)8th weekendISI (insulin sensitivity index) 8th weekendC3.06±0.423.93±0.483.95±0.6516.29±2.90-4.13±0.17D2.95±0.465.76±0.9729.83±3.10*40.07±7.64*-5.41±0.25*
C: Normal group; D: The group of rats fed with high sugar and high fat diet
*P<0.05vsC group

Fig.3The expression of LC3-I、LC3-II、Beclin-1 and P62 in the spinal cord

*P<0.05vsgroup C;#P<0.05vsgroup DA
2.4 脊髓背角P62与星形胶质细胞、小胶质细胞和神经元荧光双染
目前,免疫荧光抗体并不能很好地区分LC3-I和LC3-II,因此选择自噬底物P62研究2型糖尿病大鼠中自噬体的细胞定位。免疫荧光结果显示,P62表达于脊髓背角且主要与神经元标记物NeuN共存,少部分P62与小胶质细胞标记物OX42共存,几乎不与星形细胞标志物GFAP共定位(图4,见彩图页Ⅱ)。表明2型糖尿病神经病理性疼痛大鼠脊髓自噬功能的活化主要发生在神经元中,少部分出现在小胶质细胞内。
3 讨论
虽然1型糖尿病和2型糖尿病产生的神经性疾病的症状十分相似,但其发病机制有着本质差别[8,9]。在1型糖尿病患者,控制血糖能有效缓解神经症状;但在2型糖尿病患者,控制血糖的作用起效甚微[16]。在临床上的糖尿病人群中,只有5%~10%为1型糖尿病,2型占了约90%[17]。本研究采用高糖高脂饮食诱导胰岛素抵抗复合腹腔小剂量注射STZ的方法制备了2型糖尿病神经病理性痛大鼠模型[11-13],与单次大剂量注射STZ诱导的1型糖尿病模型相比,更具有临床意义。实验结果表明,与C组、DA组相比,DNP组MWT下降,TWL缩短,表明部分2型糖尿病大鼠出现神经病理性疼痛。
自噬是一种维持细胞稳态的保护机制,例如细胞质,蛋白质和细胞器流通周转[18]。一系列环境应激和细胞应激,如营养缺乏、免疫刺激及内质网应激等诱导自噬产生[19]。正常条件下自噬保持在较低的基础水平[20],在代谢性疾病[21]、神经退行性疾病[22,23]、炎症性疾病[24]以及癌症[25]等病理情况下会出现自噬功能失调。其中,自噬作为2型糖尿病病理进展的重要参与者被广泛研究,并被指出是一种新的治疗靶点[6]。神经病理性疼痛是2型糖尿病的常见并发症,研究表明自噬在神经病理性疼痛的发生发展中起着重要作用[26],但自噬是否参与2型糖尿病神经病理性疼痛尚未可知。
在酶的分解和酯化作用下,胞质型微管相关蛋白1的轻链亚基 (microtubule-associated protein-1 light-chain 3)即LC3-I转变为膜型,即LC3-Ⅱ,LC3-II被纳入自噬体[27],形成环状结构,组装自噬体[28]。LC3-II的含量增加常表示细胞自噬功能增强,因此认为LC3-II是评价自噬激活的生物标志物[29]。但LC3-II增加可以由自噬诱导产生,也可以由后期任意步骤(例如与溶酶体融合或内容物降解)损伤产生[30],因此共同研究LC3与组成自噬体的其他成分 (如自噬相关蛋白Beclin-1) 以及自噬溶酶体底物(P62)是更可取的研究方法。自噬诱导后,Beclin-l从Bcl-2上分离,与Vps34、Vps15、自噬相关蛋白和紫外线辐射抵抗相关基因(UV radiation resistance associated gene, UVRAG)组成复合物,招募其他的Atg组成前自噬体结构,促进自噬体的形成以及成熟[31],因此调节蛋白Beclin-l表达增加同样也表示自噬功能增强[32]。P62是一种自噬底物蛋白,P62和与其结合的多聚泛素化蛋白被完整的自噬小体吞噬,随着自噬小体在溶酶体中降解而被消除,细胞内P62的堆积表明细胞自噬功能受损[33]。
本研究结果提示,与正常组大鼠相比,DA组大鼠无神经病理性疼痛形成,但脊髓LC3-II水平升高,而Beclin-1和P62无明显改变,提示糖尿病无神经病理性疼痛大鼠的自噬水平只停留在自噬体形成的早期阶段,并无后续的自噬体成熟、降解底物的过程。与正常组大鼠相比,DNP组大鼠MWT降低、TWL缩短,大鼠脊髓LC3-II和Beclin-1蛋白质表达增加,P62表达减少,提示2型糖尿病神经病理性疼痛大鼠脊髓自噬功能增强。DNP组大鼠的LC3-II水平高于DA组,表明糖尿病神经病理性疼痛大鼠的自噬水平高于糖尿病无神经病理性疼痛大鼠。P62的免疫荧光双染色结果提示,2型糖尿病神经病理性疼痛大鼠脊髓自噬功能活化主要发生在脊髓背角神经元中,少部分出现在小胶质细胞内,提示脊髓背角神经元的自噬水平在2型糖尿病神经病理性疼痛的发生发展中起着关键作用,少部分出现在小胶质细胞内的自噬激活可能与炎症有关[34]。有研究提示,GABA能抑制性神经元自噬水平过度激活可诱导细胞2型程序型死亡,最终导致神经元的丢失,在大鼠脊神经结扎(SNL)诱导的大鼠神经病理性疼痛中发挥重要作用,使用自噬抑制剂三甲基腺嘌呤(3-methyladenine, 3-MA)能显著缓解这种疼痛[35]。本研究表明,脊髓背角神经元自噬功能的激活主要参与2型DNP,但GABA能抑制性神经元是否参与其中尚待进一步研究。

