异常威克汉逊酵母的麸曲制作工艺优化
夏玙,谢军,黄丹,罗惠波,2,*,杨文斌
(1.四川理工学院生物工程学院,四川自贡643000;2.酿酒生物技术及应用四川省重点实验室,四川自贡643000;3.四川省食品药品检验检测院,四川成都611700)
被称为“酒之骨”的曲,其创新和发展一直处于重要地位[1]。麸曲制作属熟料制曲范畴[2]。麸曲制作在于新菌种开发应用,保持功能菌性状稳定,制作技术创新等方向上努力改进[3]。酵母麸曲以麸皮为原料,蒸熟后接入纯种酵母,人工培养的酶制剂[4]。现阶段,多数采用将霉菌、酵母应用到麸曲中,用大曲与麸曲混合、小曲与麸曲混合的方法来提高白酒的品质[5]。目前,鲜有纯种酵母麸曲的相关报道。
早年,对麸曲原料研究较多。赵希玉等[6]以麸皮为培养基,加少量玉米面,并添加少量鲜酒糟调节酸度,对生香酵母的培养温度控制在34℃~37℃之间,培养时间48 h。麸曲制作常用熟料,为了节省一部分成本,尹召军等[7]采用生料、熟料混合配制根霉麸曲,生熟料之比(质量比)为4∶6,麸曲接种量为0.8%,水分含量为50%。对不同菌种的麸曲制作也是研究的一大方向。武顺等[8]采用响应面法对产吡嗪细菌的麸曲制作工艺进行了优化研究。郭凯凯等[9]将高产酯酿酒活性干酵母用于清香麸曲酒中,提高了乙酸乙酯和总酯的含量,酒质得到提升。姜鹏[10]将酵母菌S1并制成麸曲,按所需小麦总重量的0.5%、1%添加到粉碎后原料中,制成高酯强化大曲,其白酒出酒率、优质品率、原酒总酸和总酯量均得到有效提高。本试验以酵母w2在麸曲中的活菌总数为检测指标,优化酵母麸曲制作中原料配比和培养条件的工艺,并初步应用于小曲清香酒。
1 材料与方法
1.1 材料
酵母w2:异常威克汉逊酵母(wickerhamomyces anomalus),浓香型大曲筛选分离所得;YPD培养基:酵母膏 5 g,蛋白胨 10 g,葡萄糖 10 g,琼脂 10 g;孟加拉红培养基:蛋白胨5 g,磷酸二氢钾1 g,氯霉素0.1 g,硫酸镁0.5 g,葡萄糖10 g,孟加拉红0.032 g,琼脂18.5 g;9%生理盐水;麸皮、鲜酒糟、玉米粉:市售。
1.2 仪器及设备
LS-I201微生物培养箱:飞世尔实验器材(上海)有限公司;EWYR-D2403恒温培养振荡器:上海智城分析仪器制造有限公司;HT300A自动固相微萃取仪:意大利HTA公司;Agligent 7890A-5975B型气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS):美国安捷伦公司;50/30 μm DVB/CAR on PDMS萃取头:上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 酵母麸曲原料配比用量确定方法
试验酵母麸曲原料主要为麸皮、玉米粉、鲜酒糟。为研究酵母w2在酵母麸曲不同原料配比下的生长情况,三角瓶小试以各单因素梯度变化,从而确定出酵母w2的麸曲原料配比。
1.3.1.1 麸皮用量确定
配制麸皮用量梯度的酵母麸曲:现称量麸皮分别为 4、6、8、10、12、14、16 g,玉米粉均为 2 g,鲜酒糟均为4 g于250 mL三角瓶中,水分20%。121℃条件下,灭菌30 min。采用10%的接种量,将酵母w2种子液接种到不同麸皮量的三角瓶中,用玻璃棒充分搅拌均匀,4层纱布封盖,给予足够的通氧量。置25℃的恒温培养箱中培养36 h。
1.3.1.2 鲜酒糟用量确定
称量鲜酒糟分别为 1、2、3、4、5、6、7、8 g,麸皮均为10 g,玉米粉均为2 g于250 mL三角瓶中,水分20%。无菌操作,按10%的接种量。培养方式同1.3.1.1。
1.3.1.3 玉米粉用量确定
称量玉米粉分别为 0、1、2、3、4、5、6、7 g,麸皮均为10 g,鲜酒糟均为4 g于250 mL三角瓶中,水分20%。采用10%的酵母接种量。培养方式同1.3.1.1。
1.3.2 酵母麸曲培养条件的优化
应用1.3试验结果所得到的酵母麸曲的最佳原料配比,研究应用此原料配比的酵母麸曲,在不同水分含量、培养时间、培养温度下酵母的最佳生长量。
1.3.2.1 不同水分含量对酵母生长量的影响
接种10%酵母w2种子液在水分含量(质量分数)分别为5%、10%、15%、20%、25%、30%、35%、40%的酵母麸曲原料配方中。给予足够的通氧量,放置25℃恒温培养箱中培养36 h。
1.3.2.2 不同培养时间对酵母生长量的影响
采用10%接种量,水分含量为20%,麸曲原料配比同1.3.2.1。将接种好的酵母麸曲放置在25℃培养箱中,分别培养 12、24、36、48、60、72 h。
1.3.2.3 不同培养温度对酵母生长量的影响
采用10%的接种量,水分含量为20%。将已接种的酵母麸曲分别放置于 12、16、20、24、28、32、36 ℃温度的微生物培养箱中,培养36 h。
1.3.3 酵母麸曲活菌计数方法
制作菌悬液:每个样称量10 g酵母麸曲加入装有90 mL无菌9%生理盐水的250 mL三角瓶中,于恒温培养振荡器中28℃、100 r/min振荡30 min。菌液梯度稀释:无菌操作,取5支已灭菌装有9 mL 9%生理盐水的试管,依次稀释为 10-2、10-3、10-4、10-5、10-6浓度的菌悬液,用移液管分别移取1 mL菌悬液逐级稀释。涂布平板法:分别移取每个样品10-6浓度的菌液1 mL于孟加拉红平板培养基中,涂布后放置28℃恒温培养箱中培养36 h后,用菌落计数仪计数。
1.3.4 挥发性风味物质检测方法
酵母发酵液和酒液中挥发性风味物质的检测均采用此方法。固相微萃取条件:精确量取5 mL,55℃平衡10 min后萃取30 min。气相色谱条件:DB-WAX 60.0 m×0.25 mm×0.25 μm毛细管色谱柱;进样口温度230℃;不分流;程序升温,40℃保持1 min,5℃/min升到200℃,再以10℃/min升到230℃保持1 min;载气为99.999%氦气,载气流速为1 mL/min。质谱条件:电离电压70 eV,离子源温度230℃,四极杆温度150℃,电离方式EI,质量扫描范围20 amu~500 amu,溶剂延迟3 min。
1.3.5 酿酒试验
采用清香型小曲酒工艺,以2%的添加量,将最佳工艺酵母麸曲分别在糖化前(a)、糖化后(b)加入发酵糟中,以不加酵母麸曲为对照。工艺流程如下:
1.3.6 数据处理及图像处理方法
试验所得数据采用origin、Excel作图,SPSS 20.0进行方差分析,多重比较采用Duncans新复极差法进行差异显著性的分析,以P<0.05为差异显著。
2 结果与讨论
2.1 酵母w2挥发性风味代谢产物分析
对酵母w2液态发酵液进行代谢产物分析,如图1所示。
酵母w2代谢的主要产物为酯类、醇类物质,以乙酸乙酯、乙醇、苯乙醇、异戊醇、乙酸苯乙酯为主,相对含量分别为 49.008%、32.893%、6.619%、4.972%、2.928%。乙酸乙酯有水果香味,异戊醇有苹果白兰地和辛辣味,乙酸苯乙酯有甜蜜香味,苯乙醇有密香玫瑰味。酵母w2具有丰富的香甜味,可以应用到相应的酒等食品类,具有较高的风味价值。乙酸乙酯是清香型白酒的主体香,香味清新甜润,此酵母如能应用到清香型白酒中,能起到很好的提酯提味的效果,具有较高的应用开发潜质。
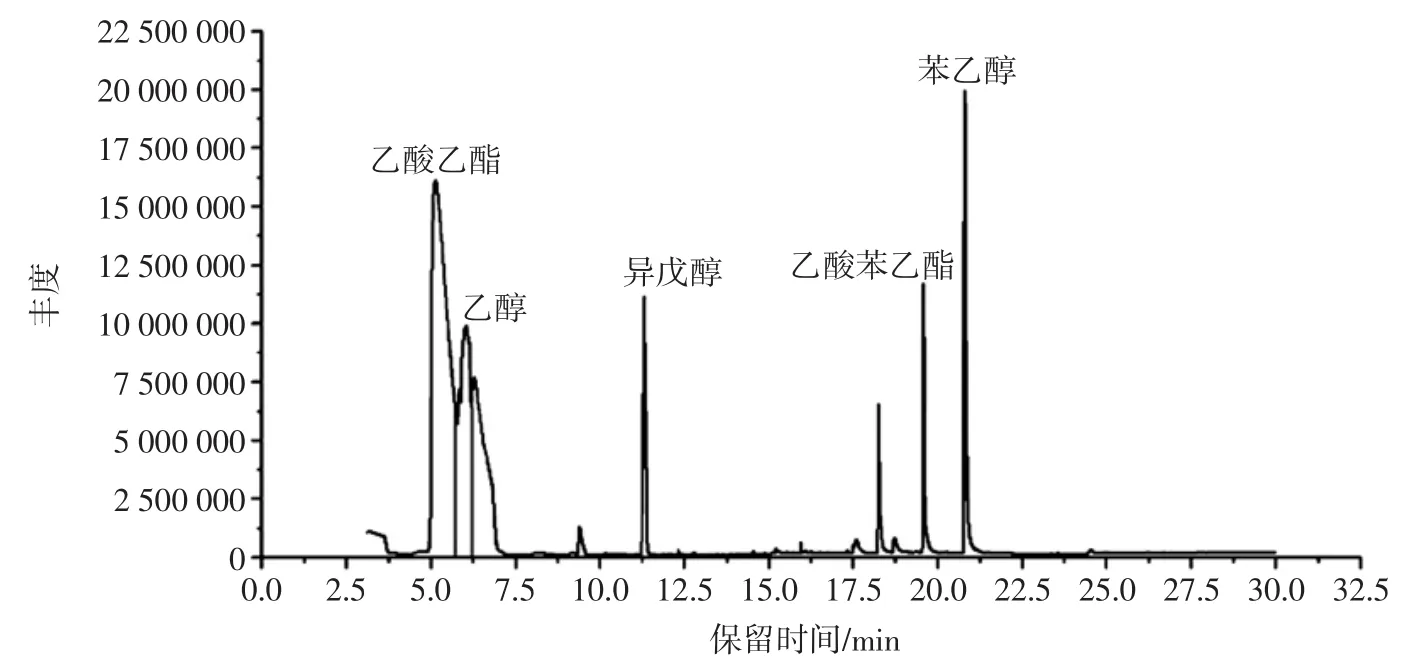
图1 酵母w2代谢产物GC-MS离子流色谱Fig.1 The GC-MS ion chromatography of metabolite by yeast w2
2.2 酵母麸曲原料用量单因素试验
张东平[11]对根霉酵母麸曲在白酒中的应用所用到的原料配比为:麸皮50%,鲜酒糟30%,玉米粉20%。黄光建等[12]对香醅配料进行优化,结果表明麸皮和鲜酒糟对酵母产酯的影响比较大,而玉米粉的影响不是太大。为了研究酵母w2在麸曲中应用,以酵母活菌数为衡量指标,得到酵母w2麸曲的原料配比。
2.2.1 麸皮用量确定
麸皮富含淀粉、维生素及无机盐等营养成分,且疏松多孔,有利于麸曲中酵母的生长代谢和通氧散热等。本试验对变量麸皮应用到酵母麸曲的结果如图2所示。

图2 麸皮添加量对酵母活菌数的影响Fig.2 The influence of amount of bran to viable count of yeast w2
由图2知,当麸皮添加量为6 g时,酵母活菌数显著高于其他麸皮添加量,其数量为1.27×108CFU/g,相当于其他添加量活菌数的1.6倍左右,在其他添加量下无显著差异。故可考虑酵母麸曲中麸皮用量占比为50%(6 g/12 g)。
2.2.2 鲜酒糟用量确定
鲜酒糟含有丰富的粗蛋白,同时还含有多种微量元素、维生素、氨基酸、还原糖等。将鲜酒糟应用于酵母麸曲的原料中,可为酵母提供较为丰富的营养料。本试验对变量鲜酒糟应用到酵母麸曲的结果如图3所示。
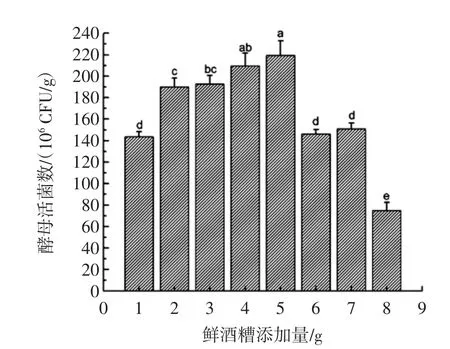
图3 鲜酒糟添加量对酵母活菌数的影响Fig.3 The influence of amount of fresh distillers grains to viable count of yeast w2
由图3知,随着鲜酒糟添加量的增加,酵母活菌数逐渐增加;而随着鲜酒糟添加量的继续增加超过一定数量,酵母活菌数呈显著下降趋势,而鲜酒糟过剩(>33.3%)会抑制部分酵母的生长。由此可知,一定量的鲜酒糟有利于酵母麸曲中酵母的生长。当鲜酒糟为4 g或5 g时,酵母活菌数无明显差异性且最有利于酵母w2的生长,可考虑鲜酒糟添加量为25%(4 g/16 g)~29.4%(5 g/17 g)范围内。
2.2.3 玉米粉用量确定
酵母的生长繁殖需要一定的碳源,玉米粉在微生物发酵中主要起碳源的作用,其中玉米粉还含有较多的生长因子。刘晓明等[13]研究酵母对不同碳源(包括玉米粉、麸皮、豆面、葡萄糖)的利用效果,结果表明玉米粉对酵母发酵为最佳碳源。本试验探究玉米粉用量对酵母生长的影响,试验结果如图4所示。
如图4,少量的玉米粉有利于酵母麸曲中发酵的酵母生长,其酵母活菌数几乎多了2倍。所以,玉米粉虽作为酵母必不可少的碳源,但只能是适量。当玉米粉的添加量达到4 g时,酵母活菌数最多,高达1.66×108CFU/g。可考虑酵母麸曲中原料玉米粉的占比为22%(4 g/18 g)。
综上所述,考虑取酵母w2麸曲的原料配比为(以总质量20 g计):麸皮 50%(10 g),鲜酒糟 28%(5.6 g),玉米粉 22%(4.4 g)。

图4 玉米粉添加量对酵母活菌数的影响Fig.4 The influence of amount of corn powder to viable count of yeast w2
2.3 酵母麸曲培养条件优化
通常制曲讲究培菌的工艺条件控制,一些主要的条件控制有温度、水分、时间、通氧量等[14]。本试验通过分别控制单因数的变量,探究酵母麸曲的质量的最佳培菌工艺条件。
2.3.1 水分含量对酵母生长量的影响
水分是微生物生长繁殖发酵代谢必不可少的资源之一,通常较高的湿度会有利于酵母的生长[15],但水分过多也会相应的抑制微生物的生长。控制酵母麸曲的水分含量试验结果如图5所示。
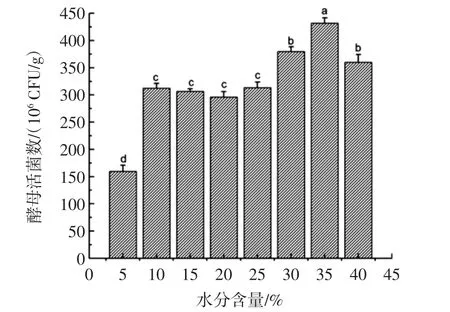
图5 水分含量对酵母活菌数的影响Fig.5 The influence of moisture content to viable count of yeast w2
如图5所示,当麸曲中水分含量只有5%时,酵母的活菌数只有1.5×108CFU/g,显著少于其他水分含量梯度的酵母量;随着水分含量的增加,其活菌数显著增加一倍并能维持在一定的数量;水分含量继续升高,当达到35%时,酵母活菌数达到峰值。酵母麸曲中单因素水分含量控制在35%左右,更利于酵母的生长。
2.3.2 不同培养时间对酵母生长量的影响
对酵母麸曲培养时间的控制,得到的结果如图6所示。

图6 培养时间对酵母活菌数的影响Fig.6 The influence of time to viable count of yeast w2
由图6可知,当酵母麸曲培养12 h时,酵母的生长很慢,随着培养时间的增加,当达到24 h时,此时酵母活菌数显著增加;培养时间继续增加,麸曲中酵母数量下降并能维持在一定数量值上,此时酵母生长稳定。培养时间为24 h左右,酵母w2生长良好。
2.3.3 不同培养温度对酵母生长量的影响
微生物培养最讲究控温工艺,温度为曲药培菌的一大重要指标[16]。曲中各类微生物生长繁殖发酵代谢中温度的变化,使得在制作过程中可大致知道此曲的发酵程度甚至认为控制发酵而提高其质量。而酵母麸曲作为纯种曲,其温度的控制上较为容易。其培养温度对酵母生长量的影响结果如图7所示。
酵母w2生长所需温度一般在16℃~36℃之间,故主要在低温培菌期存活繁殖。如图7所示,随着温度上升,麸曲中酵母的活菌数逐渐上升,当温度达到28℃时,其活菌数最多可达到1.69×108CFU/g;随着温度的继续上升,酵母菌数量显著下降。培养温度为28℃左右,酵母w2生长良好。
2.3.4 酵母麸曲培养条件正交优化
对单因素培养条件试验结果的基础上,进行四因素三水平L9(34)正交优化,以酵母麸曲中酵母w2活菌数为指标,进行正交数据分析,确定酵母麸曲的最佳培养条件,其分析结果如表1所示。

图7 不同培养温度对酵母活菌数的影响Fig.7 The influence of temperature to viable count of yeast w2

表1 酵母麸曲培养条件正交优化Table 1 The orthogonal optimization of yeast bran koji culture conditions
由表1可知,水分含量、时间、温度对酵母麸曲均有不同程度的影响。R值越大,代表了该因素的水平变化对酵母活菌数的影响较大,由极差分析得RA>RC>RB,其中水分和温度2种因素水平变化引起的极差(11.300和4.667)大于空白列的误差,说明对酵母麸曲中活菌数变化影响因数的主次顺序是:水分>温度>时间。对于 A 因素(水分):K3>K2>K1,所以选 K3为 A 因素的优水平;同理对于 B 因素(时间):K1>K3>K2,所以选K1为 B 因素的优水平;对于 C 因素(温度):K3>K1>K2,所以选K3为C因素的优水平。故,理论上最佳培养方案为A3B1C3,即水分含量40%,培养温度30℃,培养时间18 h。
2.4 酵母麸曲验证试验
对正交试验结果进行验证试验,试验结果如表2。

表2 酵母麸曲验证试验结果Table 2 The verification experiment result of yeast bran koji
由表2可知,在最佳理论培养条件下进行验证试验,得到理论最佳培养条件下酵母活菌数为(473±5.3)×106CFU/g,优于此前的试验结果,确定最佳培养方案为A3B1C3。在同培养条件下,比较试验1、2号,酵母w2应用于优化麸曲配方(相比原配方),其酵母活菌数可达到(312±4.8×106)CFU/g,增长了 57.58%;在同麸曲配方下,比较试验2、3号,优化条件相比原条件,酵母活菌数增长了51.60%。综上所述,酵母w2应用于麸曲中,其最佳原料配比和最佳培养条件均可行。
2.5 应用于清香型小曲酒酿酒试验
将工艺优化后的酵母麸曲,比较糖化24 h前、后的加入酵母麸曲进行发酵的小曲清香酒,将蒸馏后的酒液进行检测,结果如图8。
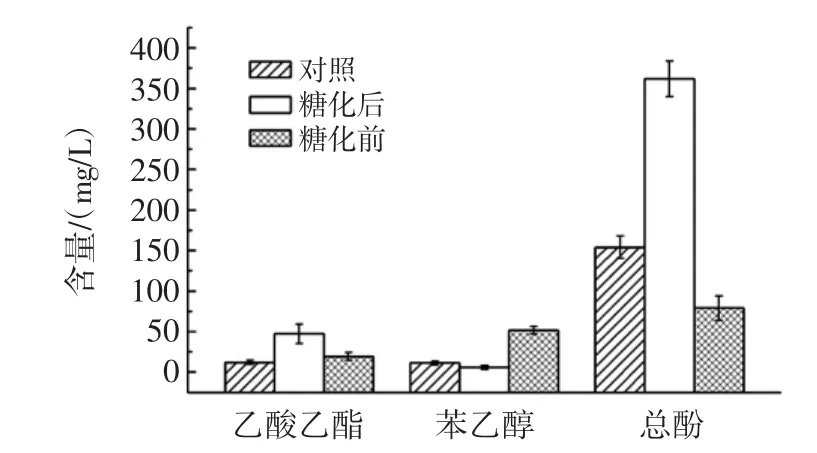
图8 酵母w2的酿酒发酵试验结果Fig.8 The results of fermentation test with the yeast w2
糖化前添加酵母麸曲使苯乙醇的量增加2倍,但总酯含量有所下降;糖化后添加酵母麸曲可使酒中的乙酸乙酯的含量提高3倍左右,总酯的含量提高2倍左右,苯乙醇含量无显著变化。酵母麸曲在清香型小曲白酒发酵中的产香促进作用,特别在糖化后加入,效果更佳。
3 结论
将产乙酸乙酯的酵母w2应用到清香型小曲白酒中,使原酒中乙酸乙酯和总酯含量得到明显提高,清香风格更加突出。通过单因素试验分析了不同原料和培养条件对酵母麸曲中活菌数的影响,并结合正交试验设计优化了培养条件,通过验证试验说明了优化后原料配比和培养条件的可靠性,确定酵母麸曲的原料配比为:麸皮10 g、鲜酒糟5.6 g、玉米粉4.2 g;酵母麸曲的培养条件为:水分40%,培养时间18 h,培养温度30℃。本试验是建立在小试的基础上初步探究酵母w2的麸曲制作工艺,但应用效果明显,为进一步探究提供了试验数据基础。

