一种低水分固态发酵玉米粉工艺研究
卢富山,尹清强,赵卫卫, 王 潇
(1.河南普爱饲料股份有限公司,河南周口466100;2.河南农业大学牧医工程学院,河南郑州450002)
玉米在我国畜禽养殖中被广泛使用,是断奶仔猪日粮中的重要能量原料,占日粮总质量的60%以上。但由于仔猪消化系统发育尚未完善,消化酶尤其是淀粉酶分泌不足,使得仔猪肠道对淀粉利用率很低(王富盛等,2012;王艳玲等,2005),目前饲料企业多使用膨化处理和细粉碎来提高玉米淀粉消化率,但是膨化处理会使玉米中的必需氨基酸含量减少(Amornthewaphat等,2005),细粉碎会加重猪胃肠角质化和损害的程度(Wondra,1995)。发酵是加工谷物类食品的传统方法,经微生物发酵作用可改变产品的组成结构、改善产品的风味和口感、提高产品的安全性和营养价值(刘庆艾等,2015;Dirar等,2010)
研究表明,淀粉经微生物发酵和酶解,产物糊精能被仔猪有效利用 (刘晓峰等,2011)。Lee等(2000)在比较糊精、玉米淀粉、葡萄糖等对21日龄断奶仔猪生产性能的影响时,发现玉米淀粉对仔猪的平均日增重、平均日采食量的影响显著低于其他各组。闫雅婷等(2011)利用发酵法对玉米粉营养结构进行改性,可溶性糖含量提高171.9%,改善了玉米的饲用品质。另外,加入乳酸菌和酵母菌的混合发酵玉米可以产生有机酸和抗菌物质,口感更加香甜。
本试验旨在利用复合微生物配合酶解工艺,摸索出微生物发酵最优条件以及发酵后可溶性糖的变化,为发酵谷物饲料提供应用依据,从而提高玉米在幼龄动物饲养中的应用价值。
1 材料与方法
1.1 试验材料
1.1.1 菌株 枯草芽孢杆菌、酿酒酵母及屎肠球菌购自中国工业微生物菌种保藏管理中心,编号分别为 CICC20819、CICC1355、CICC6078。
1.1.2 培养基 LB培养基:胰蛋白胨1 g,酵母粉0.5 g,氯化钠 0.5 g,水 100 mL,pH 7.0。
YPD培养基:葡萄糖 2 g,酵母粉1 g,胰蛋白胨 2 g,水 100 mL。
MRS培养基:葡萄糖 2 g,胰蛋白胨1 g,牛肉蛋白胨1 g,酵母粉0.5 g,结晶乙酸钠0.5 g,磷酸氢二钾0.2 g,柠檬酸三铵0.2 g,结晶硫酸镁0.05 g,硫酸锰0.02 g,吐温80 0.1 mL,水 100 mL。
1.1.3 试剂与设备 试剂包括蒽酮、乙酸乙酯、浓硫酸、氢氧化钠、福林、DNS、碘液等。设备包括灭菌锅、离心机、分光光度计、摇床、超净台、三角瓶等。
1.1.4 材料 玉米粉,过60目筛备用。高温淀粉酶(SUKAMy-Hi PW4)购于苏柯汉生物技术有限公司。
1.2 试验方法
1.2.1 检测指标及方法 可溶性糖的测定:蒽酮法;粗蛋白质的测定:凯式定氮法;总酸测定方法:氢氧化钠滴定法;活菌数的测定:平板涂布法。
1.2.2 最佳接种量的优化 设定对枯草芽孢杆菌、酵母菌、屎肠球菌3个条件进行优化,每个条件设计3个水平采用正交试验,按L9(33)设计复合菌发酵接种量正交试验(见表1)。以玉米粉为发酵基质,料水比 1∶0.45,100 ℃灭菌 20 min,发酵48 h,以发酵后可溶性糖的含量、总酸为检测指标,综合确定混菌发酵各菌的最佳接种比例。
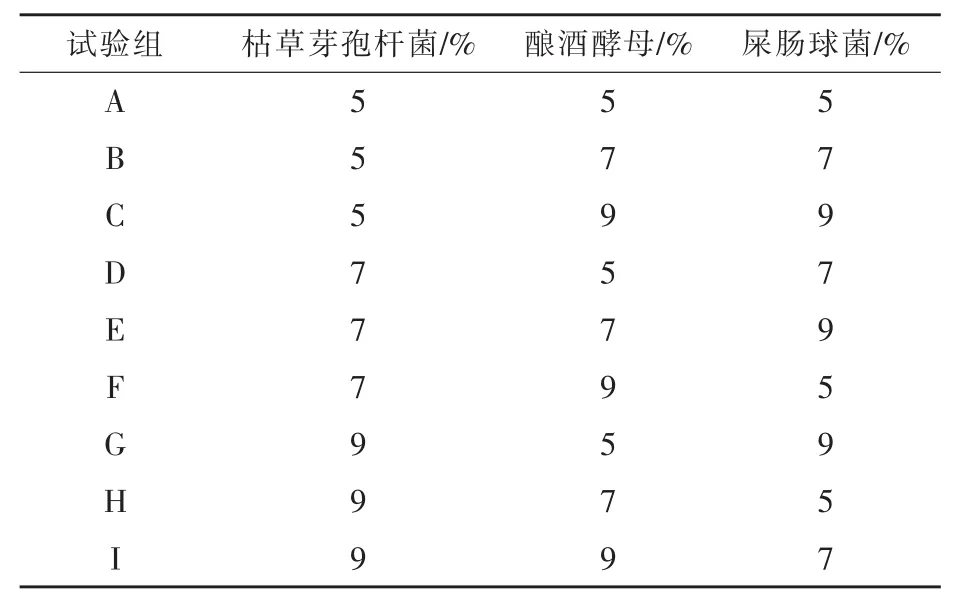
表1 复合菌发酵最佳接种量的优化正交试验因素水平表
1.2.3 发酵条件的优化 在复合菌发酵接种比例优化结果的基础上,采用正交试验按L9(33)设计对混菌发酵条件进行优化(见表2)。
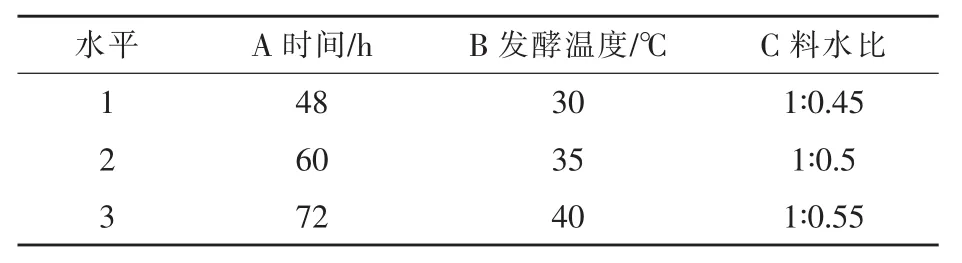
表2 复合菌发酵条件的优化正交试验因素水平表
1.2.4 外源淀粉酶对发酵效果的影响 以玉米粉为培养基质,100℃高温灭菌20 min,自然pH,料水比 1∶0.45,高温 α-淀粉酶添加量为 10、20、30 U/g玉米粉。每组3个重复,35℃培养48 h,样品在65℃烘箱中烘干,粉碎过60目筛,检测可溶性糖的含量。
1.2.5 微生物发酵与酶解结合对可溶性糖的影响首先对玉米粉采用100℃灭菌 20 min,在上述最佳发酵条件(72 h、35 ℃、料水比为 1∶0.55)及酶解(10 U/g玉米粉)的基础上,设计3个试验组。
试验组1:枯草芽孢杆菌、酿酒酵母及屎肠球菌的接种量分别为5%、7%和9%;试验组2:添加高温α-淀粉酶10 U/g玉米粉;试验组3:灭菌前添加高温α-淀粉酶10 U/g玉米粉,混合灭菌后再接种微生物发酵。
2 结果
2.1 发酵玉米粉的最佳益生菌配比 由表3的极差分析得知,屎肠球菌对发酵后总酸的影响最大,以总酸为检测指标,正交表中给出的最优效果为A1B2C3,即:枯草芽孢杆菌接种量5%、酿酒酵母接种量7%、屎肠球菌接种量为9%。表4的极差分析结果表明,对可溶性糖含量影响最大的是酿酒酵母,正交表给出的最优组合为A1B2C1,即:枯草芽孢杆菌接种量5%、酿酒酵母接种量7%、屎肠球菌接种量为5%。根据正交试验结果,得出几组 较 好 组 合 , 分 别 为 A3B1C3、A1B2C3、A1B2C2、A1B2C1,并进行重复试验验证。发现A1B2C3组产糖量最高,即枯草芽孢杆菌接种量5%、酿酒酵母接种量7%、屎肠球菌接种量为9%为最佳试验方案(见表 5)。
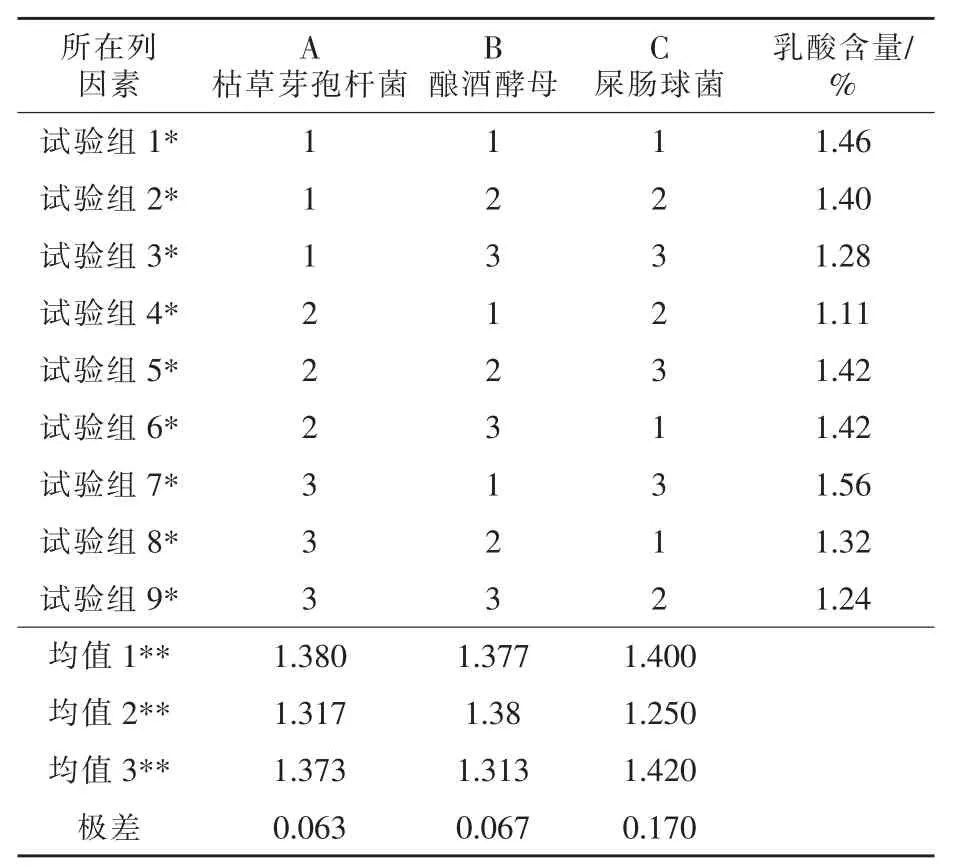
表3 复合菌发酵玉米粉产酸的最佳接种量
2.2 复合发酵条件优化试验结果 从表6的极差可以看出,产生可溶性糖的最优组合发酵条件为:72 h、35 ℃、料水比为 1∶0.55。对可溶性糖含量的影响因素主要是发酵时间,其次为水分,而温度影响最小。表7的结果分析表明,对总酸的影响因素依次为:温度>时间>水分,最佳发酵条件为60 h、35 ℃、料水比为 1∶0.55。但在此条件下,可溶性糖含量却只有39.7%。

表4 复合菌发酵玉米粉产可溶性糖的最佳接种量

表5 正交试验结果的验证
根据正交试验结果,得出最佳发酵条件为发酵 72 h、发酵温度 35℃、料水比为 1∶0.55,经验证在该条件下发酵产物可溶性糖含量达到48.6%,总酸含量能达到1.52%。整个发酵过程分为好氧和厌氧2步,发酵初期枯草芽孢杆菌大量繁殖分泌大量的酶和消耗大量氧气为乳酸菌和酵母菌提供了繁殖基础。发酵中后期对糖含量及酸度影响较大的屎肠球菌在厌氧条件下又进行了大量的增殖,起始温度缩短了菌种生长的静止期,能迅速地适应环境并进行增殖代谢,同时随着环境中温度的升高导致酿酒酵母部分死亡裂解,使细胞中的糖类释放到周围环境中。
2.3 淀粉酶与微生物复合对发酵结果的影响
2.3.1 不同淀粉酶剂量对可溶性糖含量的影响从表8可以看出,添加量在10~20 U/g玉米粉时,可溶性糖含量随着高温α-淀粉酶的添加量增加而降低,在20~30 U/g玉米粉时,可溶性糖含量随着α-淀粉酶的添加量增加而升高。从经济效益角度分析,α-淀粉酶添加量选为10 U/g玉米粉。
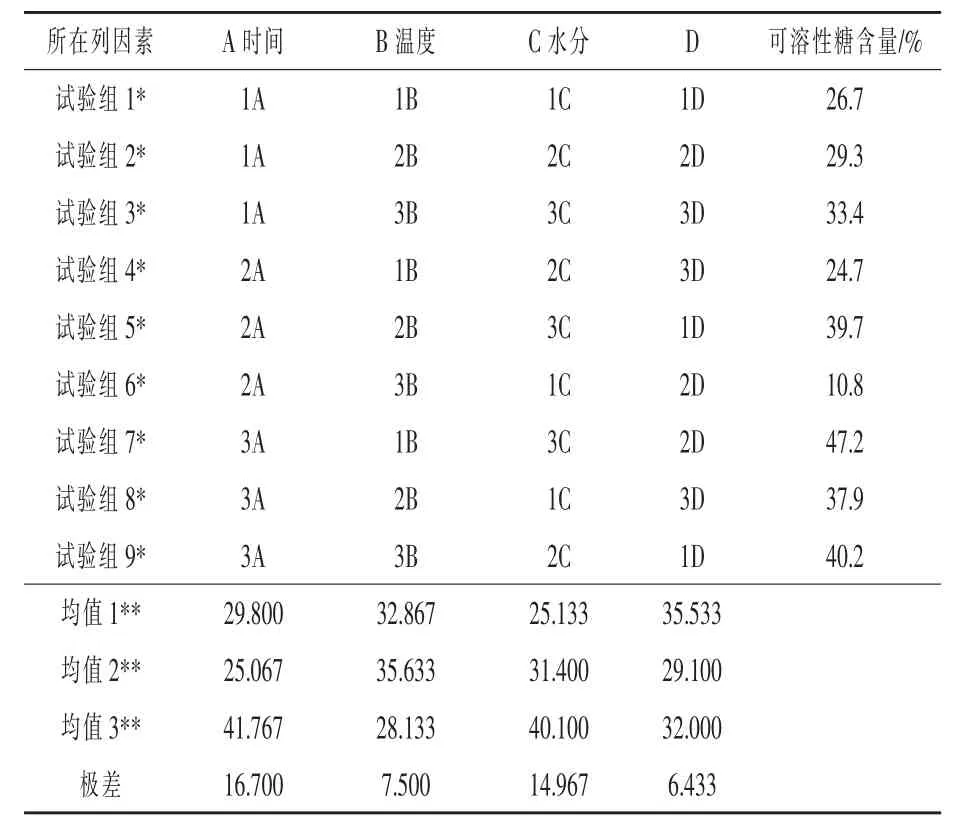
表6 复合发酵条件对可溶性糖产量的影响
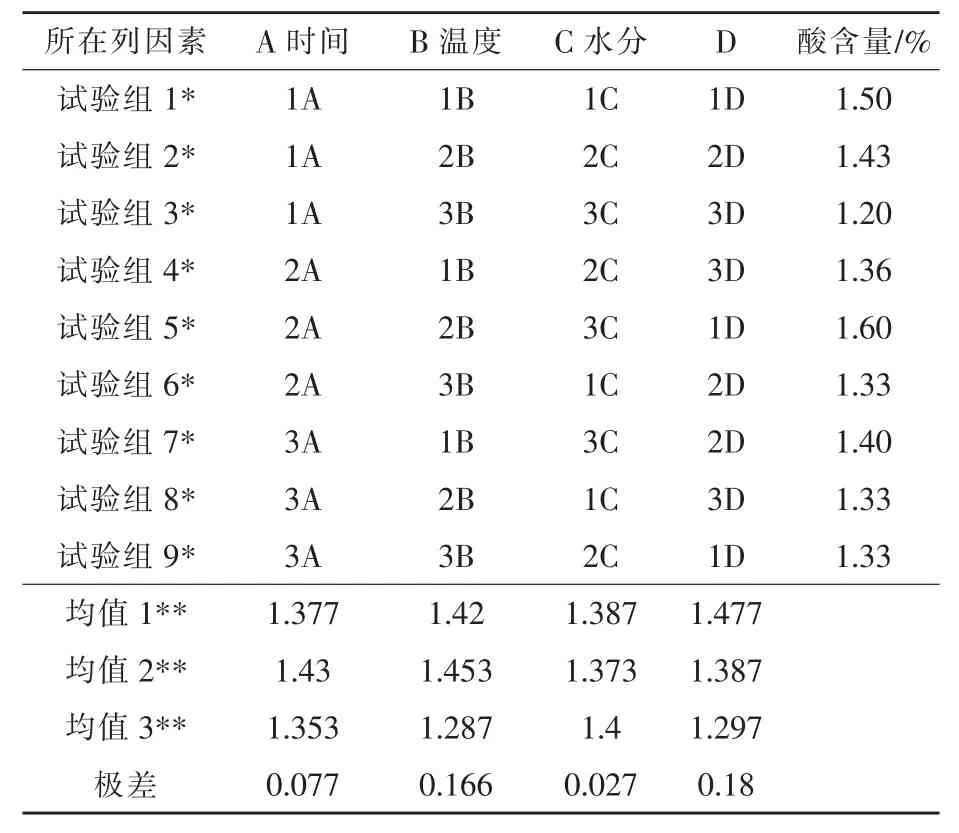
表7 复合发酵条件对酸产量的影响

表8 高温α-淀粉酶添加量对可溶性糖含量的影响
2.3.2 微生物发酵与酶解结合对可溶性糖产量的影响 由表9可以看出,单独的纯微生物发酵和纯酶解,分别使可溶性糖含量分别由对照组的11.5%提高到32.3%和37.8%;而当微生物发酵和酶解相结合时,可使可溶性糖含量提高到61.2%。

表9 外源淀粉酶结合微生物发酵的效果
3 讨论
微生物发酵与生物酶解相结合,弥补了微生物发酵产酶量低,生物酶解酶系单一的缺点,使得发酵更加彻底,极大提高了玉米的消化率,同时保证了产品的稳定性。同时酵母和乳酸菌的发酵可产生乙醇、乙酸、乳酸等风味物质以及未知生长因子,对动物有一定的诱食性和促生长作用。
根据正交试验结果,分别对试验得出的4种组合方案进行正交试验,发现与A1B2C3组相比,A3B1C3组由于影响糖含量因素最大的酵母接种量较少,而且枯草芽孢杆菌接种量过大与酵母形成一定的竞争关系,导致酵母不能更好地生长,使可溶性糖含量降低;A1B2C2组与A1B2C1组,由于屎肠球菌接种量较少,在发酵中后期增殖较慢,未能迅速改变环境的pH,抑制枯草芽孢杆菌的生长,从而促进酿酒酵母的生长导致糖含量降低。所以确定最优组为A1B2C3,即枯草芽孢杆菌接种量5%、酿酒酵母接种量7%、屎肠球菌接种量为9%为最佳试验方案。
根据高温淀粉酶最适温度为90℃左右,且耐受100℃高温,结合灭菌和冷却过程,在一定程度上能发挥高温淀粉酶的活性,故在灭菌前添加10 U/g玉米粉的高温α-淀粉酶。微生物发酵结合酶解工艺,不仅将玉米淀粉绝大部分分解,为微生物生长提供必要的碳源,也利用了单纯灭菌在升温与降温过程中产生的能量。
4 结论
本研究确定了固态发酵玉米粉的最佳培养条件与发酵工艺条件,使玉米粉中的可溶性糖含量由原来的11.5%提高到32.3%,涨幅达到了181%,进一步与生物酶解工艺相结合,使可溶性糖含量又提高了89%以上,总酸含量达到了1.5%。

