酶刺激响应纳米载体的制备与负载姜黄素体外释放研究
李辉盛,苏子桓,王冠海
( 广东医科大学药学院,广东 东莞 523808)
近年来,利用纳米传输载体传递药物,能够有效提高药物的渗透性、保留时间、生物利用度,有效降低副作用,以及在特定的部位释放药物[1-2]。介孔硅纳米粒子(MSNs)是一种有序介孔纳米材料,具有纳米孔道结构规则、孔径可调、表面基团易于修饰、生物相容性良好等优点,目前作为药物载体得到广泛的关注[3-4]。口服给药系统能根据人体内不同的环境,如酶、pH值等实现靶向给药。目前,通过口服对肠部位的靶向给药仍然存在缺陷,如肠炎、肠蠕虫、等疾病[5]。
葡聚糖是一种天然、安全无毒、生物相容性好的多糖,且免疫原性低、生物黏附性好,并且能够被细菌分泌酶所降解,如在人体结肠中典型的β -葡聚糖酶[7]。本研究通过共价键,在介孔硅纳米粒子表面引入葡聚糖分子,作为介孔硅纳米粒子的“gatekeeper”[8],以疏水性药物姜黄素为模型药物,通过酶响应控制负载姜黄素的释放。该体系在特定的治疗中,利用肠部位的酶刺激控制的释放,可能具有潜在的应用价值。
1 实验部分
1.1 原料与试剂
可溶性葡聚糖(Amylopectin)、丙烯酰氯、3-巯基丙基三乙氧基硅烷(SPTES)、正硅酸乙酯(TEOS)、十六烷基三甲基溴化铵(CTAB),国药集团化学试剂有限公司;姜黄素,纯度>99.0%,Fluka。
1.2 合成葡聚糖修饰MSNs(Dextran/MSNs)
丙烯酰化葡聚糖和含巯基的MSNs(MSN-SH)的制备参考前期工作[10]。
30 mg MSN-SH分散到10 mL姜黄素(2mg/mL)的乙醇-水溶液中,搅拌24h搅拌条件下,滴加5 mL含30 mg丙烯酰化葡聚糖的水溶液,室温下搅拌反应24 h。离心分离,沉淀用去离子水洗涤,反复操作3次,除去未接枝的葡聚糖和表面吸附的姜黄素,真空冷冻干燥,得到Dextran/MSNs/Cur纳米载体。
1.3 姜黄素体外释放
称取已干燥的Dextran/MSNs/Cur纳米载体于透析袋中,放入10mL 、37℃的PBS(pH值=7.4)缓冲溶液中,在设定的时间换取同温同体积的溶液,取出的溶液用荧光分光光度计在波长530nm测定吸收光密度,并根据标准曲线计算其累积释放量。
2 结果与讨论
2.1 葡聚糖的修饰纳米粒子的表征
图1是可溶性葡聚糖和丙烯酰化葡聚糖的红外图谱。从图中可以看到丙烯酰化葡聚糖在1724cm-1出现明显的C=O伸缩振动峰,而在1639cm-1有C=C双键的伸缩振动峰,证明了可溶性葡聚糖被丙烯酰化成功。通过介孔硅纳米粒子表面的巯基与改性葡聚糖中的双键之间的"点击化学"反应,葡聚糖可以通过共价键偶联到介孔硅纳米粒子表面,图1显示,在Dextran/MSNs红外图谱中,保留了改性葡聚糖中的羰基振动吸收峰,而双键的振动吸收峰却消失,这说明葡聚糖通过共价键成功的偶联到纳米粒子表面。

图1 葡聚糖、丙烯酰化葡聚糖和Dextran/MSNs的红外图谱
图2为Dextran/MSNs的TEM照片,从图2可以看出,通过溶胶-凝胶法得到的介孔硅粒径分散均匀,约100 nm左右。介孔硅表面接枝葡聚糖后,表面形成明显的聚合物壳层,在纳米粒子表面的介孔结构已经模糊不清。纳米载体的壳,犹如一个"门控系统",在没有达到病灶部位前,使药物能够稳定的包覆在载体中;当进入到病灶部位后,在葡聚糖酶的作用下,分解掉载体表面的葡聚糖,释放出负载的药物,因此这种核-壳结构的传输载体有利于构建靶向药物递送系统。

图2 Dextran/MSNs透射电镜照片
2.2 纳米载体对姜黄素的负载和释放
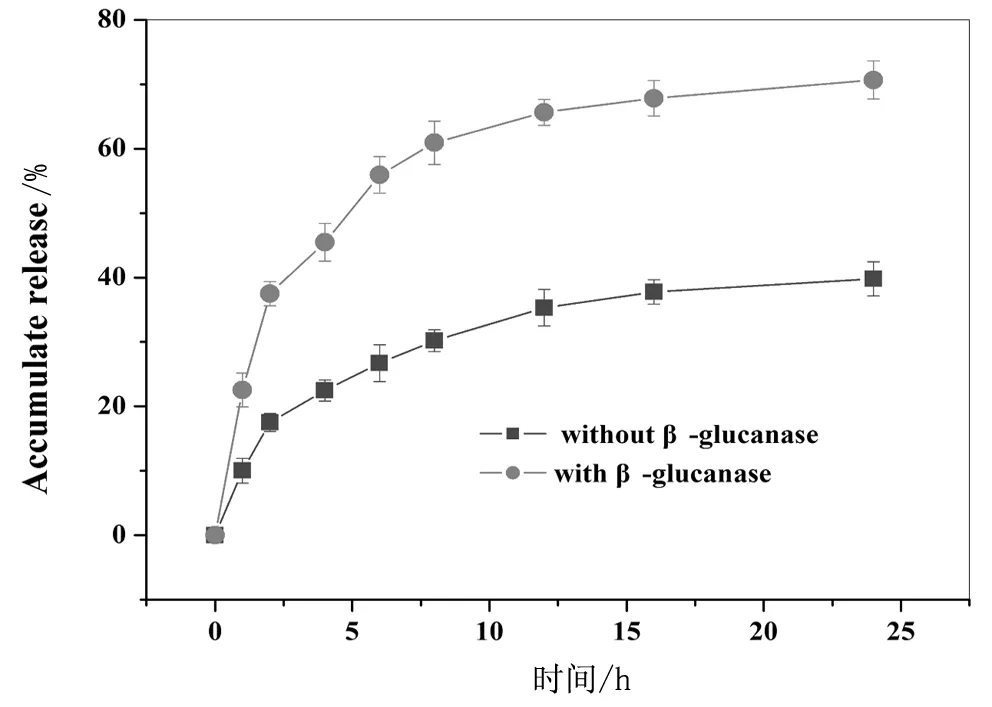
图3 β-葡聚糖酶对姜黄素在纳米载体中
姜黄素为疏水性药物,通过与介孔硅的纳米孔道作用,可以吸附到孔道中,通过紫外检测,负载量可以到到26 mg/g,具有相对较高的负载量。图3是载药纳米粒子在37℃的PBS缓冲溶液中姜黄素累积释放曲线。从图中可以明显看到,在没有β-葡聚糖酶时,姜黄素的释放速度很慢,在累积释放时间达到25h时,总释放量才达到37%左右;而加入β-葡聚糖酶后(0.30 U/mL),姜黄素的释放速度明显加快,在前5h,释放量已经达到50%,而在累积释放时间达到25h时,总释放量才达到70%左右,这说明介孔硅表面修饰的葡聚糖分子,在β-葡聚糖酶的作用下,快速分解,从纳米粒子表面解离,使药物分子从从孔道中释放快速出来。
3 结论
在本工作中,通过丙烯酰化的葡聚糖修饰介孔硅纳米粒子表面,得到了水分散性良好、粒径均一的纳米载体,通过对疏水性药物姜黄素的负载和体外释放发现,在β-葡聚糖酶的作用下,纳米载体对负载的药物具有良好的控释能力。

