Wnt7a抑制胃癌细胞的增殖、侵袭和迁移
王淑坤,丁康,孙丹,卢强,刘美逸,张妍,苗玉娟,周风华*
(潍坊医学院1病理学教研室,2生物科学与技术学院,潍坊 261053)
胃癌是第四大常见癌症,居癌症致死的第二位[1],与西方国家相比,亚洲的胃癌患病率和死亡率更高[2],全球43%的胃癌患者在中国。目前,尽管胃癌的手术和化学治疗取得一些进展,晚期患者及转移患者仍然是导致胃癌预后差的主要原因[3],因此探索胃癌的发生及转移机制将有助于开发胃癌早期标记物,并为胃癌的治疗提供可靠的靶点。
Wnt7a是一种分泌型糖蛋白,通过控制细胞增殖和分化在多种肿瘤发生发展中起重要作用,且在不同肿瘤中可能发挥不同作用[4]。Wnt7a在胃癌中的作用目前尚没有明确报道。本研究通过观察胃癌组织中Wnt7a的表达变化及分布情况,分析Wnt7a的表达变化与胃癌患者临床病理参数及预后的关系,在胃癌细胞系SGC7901中过表达Wnt7a,同时检测过表达Wnt7a后7901细胞的增殖、迁移、侵袭和凋亡状态,探讨Wnt7a在胃癌发生发展中的作用。
材料与方法
1 临床材料
收集潍坊医学院附属医院病理科2010年1月至2012年12月胃癌手术切除标本80例,以癌旁正常组织30例(距离肿瘤边缘>3cm)作为对照。新鲜标本用于qRT-PCR及Western blot等分子生物学检测,石蜡切片用于免疫组织化学染色。患者术前均未接受化疗及放疗。
2 主要试剂
SP免疫组织化学试剂盒(SP-9000,北京中杉金桥生物技术有限公司),小鼠单克隆抗体Wnt7a(Santa Cruz, sc-365459),小鼠单克隆抗体GAPDH抗 体(Proteintech Group,60004-I-Ig)。TRIzol试剂 (Life Technologies),反转录试剂盒(广州锐博生物),实时荧光定量PCR相关试剂(Takara,Dalian),细胞培养用的高糖DMEM(Hyclone),胎牛血清(Gibco),无血清DMEM(Gibco),pRFP-Wnt7a过表达质粒(上海吉凯),Lipofectamine 3000 (Thermo Fisher Scientific),MTS试剂(Promega,0000153699),EdU试剂盒(广州锐博生物),流式细胞仪试剂盒(BD Pharmingen,8155987),Transwell小室(Corning Incorporated,33117045)
3 细胞株、细胞培养及转染
人胃癌细胞SGC7901购买自ATCC细胞库,培养基为含10%胎牛血清 (Fetal bovine serum,FBS,Hyclone)的高糖DMEM (Dulbecco’s Modified Eagle’s medium, DMEM, Hyclone)。细胞置于37℃、含5%CO2的细胞培养箱中培养。按照Lipofectamine 3000试剂盒说明将处于对数生长期的细胞进行质粒转染。实验组转染pRFP-Wnt7a过表达质粒,对照组转染空载质粒,分别于转染后24h、48 h、72h提取RNA及蛋白通过qRT-PCR及Western-blot检测转染效果,并进行细胞活性、增殖状态、凋亡状态、细胞迁移及侵袭实验。
4 免疫组织化学
胃癌石蜡包埋组织,制备成石蜡切片,依次进行二甲苯脱蜡,梯度酒精水化,H2O2封闭内源性过氧化物酶,微波抗原修复,滴加Wnt7a一抗(1∶100),4℃过夜;滴加二抗工作液,37℃孵育45min;滴加三抗工作液(增强酶标山羊抗小鼠/兔IgG聚合物),37℃孵育40min;DAB显色剂显色,以出现棕黄色颗粒为阳性表达,以PBS代替一抗为阴性对照。显微镜下观察组织着色的面积和强度。免疫组织化学判读标准参考刘焕彩等[5]。
5 qRT-PCR
Trizol法提取组织和细胞总RNA并反转录合成cDNA。Wnt7a的检测,以β-actin作为内参照。在PCR仪(Bio-Rad CFX96TMReal-Time Systerm)中进行反转录,程序为37℃ 15 min, 98℃ 5 min。PCR扩增体系包括:SYBR Premix (SYBR® Premix Ex Taq ™ II kit,Takara, 大 连)10μl,Wnt7a上下游引物分别为 0.6μl/0.5ul,cDNA 1μl,去离子水 7.8μl/8μl。Wnt7a 上 游 引 物:5’-GGCCTGGACGAGTGTCAGTT-3’,Wnt7a 下游引物:5’-GCAATGATGGCGTAGGTGAA-3’; β-actin 上 游 引 物:5’-CATCCTCACCCTGAAGTACCC-3’,β-actin 下游引物:5’-AGCCCTGGATAGCAACGTACATG-3’。在实时荧光定量PCR仪中按以下程序进行扩增: 95℃1min, 40个PCR循环(95℃ 15s,60℃ 1min),扩增反应结束后,95℃ 5s,65℃ 5s,95℃ 5s,并从65℃缓慢加热到95℃建立熔解曲线。荧光定量PCR实验数据由Bio-Rad CFX96TMReal-Time System PCR仪自带软件完成,通过比较阈值分析Wnt7a的相对表达量,复孔取均值CT,计算△CT=CT(目的基因Wnt7a)-CT(内参基因β-actin),根据2△△CT计算相对表达量。
6 Western blot
提取组织和细胞总蛋白,酶标仪测定蛋白浓度,蛋白终浓度调整为3μg/μl,98℃水浴10min将蛋白变性。聚丙烯酰胺凝胶电泳分离不同分子量的蛋白,将蛋白转至PVDF膜,PVDF 膜在5%的脱脂奶粉中封闭30min 后,孵育Wnt7a抗体(浓度为1∶1000),GAPDH(浓度为1∶1000)作为内对照,4℃过夜。辣根过氧化物酶标记的抗兔的二抗中孵育,ECL发光剂进行发光。使用 Quantity One软件测定条带光密度值进行定量分析,计算Wnt7a/GAPDH光密度比值来测定Wnt7a蛋白的相对表达量。
7 细胞增殖实验
MTS实验:将SGC7901细胞以5000个细胞/孔接种在96孔板,实验组转染pRFP-Wnt7a过表达质粒(Wnt7a组),对照组(Control组)转染空载质粒,于转染24h、48h、72h,按照MTS试剂盒说明书进行,MTS试剂孵育40min,各随机选取10对孔,酶标仪( Thermo Multiskan FC型酶标仪 357-906076)检测各孔的细胞吸光度(490nm)。
EDU实验:SGC7901细胞以20000个细胞/每孔接种在96孔板,实验组转染pRFP-Wnt7a过表达质粒,对照组转染空载质粒,于转染48h后,按EDU试剂盒说明书进行,EDU孵育2h,Hoechst33342复染细胞核,荧光显微镜拍照。实验组和对照组各随机选取5个高倍视野,以EDU阳性细胞与Hoechst 33342阳性细胞比值计算细胞增值率。
8 细胞凋亡实验
将SGC7901细胞接种在96孔板,实验组转染pRFP-Wnt7a过表达质粒,对照组转染空载质粒,于转染48 hour后,按试剂盒说明书进行流式细胞仪凋亡检测。用预冷的PBS洗涤细胞两次,离心收集后用 1×Binding Buffer将细胞重悬为( 1~5)×106个/ml,设置不加任何染色液的空白细胞组,加入10μl FITC染色液的单染细胞组,加入10μl PI染色液的单染细胞组,各加入5μl FITC和PI染色液的实验组(Wnt7a组),各加入5μl FITC和PI染色液的对照组。最后每组各加入400μl的1×Binding Buffer吹打混匀,经滤网过滤后上机进行流式细胞仪(BD Bioscences E97400021)检测。
9 Transwell实验
迁移实验:将转染pRFP-Wnt7a过表达质粒和空载质粒24h后的7901细胞进行消化处理,计数后将细胞用无血清培养基重悬。按照1.2x105细胞/孔的数量加入到Transwell小室的上室,下室中加入600μl 10% FBS 的DMEM 培养基,培养箱中培养48h后取出,经4%多聚甲醛固定后用棉签轻柔擦去上室内侧细胞,0.1%结晶紫染色后以PBS洗去染色液,用棉签将上室内侧水吸干,显微镜下观察并计数穿过小室滤膜的细胞数量。
侵袭实验:预先在小室内侧滤膜铺上基质胶置于细胞培养箱内2~4h,其余操作同迁移实验。实验组和对照组各随机选取5个高倍视野,计数穿膜细胞数量。
10 统计学分析
本研究使用Prism 5.01 软件 (GraphPad Software,San Diego, CA, USA) 进行统计学分析。所有计量资料均以均数±标准()表示。两组间的计量资料采用t检验进行分析比较。Wnt7a表达与临床病理参数之间的关系进行χ2检验,生存曲线用Kaplan-Meier法绘制,Log-rank检验比较生存曲线,以P<0.05表示差异具有统计学意义。
结 果
1 胃癌组织中Wnt7a表达下调
qRT-PCR及Western blot结果显示,与正常胃粘膜相比,Wnt7a mRNA及蛋白水平在胃癌组织明显降低(图1A、B);免疫组化学结果显示,Wnt7a的阳性表达主要定位于细胞质,呈棕黄色颗粒状,胃癌组织Wnt7a阳性表达率为33%,癌旁正常组织的阳性表达率为76%(图1C)。
2 Wnt7a在胃癌组织中的表达与临床病理参数及预后的关系
为了分析Wnt7a表达与胃癌临床病理参数之间的关系,我们以80例胃癌患者Wnt7a中位表达值为依据分为两组,大于中位值者作为高表达组,小于中位值者作为低表达组,临床病理分析结果显示,与Wnt7a高表达组患者相比,Wnt7a低表达组患者胃癌的肿瘤体积相对较大,TNM分期较高,淋巴结转移率较高;Wnt7a的表达与胃癌患者的性别、年龄、分化程度无关(表1);Kaplan–Meier生存分析结果显示,高表达Wnt7a组患者的总体生存率明显高于低表达组(图 2)。
3 过表达Wnt7a抑制SGC7901细胞的增殖
EDU染色和MTS实验表明,转染pRFP-Wnt7aup的SGC7901细胞(过表达Wnt7a)与转染空载质粒的SGC7901细胞相比,生长速度明显减慢,增殖能力下降(图3A、B)。PI-Annexin V法流式细胞术分析显示,过表达Wnt7a对SGC7901细胞的凋亡无明显影响(图 3C)。
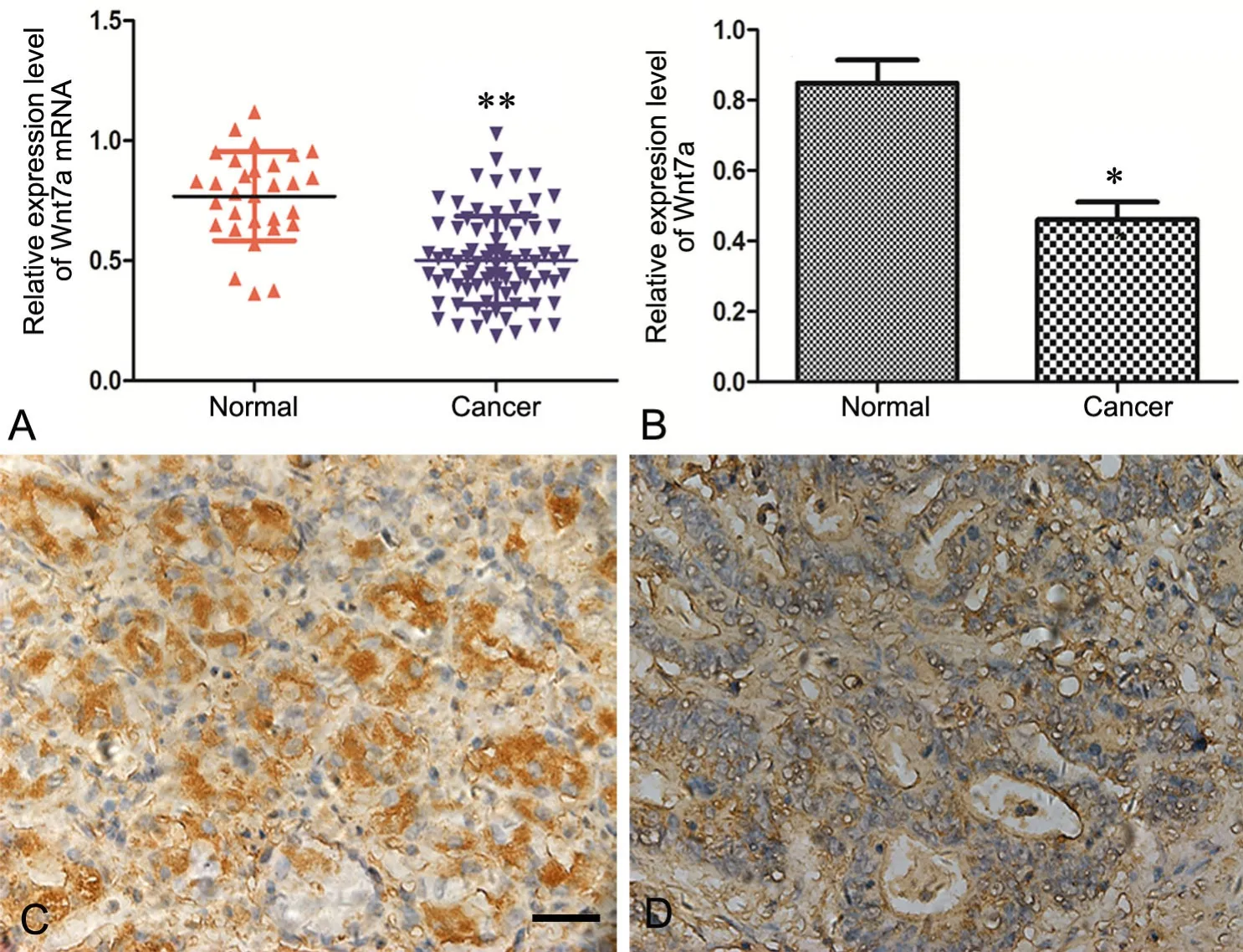
图1 胃癌组织中Wnt7a mRNA及蛋白表达检测。A,qRT-PCR检测胃癌组织Wnt7a mRNA水平的统计学分析;B,Western blot检测胃癌组织Wnt7a蛋白水平的统计学分析;C,胃癌组织中Wnt7a定位与表达的免疫组织化学检测;D正常为组织中Wnt7a免疫组织化学定位与表达;与正常组织比较:*0.01<P<0.05;**P<0.01;比例尺,50μmFig. 1 Detection of expression of Wnt7a and its mRNA in the gastric cancer tissues. A, statistical analysis of Wnt7a mRNA level detected by qRT-PCR;B, statistical analysis of Wnt7a level detected by Western blot; C, immunohistochemical detection for localization and expression of Wnt7a in the gastric cancer tissues; D, immunohistochemical detection for localization and expression of Wnt7a in the normal gastric tissues; compared with the normal gastric tissue∶ *0.01 < P < 0.05; **P<0.01; scale bar, 50μm
4 过表达Wnt7a显著抑制7901细胞的迁移和侵袭能力
Transwell迁移实验结果显示,pRFP-Wnt7a质粒转染的SGC7901细胞穿过滤膜的数量较对照组明显减少,细胞迁移能力下降;侵袭实验表明,过表达Wnt7a的SGC7901细胞的穿膜数量较对照组明显减少,细胞浸润能力下降(图 4)。
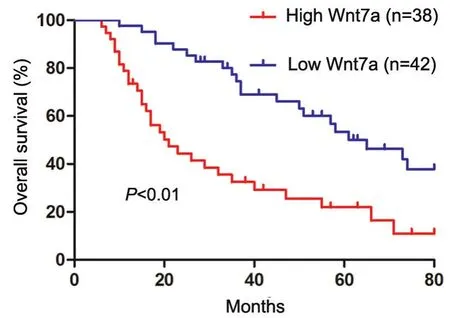
图2 Wnt7a表达水平与胃癌患者预后关系的生存分析Fig. 2 Survival analysis of relationship between Wnt7a expression level and prognosis of gastric cancer patients
讨 论
胃癌是全球最具侵袭性和致命性的肿瘤之一,尽管多种治疗方法可用于治疗胃癌,但进行手术切除的晚期胃癌患者仍然会发生局部或远处转移并最终死亡[6]。化疗耐药和有限的治疗选择是胃癌转移患者死亡的主要原因,而复杂的癌症转移级联的发生机制仍未完全阐明[7]。探索胃癌发生发展的机制,寻找有效的治疗靶点,对于胃癌的早期诊断、治疗和预后具有重要意义。
Wnt信号通路对多种正常组织和癌组织的细胞增殖和分化起着重要的调控作用[8]。Wnt信号分子是癌症诊断、治疗和预防以及再生医学、组织工程的有效靶点[9]。Wnt家族由19个分泌糖蛋白组成,Wnt7a是该家族的一种39kDa糖蛋白, 通常在肺、睾丸、淋巴结和脑中表达,已公布的数据显示Wnt7a在不同类型的恶性肿瘤中表现出不同的表达模式[10,11,12]。在浆液性卵巢癌中,CTNNB1未突变情况下,Wnt7a
通过CTNNB1(β-catenin)/TCF信号通路促进卵巢癌进展[8]。在膀胱癌中,Wnt7a的过表达促进了肿瘤的转移,并且高表达Wnt7a蛋白的膀胱癌患者的总生存期较短[10]。在乳腺癌中,Wnt7a作为一种关键的肿瘤细胞分泌因子,通过诱导成纤维细胞活化而促进肿瘤细胞在体内转移,导致患者预后差[13]。相反,在宫颈癌中,Wnt7a可以抑制癌细胞的增殖和迁移[12]。在小鼠,Wnt7a通过失活S期激酶相关蛋白(一种重要的细胞衰老的替代调节因子)诱导细胞衰老,从而抑制肺癌的发生[14]。在白血病中,Wnt7a也被鉴定为肿瘤抑制基因[15]。

表1 Wnt7a在胃癌组织中的表达与临床病理参数及预后的关系Tab. 1 Relationship between expression of Wnt7a and clinicopathologic characteristics and prognosis of gastric cancer

图3 过表达Wnt7a对SGC7901细胞增殖和凋亡的影响。A1,EDU染色检测细胞增殖(比例尺,50μm);A2,EDU染色检测细胞增殖的统计学分析;B,MTS法检测细胞增殖的统计学分析;C1,PI-Annexin V流式细胞术分析细胞凋亡;C2,PI-Annexin V流式细胞术分析细胞凋亡的统计学分析,与对照组(Control)比较; *, 0.01<P<0.05Fig. 3 Effect of Wnt7a overexpression on the proliferation and apoptosis of SGC7901 cells. A1, EDU staining detection for cell proliferation (scale bar,50μm); A2, statistical analysis of cell proliferation detected by EDU staining; B, statistical analysis of cell proliferation detected by MTS assay; C1,PI-Annexin V flow cytometry for cell apoptosis; C2, statistical analysis of cell apoptosis detected by PI-Annexin V flow cytometry; compared with the control group; *, 0.01 <P< 0.05

图4 过表达Wnt7a对SGC7901细胞迁移和侵袭的影响。A,代表性迁移和侵袭实验结果(比例尺,50μm);B,迁移和侵袭实验统计学分析;与对照组比较:*, 0.01 <P < 0.05;**,P< 0.01。Fig. 4 Effect of Wnt7a overexpression on migration and invasion of SGC7901 cells. A, representative results of migration and invasion assays (scale bar, 50μm); B, statistical analysis of migration and invasion assays; compared with the control group∶ *, 0.01 < P< 0.05; **, P< 0.01
为了探讨Wnt7a在胃癌发生发展中的作用,我们通过qRT-PCR技术、Western blot技术及免疫组织化学技术,检测Wnt7a在胃癌组织和癌旁正常组织中的表达差异,发现与癌旁正常组织相比,Wnt7a在胃癌组织中的表达明显降低,由此提示Wnt7a在胃癌的发生过程中可能发挥了抑癌基因的作用。进一步观察Wnt7a的表达与临床病理参数及预后的关系发现,Wnt7a低表达患者胃癌的肿瘤体积相对较大,TNM分期较高,淋巴结转移率较高,且低表达Wnt7a的患者预后不良。通过在胃癌细胞系SGC7901过表达Wnt7a后检测细胞增殖、凋亡、迁移和侵袭发现,Wnt7a能显著抑制细胞的增殖、侵袭和迁移能力,对细胞凋亡无明显影响。以上实验结果表明Wnt7a在胃癌的发生发展中发挥了抑癌基因的作用,能够显著抑制细胞的增殖、侵袭和迁移。Wnt7a是一种分泌型糖蛋白,主要参与Wnt信号通路的传导过程。明确Wnt7a是否通过Wnt信号通路及通过哪些信号分子参与胃癌的发生发展无疑具有重要意义。

