重组 Bacillus stearothermophilus β-CGTase在 β-环糊精制备中的应用条件优化
范博望 , 段绪果 , 吴 敬 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
环糊精(cyclodextrin,简称CD)是一种环状低聚糖的总称,其中较为典型的有α-环糊精、β-环糊精和γ-环糊精,它们分别由6、7和8个葡萄糖残基组成,每个葡萄糖残基之间由1,4-糖苷键连接而成[1-3]。由于每个葡萄糖单元采用了椅形构象,环糊精的形状像一个中空的具有亲水性外表面的截锥体,因此在水中具有较好的溶解性[4]。并且它中心疏水,外表面亲水的结构使得其能够包埋很多的疏水性分子或者基团,从而形成包合物。经过环糊精包埋以后的分子或基团的理化性质,比如水溶性、挥发性、参与化学反应的性能等都会因此而改变[5],所以环糊精在食品、农业、化学、医药等领域都有着广泛的应用[6]。β-环糊精由于相对容易析出、易于分离的特性使得其在3种环糊精中最易实现工业化生产。
环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,简称CGTase)可以作用于淀粉、糖原、麦芽寡聚糖等葡萄糖聚合物底物,通过环化反应生成环糊精。自从CGTase被发现以后,酶法转化工艺逐渐取代化学合成法成为环糊精的主要生产方法。 在大多数时候,α-[7]、β-[8-9]、γ-[10-11]环糊精会同时存在于转化体系中,以占比最大的环糊精作为主要产物可以将CGTase分为α-CGTase、β-CGTase和γ-CGTase。此外,由于不同的有机溶剂可以选择性地沉淀目标环糊精,从而使得反应平衡向主要生成某单一环糊精的方向移动。因此在实际生产中,除选择相应的CGTase以外,还需要添加对应的有机溶剂来提高某一环糊精的比例。如制备α-环糊精时常用的癸醇[12],制备β-环糊精时使用的环己烷、甲苯、叔丁醇[13],制备γ-环糊精时使用的环十二酮[11]等,都能有效的提高目标环糊精的转化率。然而,环糊精制备时常用的淀粉原料中通常含有80%左右的支链淀粉,支链淀粉中除含有α-1,4-葡萄糖苷键外。还含有一定比例的α-1,6-葡萄糖苷键,CGTase能够水解α-1,4-葡萄糖苷键,但是不能水解α-1,6-葡萄糖苷键,因此在不添加淀粉脱支酶的条件下,难以对淀粉进行彻底的转化。为了解决上述问题,Rendleman建立了先添加普鲁兰酶或异淀粉酶对淀粉进行预处理,然后再加入CGTase进行转化的二步法酶转化工艺[14]。该方法可以有效地提高环糊精的转化率,但是由于第一步脱支反应之后会形成大量的结晶状态的直链淀粉,导致第二步转化周期长达7 d以上。为了解决上述问题,江南大学的段绪果[12]、王磊[10]等分别将异淀粉酶与α-CGTase或γ-CGTase进行复配,建立了脱支与环化反应相偶联的同步转化工艺,显著地地提升了α-环糊精和γ-环糊精转化率及生产强度。但是,关于普鲁兰酶或异淀粉酶与β-CGTase复配同步转化淀粉制备β-环糊精的报道还未见报道。
作者所在研究室在前期研究中曾经试图利用异淀粉酶与β-CGTase进行同步转化制备β-环糊精,但是转化率没有明显提高。为解决上述问题,作者在制备重组β-CGTase的基础上,首次对单酶法制备β-环糊精的条件进行了优化;在此基础上,将重组β-CGTase与作者所在研究室自己制备的普鲁兰酶进行复配,建立了同步脱支环化高效生产β-环糊精的方法。
1 材料与方法
1.1 菌种及酶液
产嗜热脂肪芽孢杆菌β-CGTase的重组短小芽孢杆菌:作者所在实验室保藏;普鲁兰粗酶液:作者所在实验室制备并保存,酶活力约为1 200 U/mL。
1.2 培养基
TM 培养基(g/L):多聚蛋白胨 10,牛肉粉 5,酵母粉2,葡萄糖10;pH 7.0,新霉素终质量浓度10 μg/mL。
1.3 主要试剂
多聚蛋白胨:BBI公司;牛肉粉、酵母粉:英国Oxoid公司;分析纯α-、β-、γ-环糊精:美国Sigma公司;甘油、葡萄糖等各种国产分析纯试剂:国药集团化学试剂有限公司。
1.4 摇瓶发酵产环糊精葡萄糖基转移酶
将实验室保存的菌株以0.1%的接种体积分数接种至TM培养基,30℃、200 r/min培养12 h。然后以5%接种体积分数转接至50 mL TM培养基,30℃、200 r/min培养48 h。将发酵液离心去除菌体,上清液即为环糊精葡萄糖基转移酶粗酶液。
1.5 环糊精葡萄糖基转移酶β-环化活力的测定
由于酚酞可以被β-环糊精包埋,包埋前后的吸光度会发生变化,因此可以采用比色法测定酶活[15-16]。用25 mmol/L、pH 5.5的Na2HPO4-KH2PO4缓冲液配制1%的可溶性淀粉为底物,取2 mL底物溶液,50℃水浴10 min,加入0.1 mL适当稀释的粗酶液,以只加缓冲液的体系作为对照。精确反应10 min后,加入0.2 mL、0.6 mol/L HCl终止反应。然后,加入0.5 mL、0.6 mol/L Na2CO3调节 pH 至 10.0。将反应体系温度调节到25℃后,加入0.2 mL、1.2 mmol/L酚酞溶液并显色15 min,然后在550 nm处测定吸光值。一个酶活单位(U)定义为在上述测定条件下1 min内生成1 μmol β-环糊精所需要的酶量。
1.6 β-环糊精的生产方法
使用去离子水溶解配置15 g/dL的淀粉悬液,搅拌并加热至70~80℃,以1 U/g干淀粉的用量加入β-CGTase粗酶液,液化10 min,冷却至室温后用5 mol/L NaOH及盐酸调节pH至指定范围。然后再加入β-CGTase酶液 (5~15 U/g底物)及体积分数5%环己烷,充分混匀后在恒温、150 r/min水浴摇床中反应24 h。转化结束后通过沸水浴加热灭酶,蒸馏除去环己烷,蒸馏液与纯乙腈1∶1混匀,静置2 h,12 000 r/min离心30 min,除去未转化的糊精及淀粉,然后采用HPLC测定转化产物中的成分及含量。
1.7 β-环糊精测定方法及转化率的计算
产物中的β-环糊精含量采用高效液相色谱来检测。色谱条件为:Agilent1200 HPLC色谱仪,Agilent自动进样器,色谱柱为Thermo NH2-APS2 250 mm×4.6 mm,示差检测器为 Agilent 2410;流动相采用体积分数70%乙腈溶液,流速为0.8 mL/min,柱温设定为40℃。

2 结果与分析
2.1 重组β-环糊精葡萄糖基转移酶的摇瓶发酵制备
将保存于-80℃的菌种以0.1%的接种体积分数接种至TM培养基,30℃、200 r/min培养12 h。再以5%接种体积分数转接至50 mL TM培养基,30℃、200 r/min培养,每隔12小时取样测酶活,将酶活随着时间变化的曲线绘制成图,结果见图1。随着时间的推移,重组β-CGTase酶活不断增加,诱导48 h达到最高酶活49 U/mL,继续增加培养时间,胞外酶活开始缓慢下降。

图1 重组菌在摇瓶发酵中的产酶曲线Fig.1 Fermentation process of the recombinant Brevibacillus sp.in shake flask
2.2 底物质量浓度对β-环糊精转化率的影响
以淀粉为底物制备β-环糊精时,转化率会随着底物质量浓度的增加而降低,当底物质量浓度低时,虽然转化率较高,但是综合成本较高,并不适合应用于工业化生产[17]。
为了考察上述工艺条件下不同底物质量浓度生产环糊精的情况,找到适合工业化生产的底物质量浓度,使用去离子水悬浮马铃薯淀粉并调节pH至6.8,然后加入1 U/g底物的β-CGTase液化。控制β-CGTase加酶量为5 U/mL,加入体积分数5%环己烷,在40℃下进行酶转化,测定其酶转化后的β-环糊精质量浓度,结果见表1。随着马铃薯淀粉质量浓度的增大,α-环糊精比例越来越高,产物特异性降低。当淀粉底物质量浓度为15 g/dL时,环糊精总转化率达到62.2%,β-环糊精占比为88.6%。考虑到工业生产节省资源、降低成本的原则,在之后的试验中选择15 g/dL底物浓度作为标准。
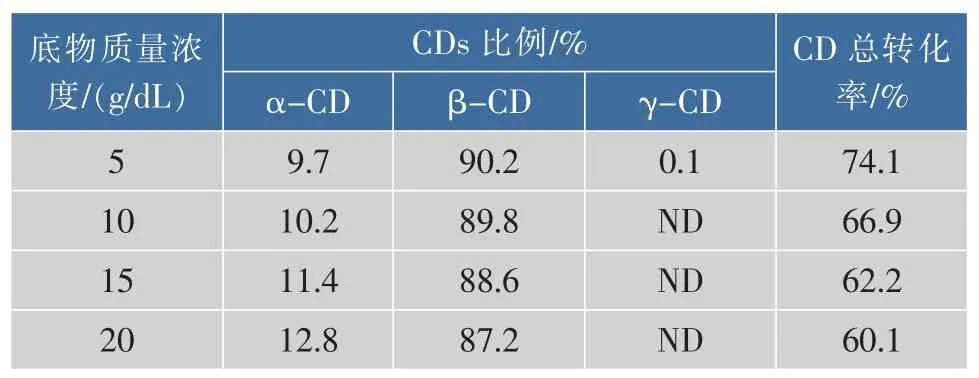
表1 底物质量浓度对环糊精制备的影响Table 1 Effectofcassava starch concentration on cyclodextrin production
2.3 反应时间对β-环糊精转化率的影响
反应时间与酶转化反应的速度有关。时间过长,会发生偶合反应,降低转化率及生产强度,使得反应副产物增多;转化时间短,反应进行的不彻底,转化率就会偏低[7]。
为了探究反应时间对β-环糊精生产的影响,使用去离子水悬浮马铃薯淀粉并调节pH至6.8,然后加入1 U/g底物的β-CGTase液化控制β-CGTase加酶量为5 U/mL,添加体积分数5%环己烷,在40℃下进行酶转化,结果见表2。随着转化时间的延长,环糊精总转化率及β-环糊精转化率会一直上升至18 h左右,环糊精总转化率最大达到64.4%,β-环糊精占比89.5%,之后转化率便不再上升。为节约成本,增加生产强度,反应时间被确定为18 h。
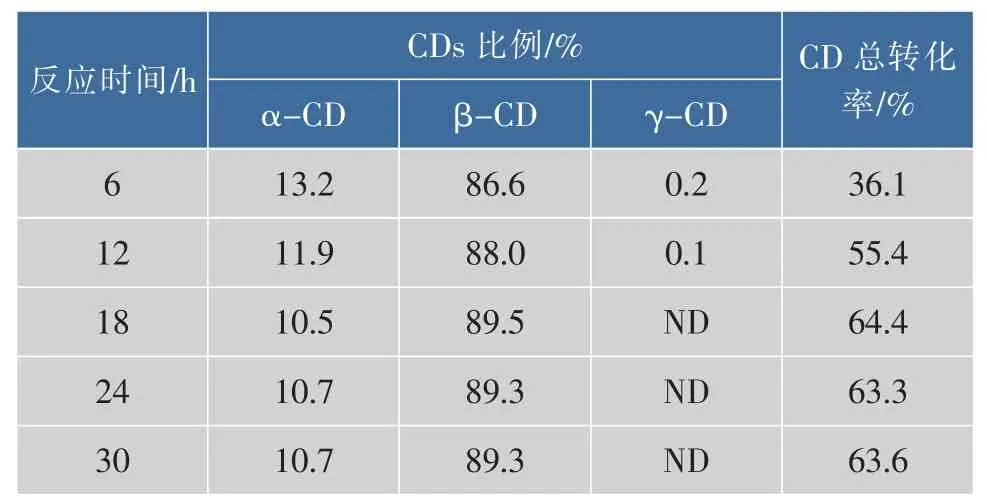
表2 反应时间对环糊精生产的影响Table 2 Effect of time on cyclodextrin production
2.4 初始pH对β-环糊精转化率的影响
反应过程中的pH对酶转化反应有着重要的影响,因为pH会影响酶活性中心的基团解离程度,从而影响酶与底物分子的结合,进而影响最终的转化效果。只有在合适的pH下,底物分子才能和酶最好地结合,使酶反应速率达到最高[18-19]。
为了探究不同pH对β-环糊精转化率的影响,使用NaOH和稀盐酸调节液化后淀粉溶液pH分别为 4.0、4.5、5.0、5.5、6.0、6.5、7.0,控制 β-CGTase 加酶量为5 U/mL,环己烷体积分数5%,在40℃下进行酶转化,结果见表3。在pH为4.0时,环糊精的总转化率只有43.0%,并且其中β-环糊精所占比例只有54.6%,产物特异性低;随着pH值的升高,环糊精的总转化率逐渐升高,并且β-环糊精所占比例也逐渐升高,产物特异性更高。当pH为6.0时,环糊精总转化率最高,达到68.1%,并且β-环糊精约占其中的87.2%。同时也可以看出,当pH在6.0~7.0时,β-环糊精转化率保持在较高水平。这或许是由于来自嗜热脂肪芽孢杆菌的环糊精葡萄糖基转移酶是一种偏中性的酶,其最适pH为6.5,因此在pH 6.0~7.0时,该酶相对稳定,其活性中心的解离程度良好,从而具有较好的催化效果。

表3 反应pH对环糊精生产的影响Table 3 Effect of pH on cyclodextrin production
2.5 反应温度对β-环糊精转化率的影响
温度会影响到酶的稳定性及催化速率,因此考察温度对β-环糊精转化率的影响。液化完成后调节pH为6.0,β-CGTase加酶量为5 U/mL,环己烷体积分数为5%,结果见表4。在50℃下,环糊精总转化率及β-环糊精所占比例均达到最高,分别为69.8%和96.6%。而在60℃时,环糊精总转化率及β-环糊精所占比例只有61.5%和97.4%,这可能是由于温度影响了反应过程中的分子结合力和活化能。该酶在60℃时热稳定性变差。可以看出,随着温度升高,β-环糊精在产物中所占的比例越大,产物特异性越好,这可能是因为温度越高,越利于环己烷对β-环糊精的包埋。综合以上因素,选用50℃的作为后续研究的反应温度。

表4 反应温度对环糊精生产的影响Table 4 Effect of temperature on cyclodextrin production
2.6 环糊精葡萄糖基转移酶加酶量对β-环糊精转化率的影响
β-CGTase是一种具有环化、偶合、歧化和水解4种活力的多功能型酶,4种活力在反应体系中同时存在并且相互影响,其相互作用关系与反应体系中β-CGTase的加量有关,因此转化率会受到β-CGTase加酶量的影响[19]。
作者通过加入不同量的β-CGTase来探究其对β-环糊精转化率的影响,结果见表5。当加酶量为3 U/g底物时,环糊精总转化率及β-环糊精比例都最低。可能是此时过低的加酶量使得切割淀粉的水解活力跟不上形成环糊精的环化活力。而当加酶量为15 U/g底物时,环糊精总转化率及β-环糊精转化率均出现下降,可能是此时环化活力已经饱和,而水解、歧化与耦合活性随着加酶量的增加进一步增强,导致生成的环糊精又被转化为其他产物。而当加酶量为13 U/g底物时,环糊精总转化率最高,为73.9%,此时,β-CD比例为98.7%。综合考虑,β-CGTase添加量为13 U/g底物。

表5 CGTase加酶量对环糊精生产的影响Table 5 Effect of α-CGTaseconcentration on cyclodextrin production
2.7 普鲁兰酶加酶量对β-环糊精转化率的影响
普鲁兰酶可以对马铃薯淀粉的支链进行脱支,形成的之链淀粉更有利于CGTase的环化,提高转化率。但是脱支后的淀粉比脱支前的支链淀粉溶解度更低,因此当普鲁兰酶加量过大时,会导致淀粉脱支形成的直连淀粉析出形成结晶,使得最终转化率降低。
为了确定最适的普鲁兰酶加量,作者考察了在之前优化的条件下不同普鲁兰酶加量时β-环糊精的转化率,结果见表6。环糊精总转化率随着普鲁兰酶加量的增多先上升后下降。当普鲁兰酶用量为50 U/g底物时,环糊精总转化率达到81.4%,β-CD所占比例为97.7%。综合考虑,将普鲁兰酶的加酶量定为50 U/g底物。
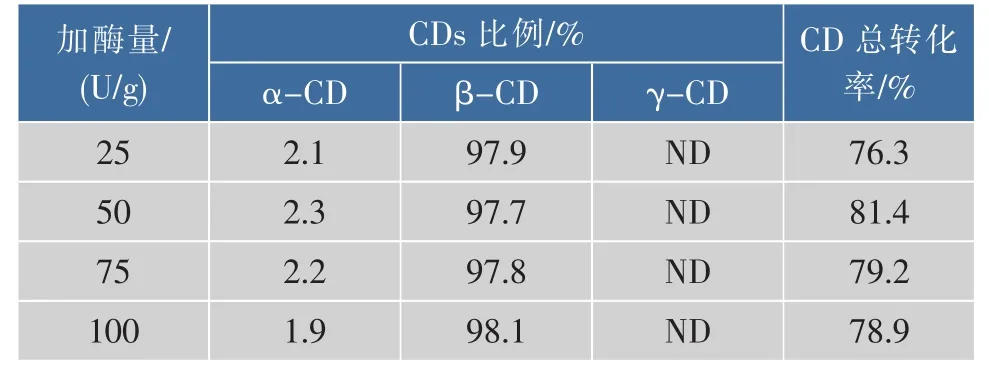
表6 普鲁兰酶加酶量对环糊精生产的影响Table 6 Effect of pulullanase concentration on cyclodextrin production
3 结 语
作者将产嗜热脂肪芽孢杆菌Bacillus stearothermophilus的β-环糊精葡萄糖基转移酶的重组短小芽孢杆菌在摇瓶中发酵培养48 h后,胞外发酵液中酶活最大为49 U/mL。使用该酶制备β-环糊精时,经过优化底物浓度、反应时间、初始pH、反应温度、β-CGTase加酶量,发现在底物质量浓度为15 g/dL,初始pH为 6.0,在 50℃下加入 13 U/g底物的CGTase时,经过18 h的转化,环糊精的总转化率最高为73.9%,其中β-环糊精占98.7%。在此基础上,在反应体系中添加普鲁兰酶使得淀粉脱支与β-CGTase的环化反应同时进行,优化后普鲁兰酶的最适加酶量为50 U/g底物,在最优条件下环糊精总转化率提升至81.4%,其中β-环糊精占比97.7%。

