α-葡聚糖酶在模拟炼糖生产条件下的活性变化
黎志德,梁达奉,黄曾慰,张九花,常国炜,刘桂云
(广东省科学院广东省生物工程研究所,广东省酶制剂与生物催化工程技术研究中心,广东广州 510316)
α-葡聚糖酶(Dextranase,EC 3.2.1.11)可以专一性水解α-1,6-糖苷键,使大分子的葡聚糖水解成小分子的寡聚糖[1]。甘蔗在收割、存放和后续加工生产环节中容易发生细菌感染导致α-葡聚糖的产生。文献指出[2],蔗汁中出现的 α-葡聚糖其高聚合度部分的占比高达31.32%,相对分子质量可以达到1.02×106,这对于精炼糖的生产和成品质量都有不良影响。炼糖生产时,α-葡聚糖在溶糖和澄清工段的累积会增大糖浆粘度,减慢过滤速度、絮凝速度及浮渣压紧速度,阻塞脱色系统,而在结晶工段则引起糖蜜粘度增高,蔗糖分结晶率降低,结晶异形体出现等现象。因此α-葡聚糖酶在甘蔗亚硫酸法制糖[3,4]、原糖精炼[5]以及甜菜制糖[6]都有应用。文献指出,加入0.05 U/mL的酶即可将蔗汁中浓度为800~900 mg/kg °Bx的α-葡聚糖完全去除[7]。另有报道[8]在甘蔗混合汁中加入国外已有商业化应用的α-葡聚糖酶,按酶活30000 U/mL计算加入5~10 mg/kg,反应30 min后,葡聚糖去除率接近90%。同时,甘蔗制糖生产线上实验表明,降解的α-葡聚糖可以减少沉降时间,提高简纯度[9]。由于 α-葡聚糖酶在pH接近中性以及高温下酶促反应活性均会受到影响[10,11],因此甘蔗制糖生产线应用时在选择反应环境条件相对温和而且停留时间较长的点加入,例如压榨车间第 1座及倒数第 2座压榨机组的蔗汁槽[12],或者将蔗汁槽条件温度控制在20到45 ℃之间,pH在5.4到6.8之间[13];但是,在炼糖生产中,溶糖的糖浆浓度一般大于 50 °Bx,溶液粘度很大,同时pH在6.0到6.8之间,温度大于65 ℃,根据此前在无机缓冲盐溶液中的数据,此条件会造成α-葡聚糖酶酶促反应速率和稳定性明显下降。另一方面,文献也提出高浓度蔗糖对酶蛋白有一定的保护作用[14]。同时,由于原糖原有的葡聚糖并不会随着炼糖生产流程被大幅除去,反而会在结晶时混入精糖当中,因此同一批次原料会持续影响成品品质,使其对后续深加工造成影响更为突出。文献指出[5],通过改变工艺参数,α-葡聚糖酶同样可以快速清除原糖糖浆、过滤清浆和脱色清浆中的α-葡聚糖,并在连续加入24 h后,精糖成品不再检出葡聚糖。此前文献多以酶在最适条件下的反应特征为基准,去考虑如何在制糖生产中的应用,较少研究酶在具体生产工艺条件下的情况,因此本文针对性地模拟炼糖条件,研究α-葡聚糖酶在类似条件下的活性变化。
1 材料与方法
1.1 原料
1.1.1 主要实验材料
α-葡聚糖酶冻干粉,葡聚糖单克隆抗体检测试剂盒,(原糖),广东省生物工程研究所;α-葡聚糖T-2000标准品,美国法玛西亚公司;3,5-二硝基水杨酸,国药集团化学试剂有限公司;蔗糖、柠檬酸,磷酸二氢钾,磷酸氢二钠、浓盐酸、氢氧化钠,酒石酸钾钠,无水亚硫酸钠,苯酚(分析纯),广州化学试剂厂。
α-葡聚糖酶基因序列来源于Chaetomium,由重组毕赤酵母发酵生产,广州市微生物所制作成冻干粉,酶在pH 5.5下保存,最适反应温度为50~60 ℃,最适反应 pH为5~6。分析纯蔗糖应预先测定原始葡聚糖含量。
1.1.2 主要实验仪器
FiveEasy™ FE20 pH计,AL104电子分析天平,美国梅特勒公司;DK-S24型电热恒温水浴箱,上海精宏实验设备有限公司;2800型紫外-可见分光光度计,美国尤尼科公司。
1.2 实验方法
1.2.1 材料准备
取 α-葡聚糖酶冻干粉用柠檬酸-磷酸氢二钠缓冲液溶解,pH 5.5,粉末与缓冲液的质量体积比不低于1:20,定容,测定酶活,置于4 ℃保存备用。酶活测定方法按DNS(3,5-二硝基水杨酸)法[15],即将酶液稀释适当倍数,加入到底物溶液中,55 ℃水浴反应10 min,加入DNS,沸水浴5 min,定容,测定OD540nm。
酶活定义:采用 DNS法,每分钟催化底物(α-葡聚糖T-2000标准品)水解产生1 μmol还原糖所需的酶量为1个酶活单位,以U表示。
剩余酶活定义:在经过改变溶液环境,温度和pH条件处理后,按一定时间重新测定酶活,以起始酶活为100%,处理后测定数据折算成对应百分比。
1.2.2 高温条件下α-葡聚糖酶的酶活变化
将酶液分别在55 ℃、65 ℃、75 ℃、85 ℃下水浴保温,于5 min、10 min、15 min分别取样,测定酶活。
1.2.3 高温与近中性pH条件下α-葡聚糖酶的酶活变化
将酶液分别使用pH 5.5、6.0、6.5、7.0、8.0的磷酸二氢钾-磷酸氢二钠缓冲溶液按照体积比1:9稀释,在55 ℃、65 ℃、75 ℃、85 ℃下水浴保温,于5 min、10 min、15 min后取样,测定酶活。
1.2.4 蔗糖浓度对测定酶活的影响
按照质量体积比2%将标准α-葡聚糖T-2000标准品加入到预先配制好的10、20、30、40、50、60 °Bx蔗糖溶液,加热搅拌至完全溶解,冷却后置于4 ℃保存备用,加入步骤1.2.1中预处理的酶液,测定酶活。
1.2.5 在60 °Bx蔗糖溶液,高温、中性pH环境下α-葡聚糖酶的酶活变化
配制60 °Bx的蔗糖溶液,其初始pH一般在pH 6.0左右,分别用1 mol/L的盐酸或氢氧化钠溶液调节pH至5.5、6.0、7.0、8.0,置于4 ℃保存备用。反应前,与酶液按照体积比1:9的比例混合均匀,并在55、65、75、85 ℃下水浴保温,于5 min、10 min、15 min后取样,测定酶活。
1.2.6 酶浓度对酶热稳定性测定的影响
将酶液分别用60 °Bx蔗糖溶液稀释10倍、100倍和1000倍,并在55 ℃下水浴保温,于5 min、10 min、15 min后取样,测定酶活。
1.2.7 酶在高温环境下降解原糖中的α-葡聚糖
用蒸馏水将原糖溶解至60 °Bx,测定pH,分别在55 ℃、65 ℃、75 ℃、85 ℃下保温,加入α-葡聚糖酶至浓度为0.3 U/mL,每隔10 min取样测定葡聚糖含量,至1 h,α-葡聚糖含量按免疫比浊法测定[16]。
1.2.8 数据统计分析
预先按照DNS法得到葡萄糖标准曲线:
葡萄糖含量(mg/mL)=A×OD540nm+b。
测定所得OD540nm值,按一下公式进行换算:
酶活(U/mL)=(OD540nm-b)/A×稀释倍数×1000/180
每次反应前,先将预处理好的酶液进行酶活测定,以起始样本测定所得酶活为 100%,然后按百分比折算各个反应后样本的值为剩余酶活,其中步骤 1.2.4中直接以无机盐缓冲液中所测得酶活为100%。
步骤1.2.7计算葡聚糖含量方法见引用文献。
2 结果与讨论
2.1 温度和pH变化对α-葡聚糖酶的影响
2.1.1 高温下α-葡聚糖酶的酶活变化
取pH 5.5柠檬酸-磷酸氢二钠缓冲液配制的α-葡聚糖酶酶液在各温度区间水浴,分时间段取样并按照适当的比例稀释,测定酶活,折算成相对值:
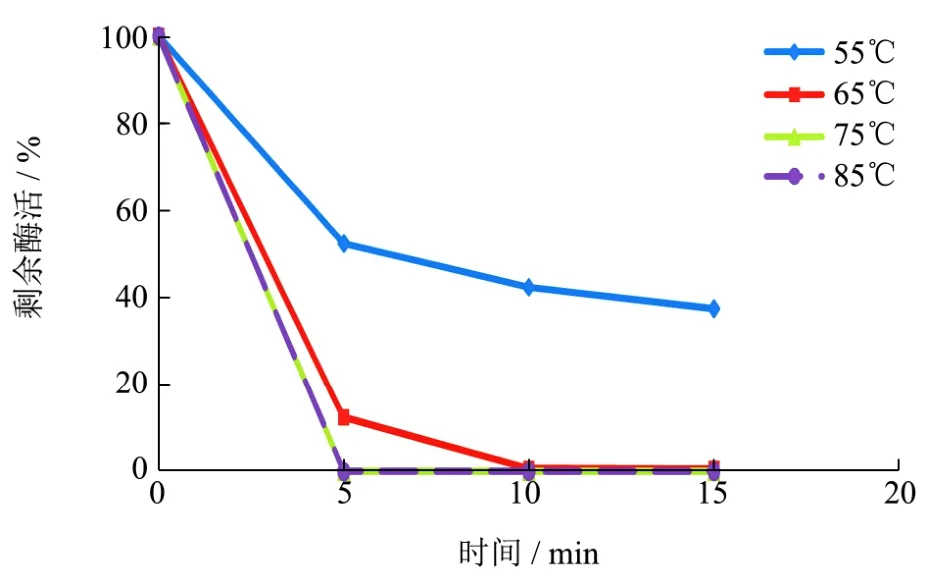
图1 高温下的酶活变化Fig.1 The changes of enzyme activity under high temperature
从图1中可见,在55 ℃下,α-葡聚糖酶活性在水浴后5 min出现明显下降后保持相对稳定,水浴15 min后剩余酶活为37.54%。在65 ℃,75 ℃和85 ℃下,水浴5 min后酶活进一步下降,其中85 ℃的样本酶活未检出。说明在磷酸盐缓冲液中,当温度大于65 ℃时α-葡聚糖酶并不稳定。
2.1.2 高温与近中性pH条件下α-葡聚糖酶的酶活变化
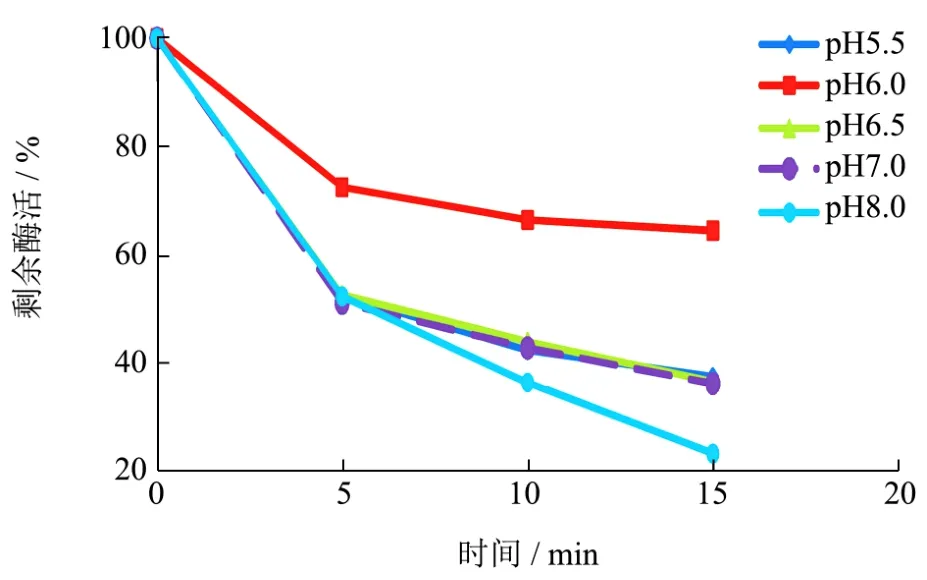
图2 在55 ℃和近中性pH条件下的酶活变化Fig.2 The changes of enzyme activity under 55 ℃ and near neutral pH
55 ℃水浴条件下,不同pH样本酶活经过折算后得到图2。从图中可见,在水浴保温过程中,前5 min各组的酶活力都大幅下降,之后下降速率降低。在55 ℃,pH 6.0条件下的α-葡聚糖酶表现得更稳定,保温15 min后剩余酶活为64.53%。pH 5.5、pH 6.5、pH 7.0和pH 8.0的结果相类似,5 min后,剩余酶活分别为52.52%、52.70%、55.00%和54.16%。15 min后分别为37.54%、36.62%、36.23%和23.26%,说明在55 ℃下,弱酸性的pH环境对该酶保持稳定性更有利[14]。
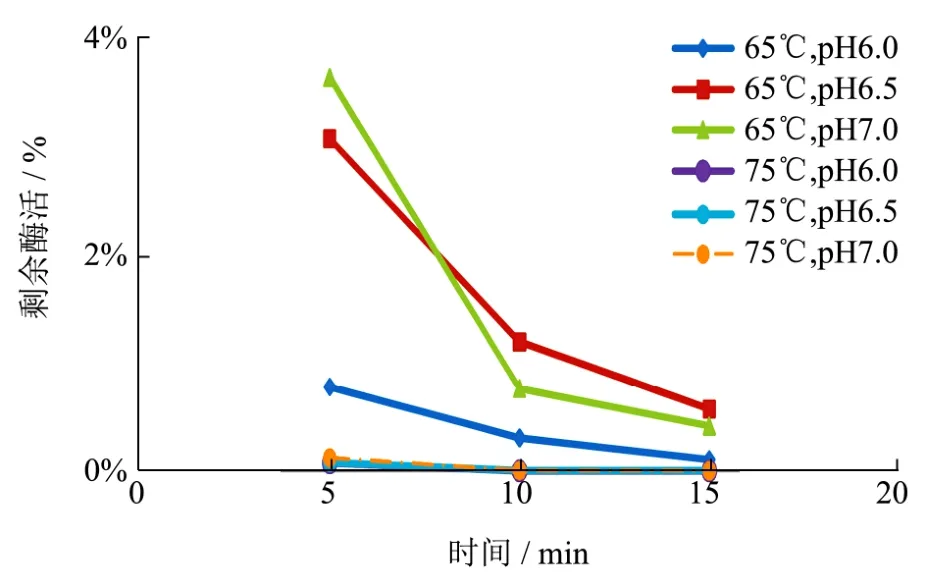
图3 在65 ℃、75 ℃和中性pH下的酶活变化Fig.3 The changes of enzyme activity under 65 ℃,75 ℃ and neutral pH
在65 ℃到75 ℃区间内,酶活损失明显加快,5 min后所有样本的酶活都剩余不足10%,随着温度的上升,接近中性pH环境的能保留更多酶活。而水浴温度为85 ℃的各个样本,酶活均未检出。
2.2 蔗糖溶液对α-葡聚糖酶的影响
2.2.1 蔗糖浓度对酶活测定的影响
以缓冲液体系中测得酶活为 100%,将不同蔗糖浓度下测得的酶活折算成相对酶活,结果如图所示。结果表明蔗糖浓度与 α-葡聚糖酶酶活测定值呈负相关,这是由于环境体系中粘度上升造成。实际生产中,由于糖浆粘度会随着温度上升而下降,同时高浓度的蔗糖对酶蛋白也有一定的保护作用,最终酶在生产线上的使用效果受以上三个因素共同影响。

图4 蔗糖浓度对测定酶活的影响Fig.4 Effect of sucrose concentration on enzyme activity measure
2.2.2 在60 °Bx蔗糖浓度,高温、近中性pH环境下α-葡聚糖酶的酶活变化
按时间段从不停pH的蔗糖溶液中取样后经稀释后测定酶活,折算后统计,实验结果如下表:
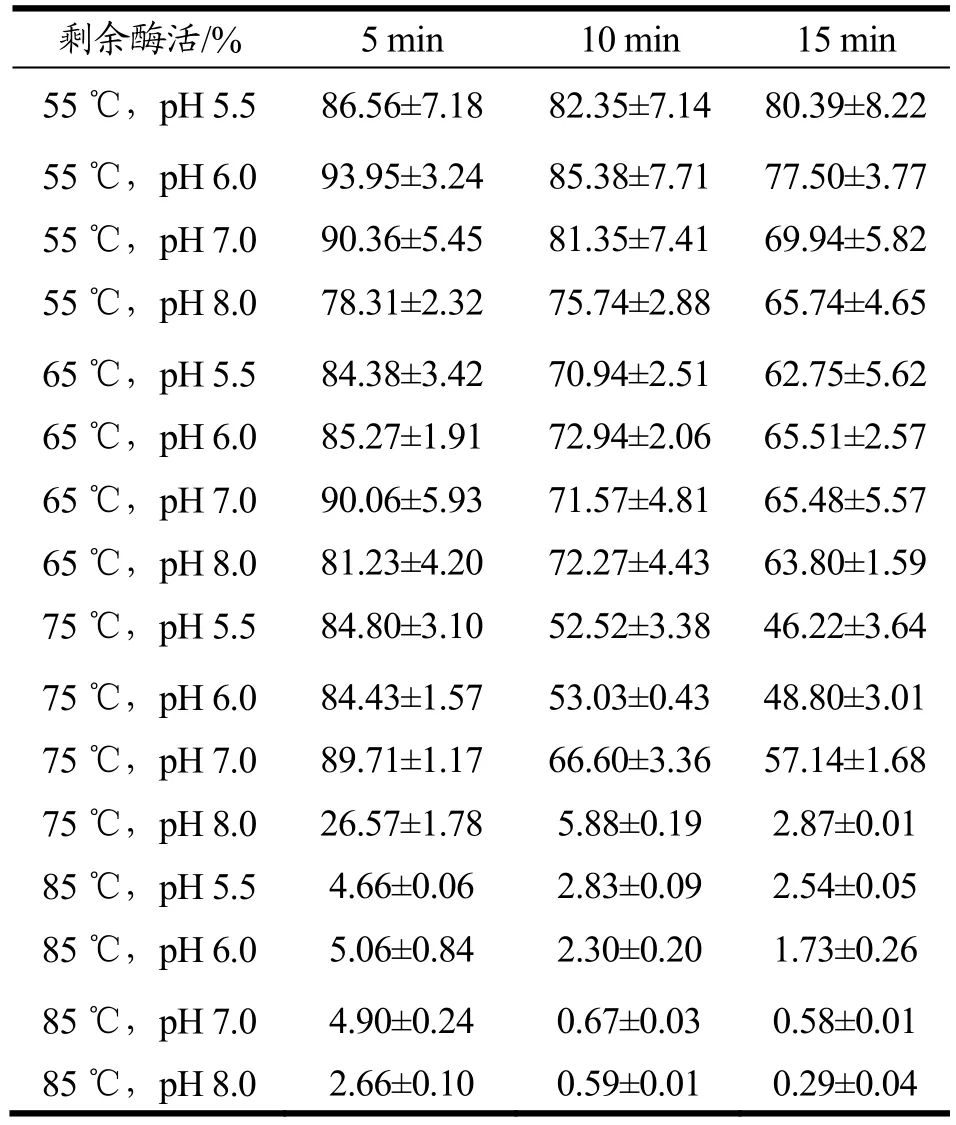
表1 酶在高蔗糖浓度,近中性pH,高温下的酶活变化Table 1 The effects of Near-neutral pH, high temperature and high sucrose concentration environment onenzyme activity
表中数据表明,α-葡聚糖酶在60 °Bx蔗糖溶液中活性能够保持稳定的温度和pH的范围都明显增大。在55 ℃~75 ℃和pH 5.5~8.0的条件下,除了75 ℃,pH 8.0的这组样本酶活损失明显以外,其他样本5 min后的剩余酶活都在80%以上。保温10 min后,测得剩余酶活保持60%以上,15 min后保持在40%以上。
当温度达到 85 ℃时,酶的热稳定性出现明显的下降,5 min后酶活都低于6%。随着温度的上升,中性pH样本中酶的稳定性较弱酸、弱碱性的样本强,与此前缓冲液体系中的实验结果相一致。综上所述,在炼糖生产中使用α-葡聚糖酶时,将反应环境保持在不高于75 ℃,预留15 min的停留时间,会明显提升酶的反应效率,减低使用量,提升效益。同时在甘蔗制糖生产中,为了避免蔗糖受热水解形成还原糖,一般会将pH调节至中性附近,该操作有利于α-葡聚糖酶保持活性。
2.2.3 酶浓度对酶热稳定性测定的影响
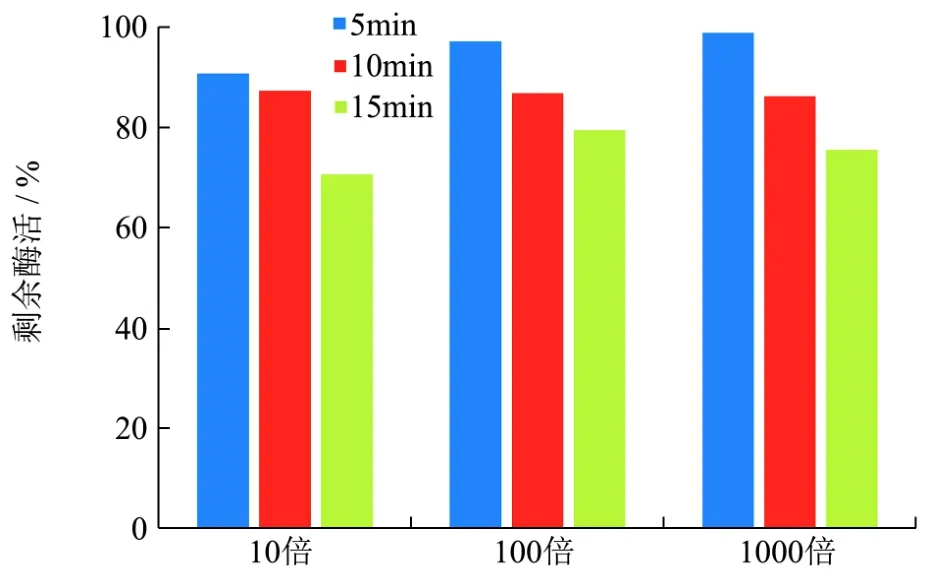
图5 酶液浓度对热稳定性测定的影响Fig.5 The effect of enzyme concentration on the determination of thermal stability
将不同稀释倍数测得结果折算成相对酶活,结果如图5。由图5可见,α-葡聚糖酶在蔗糖溶液中稀释倍数的变化,对酶的热稳定性测定结果影响较小,不同组间差异不超过10%。
2.2.4 在65和75 ℃下加酶降解原糖中原有的葡聚糖
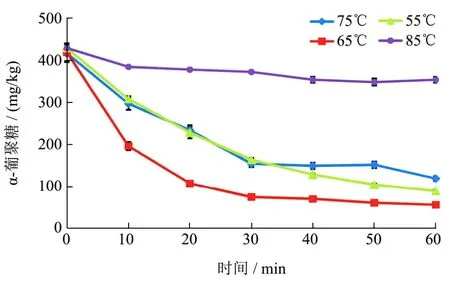
图6 酶在不同温度下降解原糖中的α-葡聚糖Fig.6 Enzymatic degradation of α-glucan in raw sugar at different temperature
取巴西进口原糖,按质量比3:3加入蒸馏水煮沸溶解,测得其最终锤度为64.5 °Bx,pH 5.92,四次取样分别测得其葡聚糖含量 428、431、433和 428 mg/kg °Bx,加入浓度为0.3 U/mL的α-葡聚糖酶反应1 h后结果如图6。
由图6可以得知,α-葡聚糖的降解大部分发生在酶加入后的前30 min,延长反应时间,除55 ℃样本α-葡聚糖含量还有比较明显的下降外,其他温度梯度下的样本变化幅度并不大。因此在生产应用时,可以用 30 min作为酶的单次投放最大持续反应时间。其中,65 ℃的样本降解效果最好,在酶加入后30 min,剩余的α-葡聚糖已不足100 mg/kg。55 ℃和75 ℃的样本效果次之,在反应30 min后剩余不足200 mg/kg。继续反应至60 min,55 ℃的样本中α-葡聚糖的含量会进一步下降到100 mg/kg,与65 ℃样本的结果较为接近。85 ℃下,α-葡聚糖酶在前10 min后失去大部分的活性,反应60 min后 α-葡聚糖下降量不足100 mg/kg,说明在85 ℃下,降解相同水平的α-葡聚糖时,需要提高酶的加入量。
3 结论
3.1 α-葡聚糖酶在高温和近中性pH条件下能保持一定的稳定性。无机盐缓冲液条件下,在pH 5.5~7.0的环境,55 ℃水浴15 min后剩余酶活仍保持20%到40%的区间内。在60 °Bx蔗糖溶液中,较高的溶液粘度使α-葡聚糖酶的酶促反应速率下降,同时热稳定性得到明显提升。在65 ℃,pH 5.5~8.0或75 ℃,pH 5.5~7.0下,水浴15 min后剩余酶活均可保持40%以上。
3.2 原糖精炼有多种工艺方案[17],一般工艺流程是原糖经过复筛后重溶,糖浆浓度保持在60 °Bx,温度为80~85 ℃,而pH会因为原糖批次不同有所差异,在pH 6.0左右波动。因此,实验将蔗糖溶液浓度设定为60°Bx,模拟炼糖生产的工艺条件。同时,由于不同批次来源的蔗糖溶解后的溶液pH存在差异,实验中使用的蔗糖配成60 °Bx溶液后,pH一般在5.5~6.0之间。结合实验的结果,考虑到pH 5.5是α-葡聚糖酶磷酸盐缓冲体系中最适反应温度下的最适反应pH,所以把试验pH范围起点统一调整到pH 5.5。根据本实验结果,α-葡聚糖酶具有直接加入到生产线上的条件。生产使用时根据实际情况,可以通过将溶糖温度控制在75 ℃以下,控制糖浆pH在中性附近和延长酶的停留时间来提高酶去除葡聚糖的效率,当环境温度超过75%或者 pH偏向碱性时,需要加大酶的加入量保证效果。

