酿酒酵母对黄酒酿造中氨基甲酸乙酯代谢及黄酒品质的影响
舒琴,焦志华,牛永武,陈启和,焦迎春
(1.浙江大学食品科学与营养系,浙江杭州 310058)(2.青海大学农牧学院,青海西宁 810016)
黄酒作为我国传统酿造的特色发酵饮品,酒精度通常在16%左右。传统黄酒保留了发酵过程中营养物质及活性物质,越来越受到人们的推崇。黄酒中的营养成分主要以蛋白质为主,且绝大部分蛋白质以肽和氨基酸形式存在,有利于人体吸收[1];另外黄酒中被检测出含有30多种无机盐,包括钙、镁、锌等人体正常生理功能不可或缺的因子[2];黄酒发酵原料中富含较高浓度的维生素,包括B族维生素、E族维生素及酵母细胞自溶释放的维生素[3];黄酒中含有的功能性低聚糖能够显著提高双歧杆菌的增值效果,具有很好的保健功能[4];黄酒中含有的酚类物质具有清除自由基、抗癌、抗衰老等功能;黄酒中还富含重要的抑制性神经递质γ-氨基丁酸和生物活性肽[5]。
黄酒是以谷物和水为原料,以酒药、麦曲等糖化发酵剂酿造而成。黄酒的品质和风味不仅取决于酿造工艺,还取决于所用的发酵原料及发酵微生物。霉菌和酵母对黄酒的生产起主导作用,另外细菌中某些乳酸菌对黄酒风味的形成有重要作用,而多数细菌对黄酒的生产是不利的[6]。黄酒中的微生物主要是由麦曲和酒药提供的,麦曲是黄酒酿造的糖化剂,同时赋予黄酒独特的风味。酒药中的微生物以根霉和酵母为主,因此具有糖化和发酵的双边功能。
通过对我国传统黄酒发酵工艺的研究表明,氨基甲酸乙酯主要来源于尿素。黄酒中的尿素一方面来自于发酵原料,另一方面来源于精氨酸的降解[1]。因此阐明精氨酸的代谢调控机制对于探究氨基甲酸乙酯的抑制途径具有重要意义,精氨酸及尿素在酿酒酵母中的代谢机制如图1所示。研究报道胞内精氨酸主要来源于两种途径:一是来自酵母细胞从细胞外的吸收,二是液泡中的大量蛋白酶,在降解蛋白质的过程中生成精氨酸[7,8,9]。酿酒酵母细胞内的精氨酸首先在精氨酸酶(CARl)作用下水解成为鸟氨酸和尿素,鸟氨酸在鸟氨酸转氨酶(CAR2)的作用下进一步转化为谷氨酸盐,而尿素降解为谷氨酸盐和二氧化碳[10]。细胞内的尿素在尿素羧化酶的作用下降解为脲基甲酸盐,脲基甲酸盐在脲基甲酸盐水解酶的作用下,进一步降解为铵盐和二氧化碳[10]。因此探究黄酒酿造过程中氨基甲酸乙酯的抑制途径需要从酿酒酵母氮代谢入手。另外传统黄酒酿造是开放式发酵,而且酒药中的酵母通常是工业化菌株,其氮代谢调控机制尚不明确;目前,已有研究报道对黄酒发酵体系中分离到的野生型菌株(YHJ7)和BY4741进行转录组分析,发现YHJ7和BY4741的基因转录水平非常相似(The Spearman correlation coefficient r=0.325,p<2.2e-16)[12]。这为应用实验室菌株探究氨基甲酸乙酯形成的氮代谢基础及调控机制提供新的角度。
在本研究中,将使用实验室分离的酿酒酵母(SC)、工业化酵母(BY4741)来替代纯酒药,并且按照工业化酿造工艺进行发酵实验,通过测定精氨酸和尿素浓度变化水平来分析不同酵母菌株在发酵体系中氮源代谢的差异;另外通过分析发酵结束煎酒后的成品中风味物质、氨基酸成分、酒精度和氨基甲酸乙酯浓度来探究不同酵母菌株对黄酒酿造品质的影响。
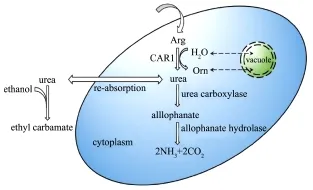
图1 精氨酸和尿素在酿酒酵母细胞中的代谢调控途径Fig.1 The metabolic regulation of arginine and urea in Saccharomyces cerevisiae cells
1 材料与方法
1.1 菌株及试剂
菌株:野生型酿酒酵母SC是由本实验室从浙江安吉乌毡帽黄酒酿造厂黄酒发酵体系中分离得到;BY4741购于自EUROSCARF(Frankfurt, Germany)。
发酵原料:酒药、熟麦曲,来自于浙江安吉乌毡帽黄酒酿造厂;糯米,来自于惠宜公司。
主要化学试剂:9-占吨醇、3-巯基丙酸(3-MPA)、邻苯二甲醛(OPA)、9-芴甲氧羰基氯甲酸酯(FMOC-Cl),购自 Sigma-Aldrich;硼酸、精氨酸、尿素、硫酸铵、乙酸钠等购自生工生物工程(上海)股份有限公司;醋酸、四氢呋喃、乙酸乙酯(分析纯)、乙腈(HPLC级别)、甲醇(HPLC级别)、盐酸等购自国药集团化学试剂有限公司。
1.2 培养基
YPD培养基:1%(W/V)酵母提取物,2%(W/V)蛋白胨,2%(W/V)葡萄糖。进行固体培养时,另加入2%(W/V)的琼脂。
1.3 实验方法
1.3.1 菌株培养
取保藏的酿酒酵母SC和BY4741,接种于YPD斜面培养基,28 ℃恒温活化培养24 h,再接种于20 mL YPD液体培养基,28 ℃恒温培养至OD600=0.4左右,转接至1 L的YPD培养基,于28 ℃,220 r/min摇床培养至OD600=0.8。离心后放置-80 ℃冰箱预冻12 h,后经真空冷冻干燥获得酵母菌体,并保存于4 ℃。
1.3.2 黄酒酿造及煎酒
以0.5 kg糯米为原料,于28 ℃下浸米2 d,控制料水质量比为 1:1.2。蒸饭后摊开冷却,使米饭的品温保持在30 ℃左右,加入90 g麦曲和1 g酒药及0.6 L水,搅拌均匀,并放置在 25 ℃恒温箱开始糖化作用,5 d后调节温度至18 ℃进行发酵作用,每隔10 d取样100 mL冻存于-80 ℃冰箱,发酵30 d后取样,煎酒,避光4 ℃保存。其中不同处理组酒药及酵母添加量如表1所示。

表1 不同分组酿造黄酒中添加的微生物Table 1 The designed fermentation microbial combinations that used in different groups of fermented Chinese rice wine
1.3.3 精氨酸浓度测定
柱前衍生:配制0.1 M、pH 9.9的硼酸缓冲液作为衍生缓冲液,将10 mg邻苯二甲醛(OPA)溶解于1 mL 0.02 M,pH 9.9的硼酸缓冲液中,并加入0.8%的巯基丙酸(3-MPA),用NaOH调节pH至9.3作为衍生试剂 1,配制 5 mg/mL的芴甲氧羰酰氯(FMOC-Cl)作为衍生试剂2,取1 mL发酵液上样,样品及衍生试剂均需经0.22 μm过滤器过滤。采用自动进样程序进样并进行柱前衍生。
流动相:A相称取0.8 g结晶乙酸钠于1000 mL烧杯中,加入1000 mL水搅拌至溶解,再加入225 μL三乙胺,加5%醋酸将pH 7.2,加入5 mL四氢呋喃,混合后备用。B相称取4 g乙酸钠,加入200 mL水搅拌至溶解,加醋酸钠调节pH 7.2,加400 mL乙腈和400 mL甲醇。
按照表2中洗脱梯度进行洗脱。

表2 HPLC测定精氨酸浓度时流动相比例及流速Table 2 The mobile phase for arginine determination by HPLC
1.3.4 尿素浓度测定
柱前衍生:分别配制终浓度为1.5 mol/L的盐酸和0.02 mol/L的9-羟基吨溶液作为衍生试剂,取1 mL发酵液作为样品,样品及衍生试剂均需经0.22 μm滤头进行过滤。
流动相:A相为0.02 M乙酸钠溶液,B相为乙腈。按照表2.3洗脱梯度进行洗脱。

表3 HPLC测定尿素浓度时流动相比例及流速Table 3 The mobile phase for urea determination by HPLC
1.3.5 氨基甲酸乙酯浓度测定
样品前处理:取50 mL黄酒样品与50 mL乙酸乙酯混合均匀并萃取氨基甲酸乙酯,将萃取后的液体置于真空旋转蒸发仪中进行浓缩,蒸干后用5 mL 30%甲醇溶解,样品中氨基甲酸乙酯浓度浓缩至原来样品的10倍。
柱前衍生:配制1.5 mol/L盐酸和0.01 mol/L占吨醇/正丙醇溶液备用,取1 mL标样或浓缩样品,加入0.1 mL盐酸和0.2 mL占吨醇溶液混合均匀,室温避光放置30 min,经0.22 μm滤头进行过滤,进样。
HPLC色谱条件:色谱柱为 C18反相柱(250 mm×4.6 mm,4 μm),进样量为20 μL,激发波长为233 nm,发射波长为600 nm,洗脱程序如表4所示。
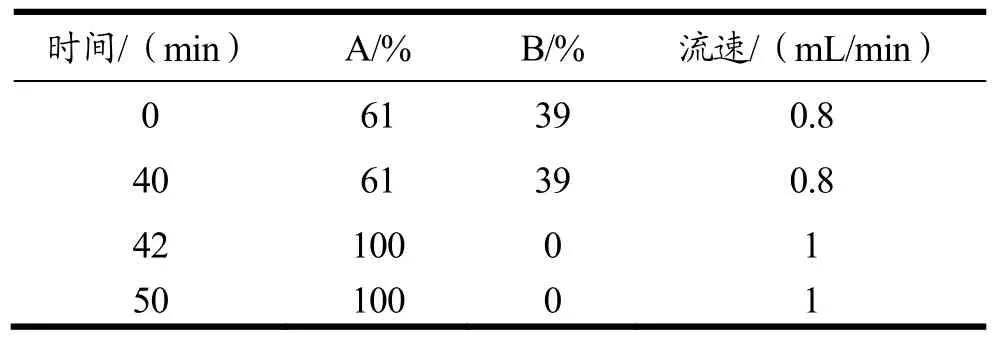
表4 HPLC测定氨基甲酸乙酯浓度时流动相比例及流速Table 4 The mobile phase for ethyl carbamate determination by HPLC
1.3.6 乙醇含量测定
根据国标GB/T 5009.48-2003中乙醇测定方法,取100 mL发酵黄酒于250 mL蒸馏器中,再加入50 mL水和数粒玻璃珠,蒸馏并用量筒收集馏出液至100 mL,将酒精计置于其中测定酒精度及温度,并将酒精度换算成20 ℃时候的乙醇浓度。
1.3.7 风味物质检测
萃取头准备:萃取头(SPME Fiber Assembly,50/30 μm,24 Ga,自动进样针)在第一次使用前,先在气相色谱口270 ℃条件下活化1 h,以后每次使用前活化30 min。
样品处理:将4 mL酒样和1g Nacl加入顶空瓶中,旋紧盖子并密封。加热至 50 ℃搅拌并充分吸附,将萃取头插入顶空瓶中50 ℃保持30 min。
GC-MS分析:色谱条件:载气为氦气,流速为1 mL/min,采用无分流进样;程序升温:初始柱温40 ℃,保持5 min,以5 ℃/mL的速率升温至230 ℃,保持10 min。进样口温度为250 ℃,GC解析时间2.5 min。
质谱条件:电子轰击离子源(EI)电子能量为70 eV,离子源温度为 200 ℃,接口温度为 250 ℃,检测口电压为 350 v。扫描方式为全扫描,质量范围为35~350。
1.3.8 游离氨基酸含量测定
对发酵30 d并煎酒后的4组发酵黄酒采用日本日立L-8900氨基酸分析仪进行游离氨基酸的检测(天门冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、胱氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、组氨酸、精氨酸),检测原理为采用茚三酮作为衍生剂与氨基酸发生衍生,经检测器进行检测分析。样品前处理方法为:精确量取10 mL样品,加0.1 mol/L盐酸溶液超声波振荡5 min,加5%磺酸水杨酸5 mL去除蛋白,在13000 r/min,4 ℃离心10 min,取上清液,氮吹仪浓缩赶酸,加0.02 mol/L盐酸2 mL,旋涡振荡,过0.22 μm孔径水膜,上机。
1.3.9 数据统计分析
每个实验重复3次。采用SPSS软件对数值进行差异显著性分析。采用Origin 8.0软件作图。
2 结果与分析
2.1 发酵过程中精氨酸变化水平
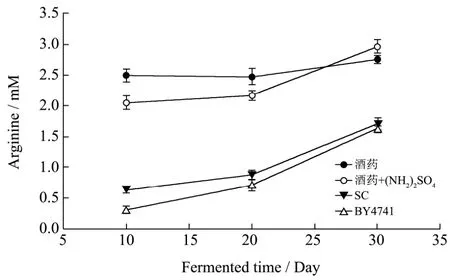
图2 不同微生物替代酒药进行发酵时发酵液中精氨酸浓度的测定Fig.2 The changing profiles of arginase concentration under different nitrogen conditions
不同酿酒酵母菌株替代酒药进行发酵时,发酵液中精氨酸浓度变化如图2所示。用麦曲和酒药进行发酵10 d左右,精氨酸保持较高浓度并在后续发酵过程中出现较缓慢的增长趋势,说明发酵初期微生物对原料的利用速率比较高;从图2中可以看出,发酵20 d后添加硫酸铵的实验组与对照组相比,精氨酸浓度开始有较快的增长,说明添加硫酸铵后酿酒酵母对精氨酸的利用速率降低。这主要是受氮代谢抑制的调控作用。
应用酿酒酵母SC及BY4741替代酒药进行发酵时,发酵液中精氨酸浓度变化水平差异不大,均保持较快的增长趋势。与酒药发酵组相比,SC及BY4741组发酵前期微生物对发酵原料的利用速率较慢,随着发酵过程的进行,微生物对原料的分解速率开始迅速提高。因此可以推测,酒药酿造黄酒前期,发酵环境中含有更多的霉菌及其它能够分解利用蛋白质的微生物;而随着发酵时间的延长,酿酒酵母发酵组中来源于麦曲的霉菌不断增殖,发酵液中精氨酸浓度迅速提高。不同发酵组中微生物对精氨酸的利用速率则需要结合尿素的水平作出判断。但是基于氮代谢抑制调控机制理论,在发酵后期酿酒酵母对精氨酸的利用速率应有较大提高。
2.2 发酵过程中尿素浓度变化水平

图3 不同微生物替代酒药进行发酵时发酵液中尿素浓度的测定Fig.3 The changing profiles of urea concentration under different nitrogen conditions
在酿造起始阶段,发酵液中的尿素主要来源于发酵原料,而在后续发酵过程中尿素的浓度变化趋势主要受到酿酒酵母对精氨酸的利用速率及对尿素降解速率的影响。如图3所示,当用酒药和麦曲进行发酵时,随着发酵时间的延长,发酵液中尿素的浓度增加速率提高;而添加硫酸铵的酒药发酵组中,发酵20 d后,发酵液中尿素的浓度呈明显的缓慢增长趋势,这说明添加硫酸铵后酿酒酵母对精氨酸的利用速率降低,该研究结果与2.1中添加硫酸铵后发酵液中精氨酸浓度变化趋势相一致。另外,当采用黄酒中分离的酿酒酵母SC与BY4741分别替代酒药进行发酵时,胞外尿素浓度变化趋势与酒药进行发酵时相比较呈现一致,这说明利用实验室来源的酿酒酵母进行发酵时,微生物对精氨酸和尿素的利用速率差异不大。
2.3 发酵过程中氨基甲酸乙酯变化水平
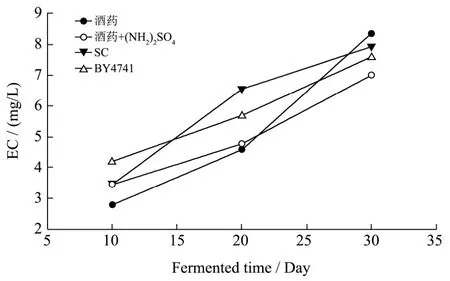
图4 不同氮源下酵母替代酒药酿造对发酵液中氨基甲酸乙酯浓度的影响Fig.4 The changing profiles of EC concentration under different nitrogen conditions
在黄酒发酵中氨基甲酸乙酯的浓度主要取决于发酵液中尿素和乙醇的浓度,如图4所示,不同酵母替代酒药进行发酵时,发酵液中氨基甲酸乙酯的浓度都随着发酵时间的延长不断升高,并且不同发酵组之间差异并不明显。其中在添加硫酸铵的发酵组中,虽然在发酵30 d左右,氨基甲酸乙酯的浓度较未添加硫酸铵的发酵组低(16%),但其差异不如尿素浓度变化明显(24%)。推测其原因可能是发酵开始时来源于原料部分的尿素相对于发酵30 d后形成的氨基甲酸乙酯含量已比较高,这对发酵过程中氨基甲酸乙酯的形成起主要作用,而发酵后期尿素浓度的提高,仅对氨基甲酸乙酯的形成起次要作用。
2.4 发酵产品中酒精度测定

表5 不同发酵微生物进行黄酒酿造时酒精度测定Table 5 The ethanol concentration under different nitrogen conditions
在黄酒酿造过程中,酒精度作为常规指标用来衡量发酵的进度。在本研究中,不同发酵组产品在20 ℃下酒精度均在10%~12%度左右,这比有些报道中黄酒酒精度偏低(4%~17%)[13],主要是因为发酵原料及发酵时间具有差异。不同发酵组酿造产品中酒精度接近,这为后续应用实验室菌株进行发酵试验提供依据。
2.5 发酵产品中风味物质组成及含量变化

图5 不同微生物替代酒药进行酿造时风味物质差异分析Fig.5 The profiles of flavor compounds under different nitrogen conditions
本研究采用固相微萃取结合气相色谱和质谱来检测挥发性物质,并采用相对定量的方式来分析不同挥发性成分的含量,其中含量最多的成分定量为 1,其它成分的含量为该成分与含量最高成分的峰面积比值。不同来源酿酒酵母替代酒药进行发酵时,产品中的风味物质组成如图5所示,其中不同发酵组中最主要的风味物质化学成分差异不大,而不同化学成分的含量具有一定差异,这说明在黄酒发酵过程中,麦曲主要决定风味物质组成,而酿酒酵母来源对各种风味物质的含量有一定的影响。
在黄酒体系中,主要的风味物质有酸、醛、醇和酯等[14]。在本研究中,各个发酵产品中检测出的主要风味物质包括乳酸、乙酸、异戊醇、苯乙醇和十六酸乙酯等。含量最高的风味物质均为乳酸,乳酸是黄酒中主要有机酸,能够缓冲调节酒味,并且在贮存过程中逐渐形成芳香酯。但过高含量的乳酸也是黄酒酸败的标志[15]。黄酒体系中的酯类物质是香气的主要来源,并且主要由酯化作用形成。
在该研究中,各发酵产品大部分风味物质与已有文献研究相一致[14、16]。另外也有部分风味物质的相关报道较少,如癸酸乙酯、十六酸乙酯等。根据黄酒中风味物质的分析,可以发现不同来源酿酒酵母发酵产品中风味物质差异性不大,因此本研究认为可以采用这两种来源的酿酒酵母进行后续实验。
2.6 发酵黄酒中氨基酸组成及含量差异分析
黄酒中氨基酸除了能够为人体提供各种必需氨基酸外,还是黄酒风味物质的重要组成部分,不同氨基酸口味不同,氨基酸含量的差异会影响黄酒的口感及风味[17]。在本研究中,我们采用氨基酸分析仪来检测发酵产品中16种游离氨基酸含量,如图6所示。首先我们对各个发酵产品中不同氨基酸含量进行分析,含量最高均为精氨酸,浓度分别为 399.98 mg/L、408.32 mg/L、401.32 mg/L、395.32 mg/L;其次为丙氨酸和脯氨酸。在该研究中检测结果与已有报道一致,即发酵原料中含有高浓度的精氨酸,在发酵后期较好的铵态氮源消耗完条件下,精氨酸成为主要氮源来源[18]。从图6中还可以看出,不同发酵组产品中各种氨基酸含量差异不大,说明黄酒中氨基酸组成及含量主要受发酵原料和麦曲中的微生物影响。

图6 不同微生物替代酒药进行发酵时游离氨基酸差异分析Fig.6 The profiles of amino acids after 30 days fermentation under different nitrogen conditions
3 结论
黄酒作为传统酿造饮品,风味独特,含有多种营养物质,深受人们喜爱。应用酿酒酵母BY4741和SC替代酒药进行黄酒酿造试验,发酵液中精氨酸、尿素和氨基甲酸乙酯的浓度差异不大。酿造前期微生物对发酵原料的利用率较低,添加硫酸铵可抑制酵母细胞对精氨酸的利用,有利于降低发酵体系中尿素的积累,符合氮代谢抑制调控机制,因而可在一定水平上降低黄酒中氨基甲酸乙酯的浓度。不同发酵组中酒精度、风味物质组成、氨基酸组成差异不大,这意味着酿酒酵母BY4741和SC替代酒药进行酿造以及在酿造过程中添加硫酸铵不影响黄酒的品质。本研究认为在后续的氨基甲酸乙酯氮代谢基础研究中,可以应用实验室酿酒酵母替代酒药在模拟体系中探索氨基甲酸乙酯形成的调控因子,进而应用于黄酒的酿造生产中,降低黄酒中致癌物质的含量,具有广阔的市场前景和较好的潜在价值。

