天然低共熔溶剂对绿色荧光蛋白的保护作用
李菲,王永华,蓝东明
(华南理工大学食品科学与工程学院,广东广州 510640)
传统的有毒有害的有机溶剂不符合绿色环保的理念,而溶剂在食品以及生物催化领域具有非常重要的作用,所以人们对于新型的绿色溶剂的需求日益迫切。离子液体(ILs)是近年发展起来应用于生物催化的“绿色”溶剂[1]。离子液体(ILs)具有独特的性质,包括不可挥发性、良好的稳定性以及不可燃性等。但目前由季铵盐(如氯化胆碱和甜菜碱)和氢键供体(hydrogen bond donor,HBD)(如糖、多元醇和有机酸)形成的混合物即低共熔溶剂 DES(deep eutectic solvent,DES)有望代替“离子液体”[2]。因为DES不仅具有离子液体的优点,同时还兼具成本低、易制备、高度生物降解性以及生物相容性等特点,更符合“绿色化学”的理念[3,4]。DES一个显著的特点是,其熔点通常低于组成DES的任何单一组分的熔点,这与DES体系中季铵盐的阴离子和氢键供体之间形成的氢键作用有关[5,6]。
天然低共熔溶剂(natural deep eutectic solvent,NADES)是指由生物体内的有机小分子如胆碱衍生物、醇类、糖类以及尿素等物质所形成的溶剂,这些小分子在微生物和动植物细胞中大量存在[7]。NADES因其环保、无毒及生物相容性好的特性,广泛应用于天然活性成分的分离萃取。Dai等[8]人发现红花中的酚类物质在天然低共熔溶剂中具有良好的萃取效果,萃取率在75%~97%。Huang等[9]人研究发现以氯化胆碱为氢键供体合成的天然低共熔溶剂和皂苷协同作用可以高效去除水稻中的镉,镉在人体内累积会损害肾脏。另外,生物催化剂在低共熔溶剂中具有高效的催化表现。Xu等[10]人利用Novozyme 435在天然低共熔溶剂中催化合成富含n-3 PUFA的甘油三酯的产率是无溶剂体系下的1.2倍,认为以低共熔溶剂作为溶剂是提高合成富含n-3 PUFA的甘油三酯的有效途径。天然低共熔溶剂不仅能够提高酶的催化效率,还可以提高酶蛋白的稳定性,延长其使用寿命[11]。
目前报道的NADES类型繁多,但仍缺乏可高效筛选对生物大分子具有保护作用的低共熔体系的方法。绿色荧光蛋白(green flurescent protein,GFP),最初从水母体内发现,其荧光活性与结构的变化具有相关性,可以作为筛选蛋白保护剂有效的探针蛋白。本文以GFP作为模式蛋白,通过研究GFP在不同类型的NADES中稳定性,筛选其中能够稳定蛋白质构象的 NADES,为天然活性物质的提取和生物催化应用提供合适的溶剂。
1 材料与方法
1.1 材料
大肠杆菌BL21用作绿色荧光蛋白(GFP)的表达宿主菌。甜菜碱,氯化胆碱,尿素,甘油,山梨醇和木糖醇购自阿拉丁化学有限公司(中国上海)。所有其他试剂均为分析级。
1.2 主要仪器
Cytation™ 5酶标仪,美国BioTek公司;R-3旋转蒸发仪,瑞士步琦有限公司;超纯水使用 Milli-Q过滤系统(UNIQUE-R20)获得。
1.3 方法
1.3.1 GFP的表达与纯化
将重组质粒pET23a-CBD-GFP分别转化到表达菌株BL21(DE3),涂布Amp抗性的LB平板,过夜长出单克隆。每次从平板挑取单克隆于5 mL LB培养基过夜培养12 h,接种于400 mL LB培养基,接种量为1%。待菌液OD600为0.8左右,降温至20 ℃加终浓度为0.1 mM的IPTG诱导,诱导时间为20 h。经过诱导表达后,用冷冻离心机离心(10000 r/min,15 min)发酵液收集菌体,用PBS缓冲液(20 mM,pH 7.4)重悬菌体,超声破碎后离心(10000 r/min,25 min)收集上清液,加入磷酸处理过的纤维素吸附CBD-GFP融合蛋白。再用3C蛋白酶消化处理CBD-GFP融合蛋白后,离心(10000 r/min,25 min)分离出GFP蛋白。通过SDS-PAGE电泳检测GFP的纯度,并利用BCA蛋白浓度测定试剂盒(上海生物生工公司)测定蛋白质浓度。
1.3.2 低共熔溶剂的制备
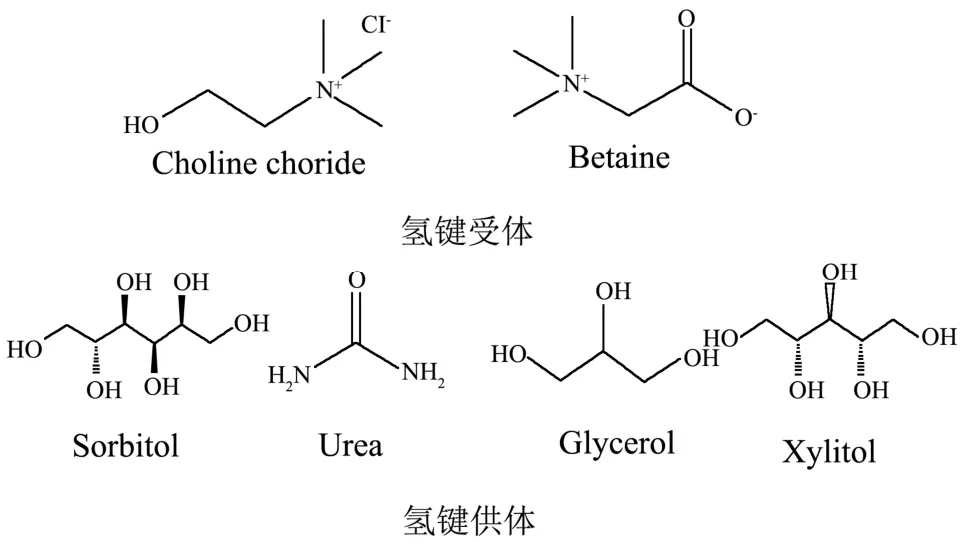
图1 天然低共熔溶剂组分的结构Fig.1 Structure of NADES component
按照一定摩尔比例称取氯化胆碱、甜菜碱和氢键供体(甘油、尿素、木糖醇和山梨醇)制备天然低共熔溶剂,如表1和图1所示。两种固体混合物置于旋转蒸发仪在80 ℃溶解0.5~4 h,直至变成透明的液体。制备好的NADES在室温冷却后保存在密封容器,存放在干燥器中。
Table 1 Natural deep eutectic solvent used in the experiment
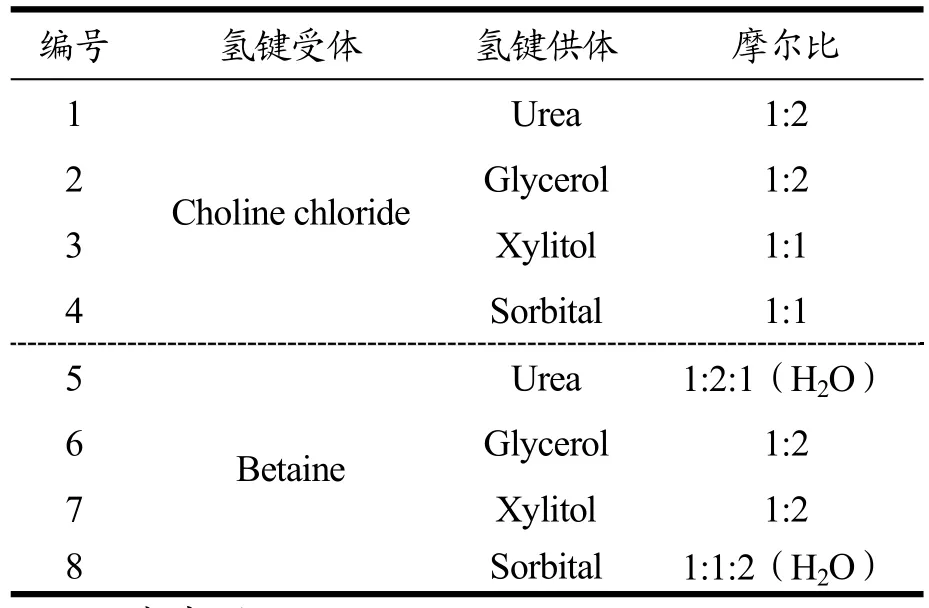
表1 实验所用的天然低共熔溶剂
1.3.3 荧光检测
利用酶标仪测定GFP的荧光发射光谱(激发波长设定在474 nm)。GFP在不同NADES中于70 ℃孵育10 min,每隔2.5 min取样(200 μL)。为了监测热失活 GFP的重折叠,将孵育后取的样品在室温下放置15 min,每10 s检测样品中GFP荧光变化。以初始的荧光强度为100%。
1.3.4 差示扫描量热法(DSC)分析
DSC分析采用差示扫描量热仪(NETZSCH DSC 204 F1,德国)。将34 mM的GFP分别溶解于纯水、氯化胆碱溶液、山梨醇溶液以及氯化胆碱-山梨醇天然低共熔溶剂后置于铝盘,放入差示扫描量热仪中,以10 ℃/min的速率从30 ℃升温到90 ℃,确定GFP在不同溶剂中的熔点Tm。
1.3.5 脂肪酶活力检测
将实验室自制的脂肪酶 AOL酶粉溶解于含水量为40%的CS天然低共熔溶剂中置于45 ℃条件孵育2 h,每隔30 min取样,在35 ℃和磷酸盐(20 mM,pH 7)作为缓冲液条件下,以对硝基苯酚辛酸酯为底物,测定脂肪酶AOL的残留活力。
1.3.6 数据统计分析
用Origin 8.5软件作图并用SPSS 9.0进行统计学分析。
2 结果与讨论
2.1 不同NADES对GFP热稳定性的影响
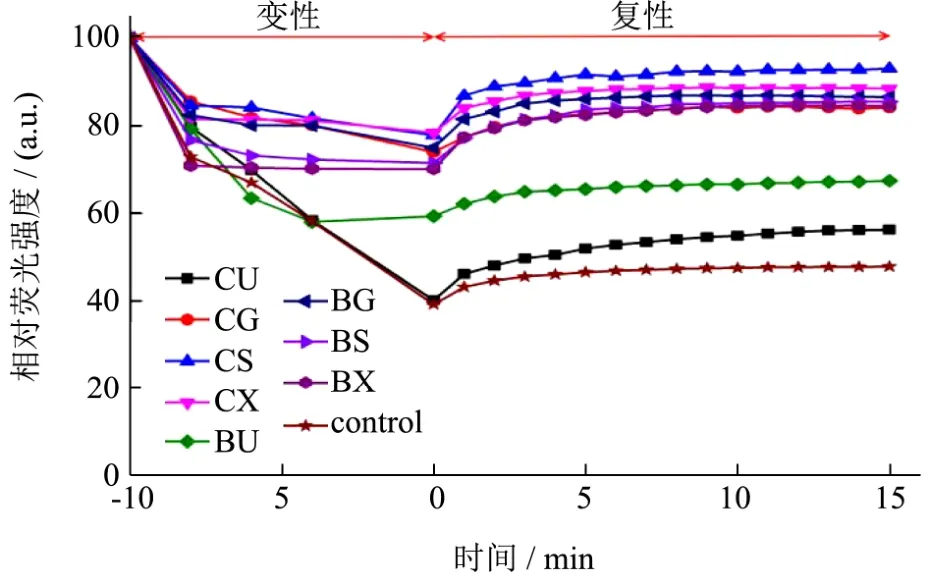
图2 GFP在不同天然低共熔溶剂中的热变性和复性Fig.2 Thermal denaturation and renaturation of GFP in various NADES
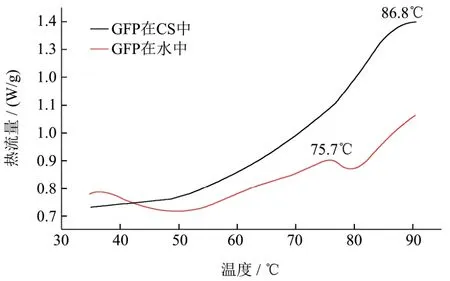
图3 GFP在水中和在CS天然低共熔溶剂中的DSC图谱Fig.3 DSC spectra of GFP in water and CS NADES
胆碱类如甜菜碱,糖类如海藻糖,以及醇类如山梨醇、甘油和木糖醇都是常见的冻干保护剂,已经被证明对生物体内的蛋白质具有较好的稳定作用,所以被选择作为天然低共熔溶剂的组分[12]。GFP的荧光与其结构折叠存在相关性,通过检测 GFP在不同NADES中的荧光强度来反映其构象的变化,揭示不同NADES对GFP热稳定性的影响规律。结果如图2所示,不含NADES的GFP经过70 ℃孵育后残留的相对荧光强度为47%。氯化胆碱-甘油(CG)、氯化胆碱-木糖醇(CX)、甜菜碱-甘油(BG)、甜菜碱-山梨醇(BS)和甜菜碱-木糖醇(BX)这五种低共熔溶剂下的GFP残留的相对荧光强度为84%~88%。氯化胆碱-山梨醇(CS)对GFP的保护作用最好,GFP残留的相对荧光强度为93%。含尿素的NADES对GFP的保护作用相对较差,GFP的残留的相对荧光强度为60%。推测是在高温环境下,DES中的尿素分子游离出NADES的氢键网络,进而夺取GPF结构中的水分子,影响GFP结构导致其荧光强度减弱。Wu等人研究了辣根过氧化物酶分别在 24种低共熔溶剂中的酶活变化,发现辣根过氧化物酶都能较好的保持其活力
[13]。
将经过高温孵育后的样品放置在室温,继续检测GFP的荧光强度变化,研究 GFP结构在缓冲液和NADES中的重折叠现象。由图2中的复性过程可知,GFP的结构在NADES和缓冲液中均可发生一定程度的重折叠过程,但是两者的效率没有明显的差异。
DSC通常用作研究蛋白质大分子热力学性质。为了进一步证明CS是否可以增强GFP的耐热性,利用DSC方法分别测定GFP在CS天然低共熔溶剂和水中的Tm值。Tm值反映了蛋白质发生聚集时的温度,此时蛋白质的结构会发生转变,所以蛋白质的热稳定性的提高与Tm的增加是密切相关的[14]。结果如图3所示,GFP在CS天然低共熔溶剂中的Tm比在水中的Tm高11 ℃,证实了CS天然低共熔溶剂有利于提高蛋白质热稳定性。Xin等人发现溶菌酶在含水量为50%的氯化胆碱-海藻糖天然低共熔溶剂中的Tm比水中提高了10.4 ℃[15]。
2.2 NADES含水量对GFP稳定性的影响
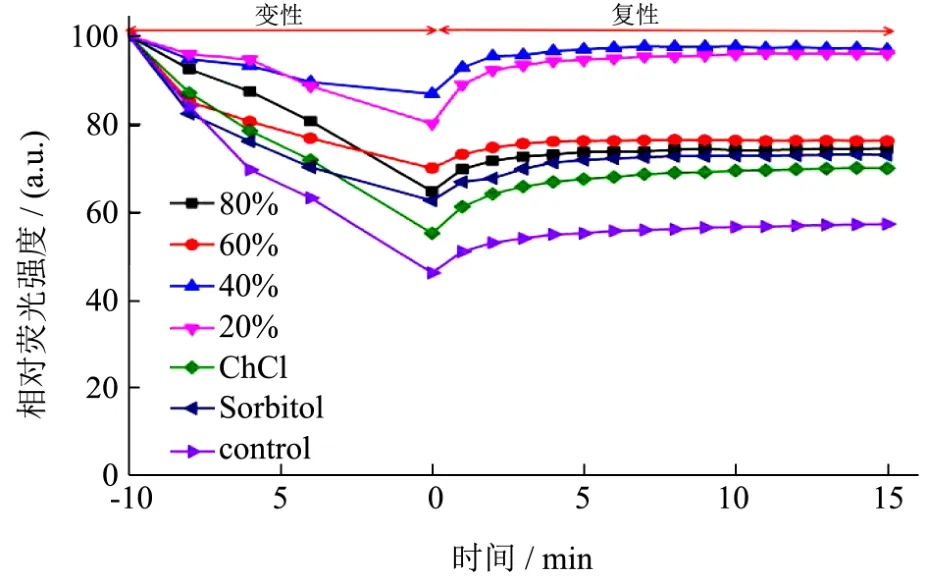
图4 不同含水量的CS天然低共熔溶剂以及其单组份对GFP热稳定性的影响Fig.4 Effect of CS NADES with various water content and single NADES components on GFP thermal stability
水分对NADES中的氢键的有一定的影响,因为水分子会削弱 DES组分之间的相互作用从而破坏NADES的氢键网络[15,16]。考察GFP在含水量为0%、20%、40%、60%、80%的CS低共熔溶剂以及单组份ChCl和Sorbitol中的热稳定性。如图4所示,GFP在含水量为20%和40%的CS天然低共熔溶剂中,70 ℃孵育10 min后的残留的相对荧光强度都在90%左右,而在含水量为60%和80%的相同处理条件下残留的相对荧光强度为64%和70%。
进一步探究低共熔溶剂单组份是否对蛋白质稳定性具有类似的保护作用的影响,研究了GFP在与40%含水量的CS低共熔溶剂相同浓度的单组份氯化胆碱和山梨醇溶液中的热失活现象。由图4可知,在70 ℃孵育10 min后,GFP在单组份氯化胆碱和山梨醇溶液中的残留相对荧光强度分别为55%和62%,高于对照组即在缓冲液中的残留相对荧光强度,同时低于在含水量为40%的CS天然低共熔溶剂中的残留相对荧光强度。
2.3 NADES对GFP耐受SDS和H2O2的影响
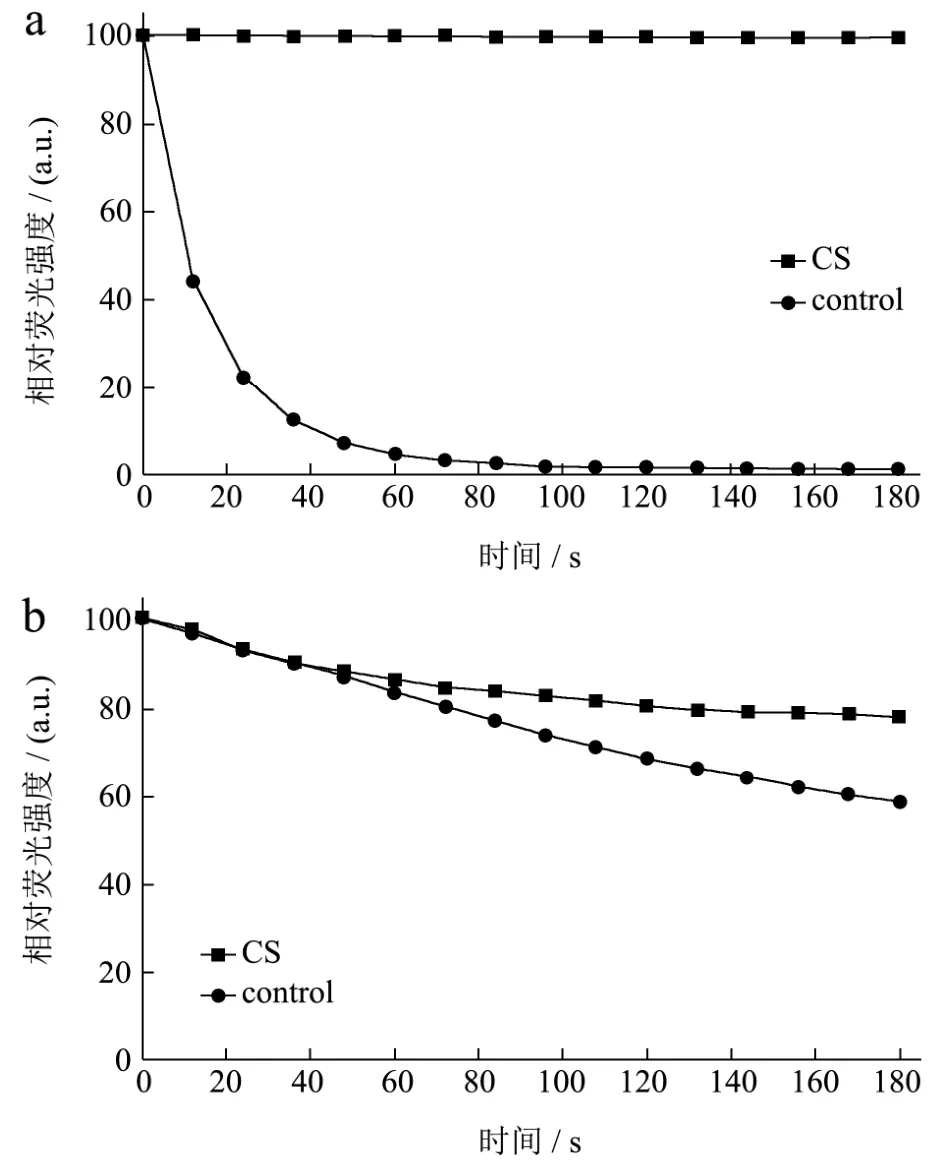
图5 SDS(a)和H2O2(b)对于CS天然低共熔溶剂中的GFP稳定性的影响Fig.5 Effects of SDS(a) and H2O2(b) on the GFP stabilization in presence of CS NADES
除了温度,化学试剂如金属离子、有机溶剂、氧化物以及表面活性剂对于蛋白质稳定性有也影响。为了探究CS低共熔溶剂是否对蛋白质耐受化学物质的能力有影响,测定了再加入SDS和H2O2后,在含水量为40%的CS低共熔溶剂中的GFP的荧光变化,对照组为在不加NADES的缓冲液中的GFP。图5(a)和(b)所示,在1%的SDS中孵育3 min后,GFP的荧光强度没有发生降低,而对照组中的GFP的荧光强度在2 min内完全丧失,表明CS天然低共熔溶剂具有增强GFP耐受SDS的能力。加入浓度为0.97 M的H2O2的3 min后,在CS低共熔溶剂的GFP残留原始荧光强度的80%,对照组残留原始荧光强度的60%,表明在CS天然低共熔溶剂中的GFP耐受H2O2的能力没有很明显的提升。
2.4 NADES对脂肪酶AOL热稳定性的影响
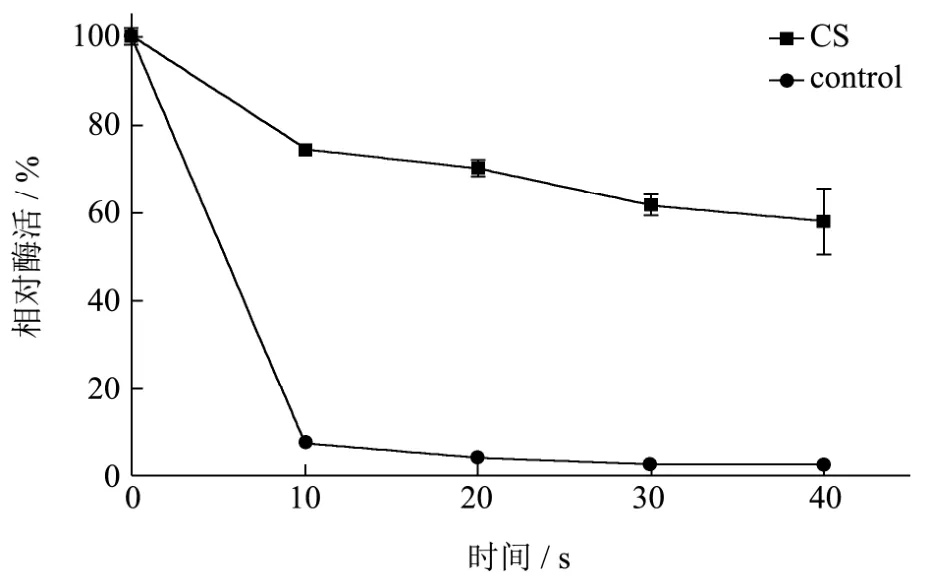
图6 在CS天然低共熔溶剂中的脂肪酶AOL在45 ℃下的热稳定性Fig.6 Incubation of AOL at 45 ℃ in the presence of CS NADES
CS天然低共熔溶剂对GFP具有保护作用,但对于其他蛋白质特别是酶蛋白是否具有相同的保护效果值得深入探究。脂肪酶是工业生物技术领域应用最为广泛的酶制剂,因此选择来源于米曲霉的脂肪酶AOL作为模式酶,探究其在CS天然低共熔溶剂热稳定性情况。结果如图6所示,在45 ℃孵育40 min后,CS天然低共熔溶剂中的脂肪酶AOL残留活力为60%,而不加低共熔溶剂的脂肪酶AOL的活力在10 min内丧失90%,所以CS天然低共熔溶剂同样对脂肪酶具有保护作用,能够提高脂肪酶的热稳定性,有利于脂肪酶AOL应用于生物催化反应。
3 结论
本文以 GFP为模式蛋白,研究了其在不同NADES中的热稳定性,发现了CS天然低共熔溶剂对GFP具有良好的保护作用,且CS天然低共熔溶剂的含水量会对 GFP热稳定性的影响,含水量为 40%的CS天然低共熔溶剂稳定蛋白质的效果最好。同时CS天然低共熔溶剂可以提高GFP对SDS的耐受性,对H2O2的耐受性影响不大,同时对脂肪酶AOL具有稳定作用。所以CS天然低共熔溶剂不仅对蛋白质具有保护作用,同时对于细胞系的生长没有明显毒副作用,在食品加工及生物催化领域将有广泛的应用前景。

