天然抑菌剂对鲁氏接合酵母的抑菌作用
王璇,胡仲秋,袁亚宏,任婷婷,岳田利
(西北农林科技大学食品科学与工程学院,农业部农产品质量安全风险评估实验室(杨凌),国家杨凌农业综合试验工程技术研究中心,陕西杨凌 712100)
很多食品中都含有水分,但水分多有利于大多微生物的生长从而导致食品腐败变质[1]。研究表明,溶液渗透压是食品货架期的主要影响参数[1]。许多食品为了延长其保质期,会适量增加食品中糖或盐的浓度如蜂蜜、糖浆、酱油和浓缩苹果汁等[2]。高渗透压的食品可以抑制大多数微生物的生长,但是有些微生物如耐高渗酵母菌能在高糖和高盐浓度下生长。
鲁氏接合酵母是一种耐高渗酵母,也是一种重要的食品腐败菌,由于它具有耐酸、耐高渗、耐弱酸抑菌剂和适应高渗环境及高温的特性,能够引起低 pH值、高糖的食品变质[3~5]。据报道有从浓缩苹果汁(糖度70 °Brix,pH值3.5)中分离出鲁氏接合酵母菌并可在浓缩苹果汁中生长繁殖[6],导致胀罐、果汁营养成分的损失与破坏、糖度和pH的改变,影响人类的身体健康。因此,控制浓缩苹果汁中鲁氏接合酵母的生长是果汁加工企业亟待解决的问题[7]。
为延长浓缩苹果汁的保藏期限,传统的方法是向果汁中添加抑菌剂来抑制果汁中微生物的生长从而起到延长果汁贮藏期的目的,这也是一种方便有效的控制微生物生长的方法。目前世界上食品工业中常用的抑菌剂以化学合成抑菌剂居多,在欧洲国家山梨酸以及苯甲酸是被允许添加到食品中的抑菌剂,但是对被添加食品以及添加量有着严格的规定[8,9]。Arroyo-Lopez等人与Rojo等人曾报道山梨酸钾和苯甲酸钠均可有效抑制橄榄油及浓缩葡萄汁中鲁氏接合酵母的生长[10],但山梨酸钾是一种低毒性化学抑菌剂,苯甲酸钠可在人体肠道的酸环境下转化为毒性较强的苯甲酸,会导致体重下降、腹泻、出血、瘫痪甚至死亡[11]。化学合成抑菌剂因其具有诱癌性、致畸性和易引起食物中毒等问题无法解决,且对人体的健康带来一定的负面影响,这与人们追求安全、健康饮食方式的愿望相违背[12],因此人们开始寻求广谱、高效、低毒的天然食品抑菌剂[13]。在过去的二十年间,科研人员对来源于动物、植物及微生物的天然抑菌物质进行了广泛研究,以期它们能够替代传统化学抑菌剂有效抑制微生物对食品的污染[14~16]。天然抑菌剂具有抗菌性强、安全无毒、水溶性好、热稳定性好和作用范围广等合成抑菌剂无法比拟的优点[17]。按照其来源可分为微生物源抑菌剂、动物源抑菌剂和植物源抑菌剂[18]。香草醛和羟基肉桂酸被报道能够有效抑制包括真菌和细菌在内的大部分微生物的生长,在有效抑制高渗酵母污染领域有着潜在的应用价值[19~22]。纳他霉素是由纳塔尔链霉菌产生的一种多烯大环内脂类抗生素[23],是一种常用的抗真菌剂,其抗真菌广谱[24],广泛应用于食用奶酪表面涂层防止霉菌的生长和污染[25~27],在食品工业用来防止霉菌和酵母菌的污染[28]。ε-聚赖氨酸(ε-PL)是一种由25-30的赖氨酸残基与3-氨基和羧基功能之间的酰胺键的 HOMO阳离子聚酰胺的多聚赖氨酸[29,30]。这种肽最初是从一个白色链霉菌株inopolymerus分离出来的[29]。ε-聚赖氨酸抗菌广谱,对革兰氏阳性细菌、革兰氏阴性细菌、酵母菌和霉菌都有抗菌作用[31]。但天然抑菌剂活性成分复杂,抑菌机制尚不完全明确[32],其对鲁氏接合酵母的抑菌作用研究还处在雏形阶段。
本研究从浓缩苹果汁(糖度 70 °Brix,pH 值 3.5)中分离得到的鲁氏接合酵母为研究对象,通过牛津杯抑菌圈法研究植物源、动物源以及微生物源天然抑菌剂对鲁氏接合酵母的抑菌活性,通过二倍稀释法测定天然抑菌剂的MIC,筛选出对鲁氏接合酵母抑菌效果较好的两种天然、无色无味的食品级抑菌剂,并通过比色法测定添加这两种抑菌剂后鲁氏接合酵母的生长曲线,比较这两种抑菌剂单一和复配协同抑菌效果,在不同处理条件下对抑菌剂进行处理,观察其抑菌效果的稳定性,为天然抑菌剂延长浓缩苹果汁的贮藏期提供了一个合理的解决途径。
1 材料与方法
1.1 材料与试剂
酵母菌种:鲁氏接合酵母 1130(Zygosaccharomyces rouxii),由西北农林科技大学食品科学与工程学院健康食品制造与安全控制工程实验室提供。
浓缩苹果汁(糖度70 °Brix,pH值3.5)购买于陕西果汁加工厂。12 °Brix苹果汁:浓缩苹果汁与去离子水按约1.0:7.2比例混合,搅拌均匀。
YPD半固体培养基:蛋白胨,酵母浸粉,葡萄糖,琼脂,蒸馏水。
植物源抑菌剂:薰衣草油、甘松精油、桂油、迷迭香精油、黄荆精油、桉叶精油、阿魏酸、胡椒醇、丁香油、牛至油、香茅油、山苍子油。
动物源抑菌剂:壳聚糖、鱼精蛋白、乳铁蛋白、溶菌酶、葡聚糖。
微生物源抑菌剂:ε-聚赖氨酸、纳他霉素、苯乳酸。
以上天然抑菌剂均由上海源叶生物科技有限公司提供,其中精油纯度均为99%,阿魏酸、胡椒醇、壳聚糖、鱼精蛋白、乳铁蛋白、溶菌酶、葡聚糖、ε-聚赖氨酸、纳他霉素、苯乳酸均为分析标准品,纯度均为98%。
1.2 仪器与设备
ZXSD-A1160型生化培养箱;YXQ-LS-70A 型立式压力蒸汽灭菌器;UV-1700紫外可见分光光度计;YT-CJ-2ND型超净工作台;ZWY-240恒温培养振荡器;DK-98IIA型电热恒温水浴锅;涡旋振荡器;HC-3018R高速冷冻离心机。
1.3 试验方法
1.3.1 抑菌剂的筛查
1.3.1.1 抑菌剂前处理
将抑菌剂溶解配成溶液,用0.22 µm孔径无菌滤膜进行过滤除菌待用[33]。
1.3.1.2 菌种的活化
将保存在甘油管中的鲁氏接合酵母 1130(Zygosaccharomyces rouxii)自然条件下解冻后,置于灭菌后的YPD培养基中进行活化,于28 ℃,120 r/min摇床中培养24 h。取第一代活化的种子液以2%的接种量接种于无菌YPD液体培养基中,28 ℃,120 r/min摇床中进行培养,待菌液浓度达到108CFU/mL后,作为种子液待用[34]。
1.3.1.3 抑菌活性的测定(牛津杯抑菌圈法)
配制固体琼脂和半固体营养琼脂培养基,高压蒸汽121 ℃,15 min灭菌,在培养皿上倒入薄薄的一层固体琼脂,待固体琼脂凝固后,用无菌镊子将外直径为8 mm的牛津杯垂直放在琼脂平面上[35],待无菌半固体营养琼脂培养基温度降为50 ℃左右,将二代活化好的菌液(菌浓度约108CFU/mL)用移液枪吸取2%至半固体营养琼脂培养基中缓慢摇匀(避免产生气泡)后倒入琼脂平面上,待半固体营养琼脂培养基凝固后拔出牛津杯,此时半固体培养基中会形成和牛津杯直径大小一样的孔洞。用移液枪吸取100 µL抑菌剂至孔洞中,放入28 ℃培养箱中恒温培养48 h后用游标卡尺测量其抑菌圈直径,通过比较抑菌圈直径来比较抑菌效果。其中精油和吐温80以1:1的比例混合,其余抑菌剂均配制成浓度为10 mg/mL的溶液。每组试验重复3次,取其平均值。
1.3.1.4 最小抑菌浓度的测定(二倍稀释法)[36]
将抑菌剂用蒸馏水通过二倍稀释法稀释成5个梯度并进行无菌滤膜除菌。配制半固体营养琼脂培养基,121 ℃,15 min高压蒸汽灭菌,待培养基温度降为50 ℃左右,用移液枪吸取2%的抑菌剂加入培养基中混匀并倒平板待凝固形成药平板后,将活化好的二代种子液(菌液浓度约为108CFU/mL),无菌蒸馏水稀释10倍,用移液枪吸取100 µL至药平板并用刮铲涂刮均匀,放入28 ℃恒温培养箱培养48 h,观察长菌情况。凡是最高稀释平板中无菌落形成者,即为该物质的MIC。相同条件下,MIC越小,抑菌活性越大。其中精油和吐温80以1:1的比例混合,其余抑菌剂均配制成浓度为10 mg/mL的溶液。每组试验重复3次,取其平均值。
1.3.2 不同基质下鲁氏接合酵母生长曲线的测定
苹果汁中的成分与 YPD培养基中的成分有所差别,其对酵母菌的生长影响也会有差别。将浓缩苹果汁(糖度 70 °Brix,pH 值 3.5)稀释成糖度为 12 °Brix,pH为3.8的普通苹果汁,105 ℃,15 min进行高压蒸汽灭菌,YPD培养基121 ℃,15 min进行高压蒸汽灭菌,将二代活化好的鲁氏接合酵母接入 YPD培养基中,涡旋振荡器震荡均匀,离心(10000 r/min,10 min)去上清液,并用已灭菌的果汁洗菌离心(10000 r/min,10 min)三次,接入果汁中使果汁中菌液浓度为 106CFU/mL,120 r/min,28 ℃摇床培养90 h,用分光光度计测量在600 nm波长下菌悬液的吸光值[37],每5 h取一次样测定果汁的OD值,并绘制其生长曲线,吸光值越大,说明微生物的浓度越大,生长越快[38]。每组试验重复3次,取其平均值。
1.3.3 协同抑菌效果的测定(紫外分光光度值法)[39]
因精油有刺激性气味,有些精油还具有颜色,在果汁中不宜添加,因此从其余抑菌剂中通过比较MIC以及结合成本考虑,筛选出抑菌效果较好的两种无色无味水溶性天然食品级抑菌剂纳他霉素和 ε-聚赖氨酸,用超纯水配制pH为3.8的柠檬酸溶液,将纳他霉素和ε-聚赖氨酸分别溶解在柠檬酸溶液中配制成浓度均为10 mg/mL的溶液,通过文献查阅将纳他霉素与ε-聚赖氨酸的复配比设为7:3、5:5、3:7混合制成1 mg/mL的复合溶液[10],并进行无菌滤膜除菌。将浓缩苹果汁(糖度 70 °Brix,pH 值 3.5)稀释为糖度为 12 °Brix,pH为3.8的普通苹果汁,105 ℃,15 min进行高压蒸汽灭菌,静置待温度降为室温,将纳他霉素、ε-聚赖氨酸以及复配抑菌剂以不同的量接入果汁中。将二代活化好的酵母菌离心(10000 r/min,10 min)[34]去上清液,并用已灭菌的果汁洗菌离心(10000 r/min,10 min)三次,接入果汁中使果汁中菌液浓度为106CFU/mL,120 r/min,28 ℃摇床培养5 d,每6 h取一次样测果汁的OD值,并绘制其生长曲线,OD值前后差距最小者抑菌效果最好。每组试验重复3次,取其平均值。
1.3.4 不同处理条件下复合抑菌剂的抑菌稳定性比较
1.3.4.1 柠檬酸浓度对复合抑菌剂抑菌稳定性的影响
用去离子水配制不同浓度梯度的柠檬酸溶液作为溶剂,浓度分别为0.1%、0.2%、0.4%、0.8%、1.6%,加入抑菌剂使其浓度为10 mg/mL并进行无菌滤膜除菌。牛津杯抑菌圈法[35]测定不同柠檬酸浓度下抑菌剂的抑菌效果。每组试验重复3次,取其平均值。
1.3.4.2 温度对复合抑菌剂抑菌稳定性的影响
用去离子水配制溶剂,用柠檬酸调节其pH为3.8,加入抑菌剂并进行无菌滤膜除菌。将抑菌剂放置不同温度的水浴锅中加热 10 min,温度分别为:20 ℃、40 ℃、60 ℃、80 ℃、100 ℃,处理完毕后牛津杯抑菌圈法[32]测定不同温度处理条件下抑菌剂的抑菌效果。每组试验重复3次,取其平均值。
1.3.4.3 紫外照射时间对复合抑菌剂抑菌稳定性的影响
用去离子水配制溶剂,用柠檬酸调节其pH为3.8,加入抑菌剂并进行无菌滤膜除菌。将抑菌剂放置在离波长为260 nm的紫外灯1 m的直线距离下照射,分别照射0 min、15 min、30 min、45 min、60 min取出抑菌剂,牛津杯抑菌圈法测定不同紫外照射时间处理条件下抑菌剂的抑菌效果。每组试验重复3次,取其平均值。
1.3.5 数据统计分析
2 结果与讨论
2.1 天然抑菌剂的抑菌活性测定
20种天然抑菌剂用牛津杯抑菌圈法,比较其抑菌圈直径,结果见表1、表2、表3、图1、图2和图3。由表1可知,单宁、茶多酚和竹叶精油对鲁氏接合酵母没有抑菌作用,其余均对鲁氏接合酵母有抑菌作用,抑菌效果最好的是黄荆精油,抑菌效果最差的是胡椒醇,精油对鲁氏接合酵母的抑菌效果要比多酚和醇类的抑菌效果稍好一些。由表2可知,动物源抑菌剂对鲁氏接合酵母有抑菌作用的种类比较少,笔者选取 5种动物源抑菌剂对鲁氏接合酵母进行抑菌试验,其中乳铁蛋白、溶菌酶和葡聚糖酶对鲁氏接合酵母没有抑菌作用,壳聚糖和鱼精蛋白对鲁氏接合酵母有抑菌作用,壳聚糖的抑菌效果较差,鱼精蛋白的抑菌效果较好。由表3可知,微生物源抑菌剂对鲁氏接合酵母的抑菌效果比植物源和动物源抑菌剂效果好。由图 1、图2和图3可知,添加相同浓度相同量的抑菌剂至孔中,纳他霉素的抑菌圈要大于ε-聚赖氨酸,向孔洞中添加对照组柠檬酸并未有抑菌圈形成,表明纳他霉素对鲁氏接合酵母的抑菌效果要好于ε-聚赖氨酸,溶剂柠檬酸对鲁氏接合酵母没有抑菌作用。

图1 添加纳他霉素后抑菌圈大小Fig.1 The size of bacteriostasis after adding namamycin

图2 添加ε-聚赖氨酸后抑菌圈大小Fig.2 The size of bacteriostasis after adding ε-polylysine

图3 添加柠檬酸后抑菌圈大小Fig.3 The size of bacteriostasis after adding citric acid

表1 不同植物源抑菌剂的抑菌活性Table 1 The antibacterial activity of different botanical antibacterial agents

表2 不同动物源抑菌剂的抑菌活性Table 2 The antibacterial activity of different animal antibacterial agents

表3 不同微生物源抑菌剂的抑菌活性Table 3 The antibacterial activity of different microbial antibacterial agents
2.2 天然抑菌剂最小抑菌浓度的测定
由表4可知,在植物源抑菌剂中,阿魏酸比胡椒醇的抑菌效果好。精油对鲁氏接合酵母的抑菌效果都比较好,效果最好的是香茅油,效果最差的是丁香油。由表5可知,在动物源抑菌剂中鱼精蛋白的抑菌效果比壳聚糖好。由表6可知,在微生物源抑菌剂中,纳他霉素的抑菌效果最好,ε-聚赖氨酸次之,苯乳酸的抑菌效果最差。
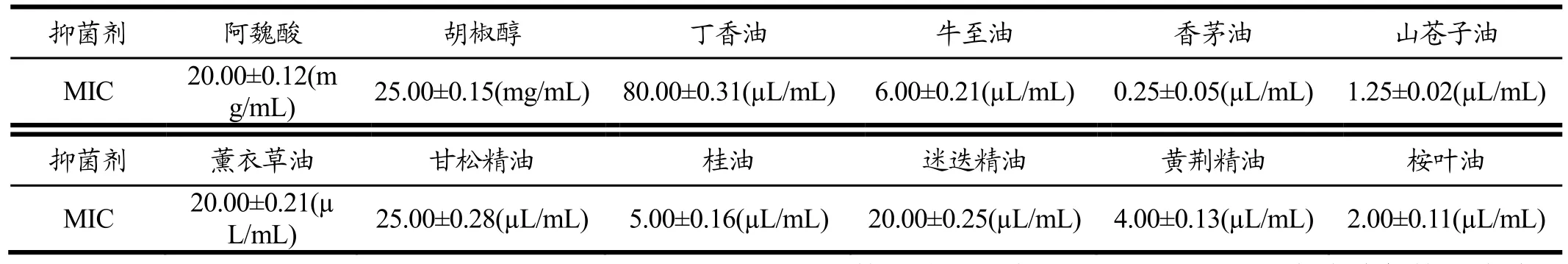
表4 不同植物源抑菌剂对鲁氏接合酵母的最小抑菌浓度Table 4 The minimum inhibitory concentration of different botanical antibacterial agents on Zygosaccharomyces rouxii.
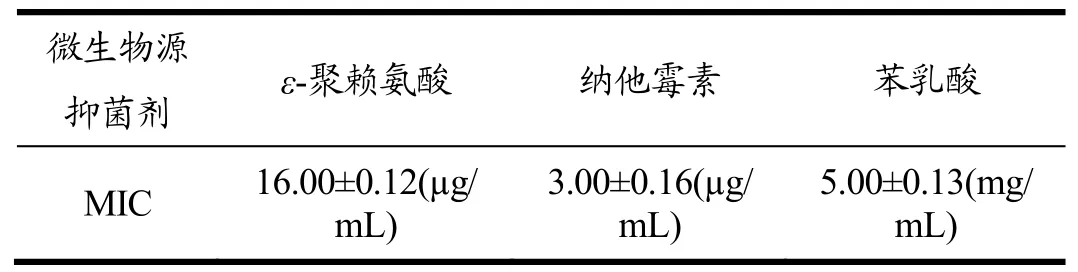
表6 不同微生物源抑菌剂对鲁氏接合酵母的最小抑菌浓度Table 6 The minimum inhibitory concentration of different microbial source antibacterial agent of Zygosaccharomyces rouxii.
2.3 不同基质下酵母菌生长曲线的测定

图4 鲁氏接合酵母在不同基质生长期间OD值的变化Fig.4 Changes of OD during Zygosaccharomycesrouxii growth in different matrix
苹果汁中的成分与 YPD培养基中的成分有所不同,其对酵母菌的生长影响也会有差别。
图4是初始菌液浓度为106CFU/mL的YPD培养基和将浓缩苹果汁稀释为糖度为 12°Brix,pH 为 3.8的普通苹果汁在120 r/min,28 ℃摇床培养条件下培养90 h的过程中鲁氏接合酵母的生长曲线。由图4可知,鲁氏接合酵母在YPD培养基中55 h达到稳定期,90 h达到稳定期末期,在苹果汁中70 h达到稳定期,90 h达到稳定期末期,且在稳定期期间,鲁氏接合酵母在YPD中的OD值要高于在果汁中的OD值,可能是苹果汁中含有多酚类物质会抑制鲁氏接合酵母的生长。因此,抑菌剂在YPD中的MIC与在苹果汁中的MIC略微有所差异。
2.4 协同抑菌效果的测定
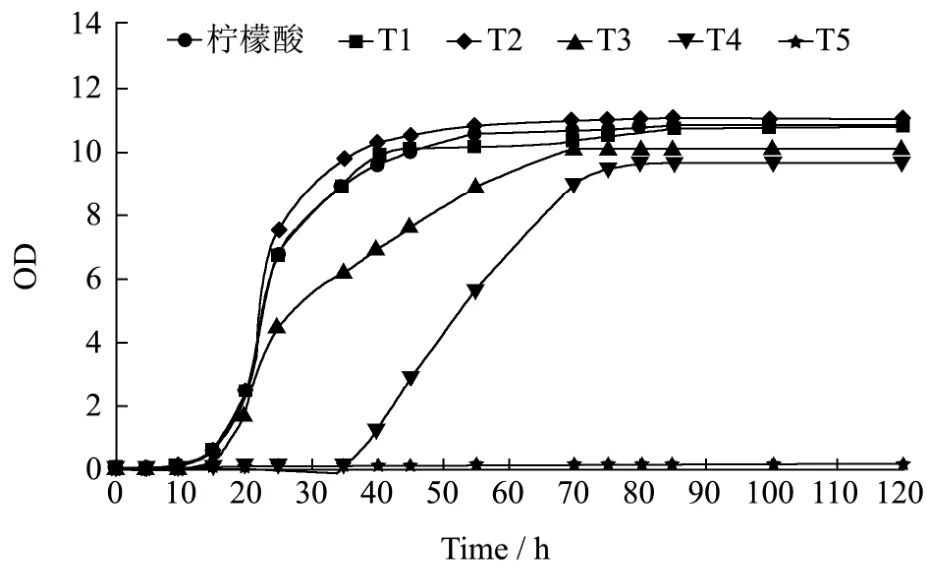
图5 果汁中不同纳他霉素添加量下鲁氏接合酵母生长期间OD值变化Fig.5 Changes of OD value during Zygosaccharomycesrouxii growth in different amount of natamycin of fruit juice
由前面数据可知,对鲁氏接合酵母抑菌效果较好且无色无味水溶性天然抑菌剂有纳他霉素和ε-聚赖氨酸两种抑菌剂,都属于微生物源抑菌剂。但纳他霉素在水中的溶解度很小,将其配制成溶液需要添加大量的纳他霉素溶液,ε-聚赖氨酸在水中的溶解度较大,但其抑菌效果较纳他霉素差,因此需要较高浓度的ε-聚赖氨酸溶液才能彻底抑制鲁氏接合酵母。因此可将纳他霉素和ε-聚赖氨酸两种抑菌剂进行复配制成复合抑菌剂,以提高其抑菌效果。

图6 果汁中不同ε-聚赖氨酸添加量下鲁氏接合酵母生长期间OD值变化Fig.6 Changes of OD value during Zygosaccharomycesrouxii growth in different amount of ε-polylysine of fruit juice

图7 果汁中不同复合抑菌剂配比下鲁氏接合酵母生长期间OD值变化Fig.7 Changes of OD value during Zygosaccharomycesrouxii growth in different ratio of composite antibacterial agent of ε-polylysine of fruit juice
将纳他霉素和ε-聚赖氨酸以不同的配比混合后加入接有鲁氏接合酵母的果汁中,在600 nm的波长条件下测定其菌悬液的吸光度来判断其最小抑菌浓度。图5、图6和图7分别为纳他霉素、ε-聚赖氨酸以及复合抑菌剂在果汁中的生长曲线测定,初始OD值和最终OD值前后差值≤ 0.05即可认为抑菌剂抑制住了鲁氏接合酵母的生长,其中T1~T5表示纳他霉素的浓度分别为 1 µg/mL、2 µg/mL、3 µg/mL、4 µg/mL、5µg/mL,J1~J5 表示 ε-聚赖氨酸的浓度分别为 1 µg/mL、2 µg/mL、4 µg/mL、8 µg/mL、16 µg/mL,T:J=3:7、T:J=5:5、T:J=7:3 表示当纳他霉素和 ε-聚赖氨酸的复合浓度为1 µg/mL时两者的复配比分别为:纳他霉素:ε-聚赖氨酸=3:7、纳他霉素:ε-聚赖氨酸=5:5、纳他霉素:ε-聚赖氨酸=7:3。由以上数据和鲁氏接合酵母在果汁中生长曲线的测定可知,纳他霉素在果汁中的MIC是5µg/mL,ε-聚赖氨酸在果汁中的MIC是16 µg/mL,当纳他霉素:ε-聚赖氨酸为7:3时,抑菌效果最好,复合抑菌剂的MIC是1 µg/mL。
以前的研究表明,当ΣFIC小于1.00时,ΣFIC被认为是有协同作用,如果ΣFIC大于1.00,ΣFIC被认为是有拮抗作用。最近新的研究表明,如果 ΣFIC小于或等于0.5,则具有协同作用[22];如果ΣFIC大于0.5但小于1.00则具有附加作用,ΣFIC大于1.00小于4.00时表示无作用,ΣFIC大于4.00时表现出拮抗作用[43]。
ΣFIC由以下公式计算[41]:

式中:A为纳他霉素的MIC,B为ε-聚赖氨酸的MIC,C为复合抑菌剂的MIC。
由此计算得知,当纳他霉素:ε-聚赖氨酸=3:7时,ΣFIC 为 0.42;当纳他霉素:ε-聚赖氨酸=5:5 时,ΣFIC为 0.36;当纳他霉素:ε-聚赖氨酸=7:3 时,ΣFIC 为 0.28。因此,纳他霉素与ε-聚赖氨酸具有协同抑菌效果,协同抑菌效果最好的复配比为:纳他霉素:ε-聚赖氨酸=7:3。
2.5 不同处理条件下复合抑菌剂的抑菌稳定性比较
2.5.1 柠檬酸浓度对复合抑菌剂抑菌稳定性的影响
柠檬酸的浓度主要影响溶剂的pH,随着pH的降低其复合抑菌剂的溶解度会相应增大,但根据国外有关报道,它们也指出酸度是影响鲁氏接合酵母生长的主要限制因素[43],与此同时pH也有可能影响抑菌剂的稳定性。本试验以普通苹果汁(糖度为12 °Brix,pH为3.8)为培养基质,比较不同柠檬酸浓度溶解相同量的复合抑菌剂对鲁氏接合酵母抑菌活性的影响。由表7可知,柠檬酸浓度在0.1% ~1.6%范围内,随着柠檬酸浓度的增加,复合抑菌剂的抑菌活性呈现显著下降趋势。可能是随着柠檬酸浓度的增大,溶液 pH逐渐下降,复合抑菌剂的稳定性受到了影响,从而降低了其抑菌活性。
2.5.2 温度对复合抑菌剂抑菌稳定性的影响[39]
温度过高会导致复合抑菌剂变性从而影响抑菌剂的抑菌稳定性。以普通苹果汁(糖度为12 °Brix,pH为3.8)为培养基质,比较复合抑菌剂在不同温度处理条件下其抑菌活性的大小。由表8可知,在热处理低于60 ℃时,温度对复合抑菌剂抑菌活性影响随着温度的升高抑菌活性逐渐降低,但降低趋势不明显。当热处理高于60 ℃时,随着温度的上升其抑菌活性降低明显,当热处理达到100 ℃时,复合抑菌剂由原来的无色澄清透明溶液变为浅绿色澄清透明溶液,其抑菌活性也明显下降。可能是因为高温条件下破坏了复合抑菌剂内部的分子结构,使复合抑菌剂的化学性质发生了改变,影响了其抑菌效果。
2.5.3 紫外照射时间对复合抑菌剂抑菌稳定性的影响[39]
抑菌剂在紫外照射下其内部结构可能会有所变化,进而影响其结构稳定性和抑菌活性。以普通苹果汁(糖度为12 °Brix,pH为3.8)为培养基质,比较复合抑菌剂经不同紫外照射时间后其抑菌活性的大小。由表9可知,复合抑菌剂随着紫外照射时间的延长,其抑菌活性略微有所降低但不明显,说明紫外照射会对复合抑菌剂的抑菌活性有轻微影响,会使其抑菌活性略微有所降低。

表7 柠檬酸浓度对复合抑菌剂抑菌活性的影响Table 7 Effect of citric acid concentration on the antibacterial activity of composite antibacterial agent

表8 温度对复合抑菌剂抑菌活性的影响Table 8 Effect of temperature on the antibacterial activity of composite antibacterial agent

表9 紫外线对复合抑菌剂抑菌活性的影响Table 9 Effect of ultraviolet rays on the antibacterial activity of composite antibacterial agent
3 结论
对鲁氏接合酵母有抑菌活性的天然抑菌剂有很多,其中植物源抑菌剂的种类最多,抑菌效果较好的是阿魏酸和山苍子油,动物源抑菌剂种类最少,吴刚[44]研究了壳聚糖对啤酒酵母表现出抑制作用,本研究发现壳聚糖对鲁氏接合酵母也有一定的抑菌效果,王南舟等人[45]研究了鱼精蛋白对啤酒酵母和异常汉逊酵母均有抑制作用,本研究发现鱼精蛋白对鲁氏接合酵母也有较好的抑菌效果,但其提取成本较高,考虑到经济实惠因素,目前还不能大规模生产作为食品中的抑菌剂。对鲁氏接合酵母抑菌效果最好的是微生物源抑菌剂,且微生物源抑菌剂以其无色、无味、安全无毒、高效和经济实用等特点在食品中的应用也越来越广泛[46]。本文通过对天然抑菌剂MIC的测定,筛选出纳他霉素和ε-聚赖氨酸两种微生物源抑菌剂,并将两种抑菌剂以不同添加配比通过紫外分光光度计测量其OD值,发现当纳他霉素:ε-聚赖氨酸=7:3时基本能完全抑制住果汁中鲁氏接合酵母菌的生长,且两种抑菌剂具有协同抑菌效果。由于不同培养基基质的成分不同,对微生物的生长也有不同的影响,鲁氏接合酵母在YPD中的OD值要高于在果汁中的OD值,可能是苹果汁中含有多酚类物质会抑制鲁氏接合酵母的生长。因此,抑菌剂在YPD中的MIC与在苹果汁中的MIC也会略微有所差异。通过将抑菌剂在不同柠檬酸浓度、不同温度以及不同紫外照射时间下测定其抑菌活性的稳定性可知,三种因素都会影响复合抑菌剂的抑菌活性。随着柠檬酸浓度的增加,其抑菌活性逐渐降低;随着温度的升高,其抑菌活性逐渐降低;随着紫外照射时间的延长,其抑菌活性逐渐降低。

