血清维生素D水平与慢性肝病相关性的临床研究
豆正莉,陈 熙,任晓非,马维娟,李自生
慢性肝病多指肝脏长期受到侵袭破坏和再生的过程,常进展为肝炎、肝纤维化、肝癌等。越来越多的文献[1]报道慢性肝病患者发生骨质疏松和骨折的风险增加,可能与维生素D(vitamin D,VitD)缺乏有关。近年的相关研究[2]显示,肝脏疾病患者中VitD水平普遍偏低,VitD缺乏在肝脏疾病的发生、发展中起一定的作用,并且与肝病患者的预后有一定的关联。VitD代谢过程中产生的25(OH)D半衰期长,在血清中稳定,可反映机体VitD的储备水平[3]。该研究拟探讨慢性肝病患者血清25(OH)D水平及其与肝功能分级的相关性,旨在为该类患者的临床治疗提供新的思路。
1 材料与方法
1.1病例资料选取2017年6 月~2017 年11月在安徽医科大学附属巢湖医院消化科、感染科住院的失代偿期肝硬化患者100例和慢性乙型病毒性肝炎(chronic hepatitis B,CHB)患者 100例作为试验组,同期健康体检人群100例作为对照组。患者纳入标准:失代偿期肝硬化的诊断依据第八版《内科学》(人民卫生出版社),通过血常规、肝生化、出凝血时间、肝脏CT或MRI影像学检查及胃镜检查等,明确有肝功能减退及门静脉高压存在;CHB的诊断符合中华医学会制定的CHB防治指南[4]。排除标准:恶性肿瘤、高血压、冠心病、肺结核、糖尿病、慢性肾病等相关疾病患者;近3个月有服用VitD制剂;可引起VitD吸收障碍的消化道手术、炎症性肠病、甲状腺及甲状旁腺疾病的患者;妊娠或哺乳期妇女。本研究获安徽医科大学附属巢湖医院伦理委员会批准,伦理编号:201711-LJSX-02,所有研究对象均签署知情同意书。
1.2研究方法空腹8 h以上抽取静脉血2~3 ml、离心后保存血清于-80 ℃冰箱中待测;电化学发光法检测25(OH)D水平,采用上海罗氏公司生产的25(OH)D检测试剂盒。血常规、肝功能、肾功能、国际标准化比值(international normalized ratio,INR)、凝血酶原时间(prothrombin time ,PT)等项目均来自于病历资料。25(OH)D水平分类标准:缺乏(<20 ng/ml);不足(20 ~30 ng/ml); 理想水平(30~100 ng/ml)[3]。终末期肝病模型(model for end-stage liver disease ,MELD)评分计算公式:MELD=3.78×ln(总胆红素)+11.2×ln(INR)+9.57×ln(血肌酐)+6.43×(胆汁性或酒精性0,其他1),任何小于1的数值默认为1,以防评分为负数;适用于≥12岁的患者。结果范围:MELD评分≥18分,高危;MELD评分14~18分,中危;MELD评分≤14分,低危[5]。分析25(OH)D水平在肝硬化组、CHB组、健康对照组之间的差异;统计肝硬化组患者血清25(OH)D水平与肝脏储备功能量化评估分级标准(child-pugh score,CP)和MELD评分之间的相关性。
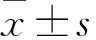
2 结果
2.1不同组别年龄、性别及25(OH)D水平的比较健康对照组、CHB组、肝硬化组的总血清25(OH)D水平之间差异有统计学意义(P<0.001)。肝硬化组25(OH)D水平显著低于对照组及CHB组(P均<0.001)。肝硬化组中25(OH)D水平缺乏比例明显高于CHB组(P<0.001)及健康对照组(P<0.001),差异有统计学意义;肝硬化组中25(OH)D水平正常比例明显少于CHB组(P<0.001)及健康对照组(P=0.003),差异有统计学意义。见表1。
2.225(OH)D水平与肝硬化Child-Pugh分级的关联Child-Pugh A级患者25(OH)D 水平大于Child-Pugh B级(P<0.001);Child-Pugh B级患者25(OH)D 水平大于Child-Pugh C级(P<0.001),差异均有统计学意义。25(OH)D水平与Child-Pugh评分呈负相关(Spearman 相关系数rs2=-0.559,P<0.001)。见表2。
2.325(OH)D水平与肝硬化MELD评分的关联MELD评分≤14组的患者25(OH)D 水平大于MELD评分≥18组的患者(P=0.002),差异有统计学意义;MELD≤14与MELD(14~18)、MELD(14~18)与MELD≥18两两比较差异均无统计学意义(P>0.05)。25(OH)D水平与MELD评分呈负相关(Pearson相关系数r2=-0.551,P<0.001)。见表3、图1。
图1 25(OH)D水平与MELD评分的相关性

项目分组对照(n=100)肝炎(n=100)肝硬化(n=100)F/χ2值P值年龄(岁)58.53±13.5644.41±11.7458.97±12.8742.238<0.001性别(男:女)67:3372:2873:270.9970.60725(OH)D总水平29.80±8.95**37.96±9.93**24.42±12.0642.621<0.00125(OH)D充足 (>30)47(47%)**80(80%)**27(27%)57.347<0.00125(OH)D不足 (20~30)38(38%)19(19%)35(35%)9.8140.00725(OH)D缺乏 (<20)15(15%)**1(1%)**38(38%)47.290<0.001
与肝硬化组比较:**P<0.01

表2 肝硬化组肝功能Child-Pugh分级与25(OH)D(ng/ml)水平的比较
与Child -Pugh A比较:**P<0.01;与Child -Pugh B比较:##P<0.01

表3 肝硬化组肝功能MELD评分与25(OH)D(ng/ml)水平的比较
与MELD≤14比较:**P<0.01
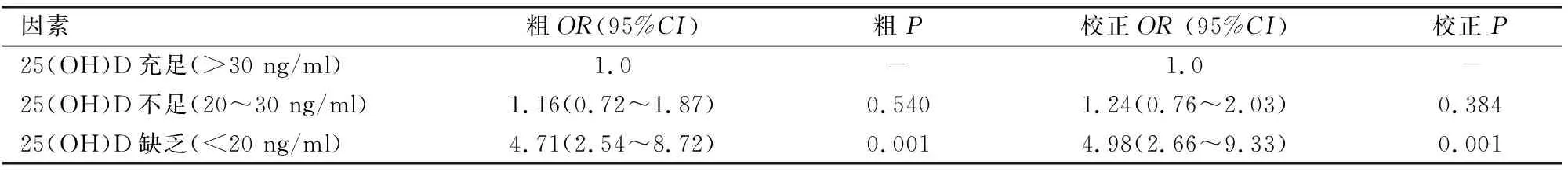
表4 25(OH)D水平和慢性肝病的多因素分析
2.425(OH)D水平和慢性肝病的多因素分析将25(OH)D分为充足、不足、缺乏;未校正年龄、性别混杂因素显示,25(OH)D水平<20 ng/ml的患者肝脏病变程度更重(P=0.001);多元logistic回归校正年龄、性别混杂因素后显示,25(OH)D水平<20 ng/ml的患者肝脏病变程度仍然更重(P=0.001)。见表4。
3 讨论
VitD属于类固醇衍生物,主要来源包括阳光照射皮肤合成及饮食摄入,需分别在肝脏、肾脏经过两次羟化反应后才具有生物学活性。活化后的VitD经VitD结合蛋白(vitamin D binding protein,DBP)转运至靶器官,与VitD受体(vitamin D receptor,VDR) 结合发挥其生物学效应,VDR 存在于几乎所有的有核细胞中,作用广泛[3]。VitD的经典作用为调节体内钙磷平衡,促进骨骼健康。此外,有文献报道:VitD还具有调节免疫、调节细胞增殖与分化、抗炎、抗氧化、抗纤维化等多重作用[6],在降低许多慢性疾病(包括常见癌症、自身免疫性疾病、传染病和心血管疾病)的风险方面发挥着巨大的作用[7]。
Hoan et al[8]研究发现CHB相关性肝硬化及肝癌患者的25(OH)D水平均显著低于CHB患者。另有报道[9]称慢性丙型病毒性肝炎(chronic hepatitis C,CHC)相关的肝硬化患者中25(OH)D水平也显著低于CHC患者。本研究中,肝硬化组中由慢性病毒性肝炎引起的占2/3以上,肝硬化患者中25(OH)D水平普遍较低,比率明显高于CHB组及健康对照组。与以上两个研究结果相似。这与VitD的抗纤维化作用有关,大量文献[10]指出VitD具有抗肝纤维化作用,当各种病因导致肝脏持续性损伤,肝星形细胞(hepatic stellate cells ,HSC)被激活,细胞因子生长增加,细胞外基质(extracellular matrix,ECM)合成增加、降解减少,最终导致肝纤维化发生。此种机制与HSC VDR参与表达调控相关。活化的VitD能够上调VDR在HSC中的表达,抑制HSC增殖,降低体内平滑肌肌动蛋白、胶原蛋白的水平,延缓肝硬化进展。活化的1,25(OH)2D可抑制 HSC 的激活和增殖,调控细胞外基质和基质金属蛋白,减少 ECM 合成,促进 ECM 降解,协同延缓并阻止肝纤维化的形成[11]。本研究也证实VitD在肝硬化组患者中水平最低,提示VitD可能是肝纤维化的一项保护性因素。
本研究进一步显示血清25(OH)D水平与Child-Pugh 分级及MELD评分均呈负相关,与既往的文献[12]报道一致。此种现象与DBP功能有关, DBP有强大的VitD结合能力,DBP下降50%并不会导致VitD水平降低,而在肝功能严重损害的患者中DBP合成大幅度下降进而降低VitD水平[13],这就可解释为什么更低的血清25(OH)D水平在Child B、Child C及MELD评分>18分的肝功能较差的肝硬化患者中更为多见。慢性肝病中VitD水平普遍缺乏的原因有:①肝功能受损后25-羟化酶的活性降低,白蛋白及DBP合成减少,VitD在肝脏的羟化受损[14];② 胆汁促进VitD的吸收,肝硬化患者,肝细胞生成和分泌胆汁量减少,导致VitD吸收障碍;同时因门静脉高压胃肠道淤血水肿,进食减少,饮食摄入VitD量随之减少[15];③ 肝硬化患者因为疾病户外活动较少,暴露在阳光中的时间缩短,同时合并黄疸降低阳光照射皮肤产生的VitD。
肝炎发展为肝硬化往往需要数十年的时间,因此在本研究中肝炎组患者的年龄明显小于肝硬化组患者的年龄。将25(OH)D水平分为充足、不足、缺乏;未校正年龄、性别混杂因素与多元Logistic回归校正年龄、性别混杂因素后均显示,25(OH)D浓度<20 ng/ml的患者肝脏的病变程度更重,提示年龄、性别差异对本研究结果无影响。

