日本血吸虫虫卵可溶性抗原抑制TNBS小鼠结肠炎的实验研究
李 路, 陈 熙, 武 艺, 徐永伟, 徐元宏,王书书, 沈继龙
炎症性肠病(inflammatory bowel disease, IBD) 是一种病因尚不明确的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis, UC) 和克罗恩病(Crohn’s disease, CD)。目前的研究[1]表明:遗传、微生物和环境因素都会引发免疫反应的异常,进而导致IBD的发生,其中肠道菌群失调和免疫功能异常是IBD的重要发病机制。Strachan[2]提出的“卫生假说”认为,过于讲究卫生、从未有过蠕虫感染的人群可能更易于患IBD、其他过敏性和自身免疫性疾病。三硝基苯磺酸(2,4,6-trinitrobenzene sulphonic acid,TNBS)诱导的小鼠结肠炎模型是研究IBD发病机制的常用动物模型[3]。近年来,越来越多的研究[4]表明,蠕虫可通过调节Th1/Th2免疫应答,诱导产生Treg对IBD起到免疫抑制作用。有研究[5]表明,日本血吸虫虫卵可通过诱导Th2型免疫反应下调Th1型反应来改善TNBS诱导的小鼠结肠炎。因此,能否在无活体寄生虫感染的情况下,用蠕虫虫源性分子作为一种新的治疗策略成为研究热点。在我国,日本血吸虫虫卵可溶性抗原(Schistosomajaponicumsoluble egg antigens, SjSEA)易于获得且无毒无害,该研究旨在探讨SjSEA对TNBS诱导的小鼠结肠炎的免疫调节作用及其机制,为临床IBD治疗提供新思路。
1 材料与方法
1.1实验动物雌性BALB/c小鼠,SPF 级,8~10周,购自常州卡文斯实验动物有限公司,在室温、光照周期12 h ∶12 h 条件下适应性饲养4 d。
1.2实验材料TNBS购自美国Sigma 公司;内毒素去除凝胶(Detoxi-GelTMEndotoxin Removing Gel)购自美国Thermo Scientific公司;髓过氧化物酶(Myeloperoxidase, MPO)试剂盒购自南京建成生物工程研究所;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记抗CD4单抗、PE标记抗IFNγ(interferon-γ,γ干扰素)单抗、APC标记抗IL-4(interleukin-4,白细胞介素4)单抗、APC标记抗CD25单抗,PE标记抗Foxp3(forkhead box P3, 转录因子)单抗购自美国BD Pharmingen公司。
1.3方法
1.3.1小鼠结肠炎模型的构建 实验前,小鼠禁食24 h。灌肠液使用5% TNBS和无水酒精的混合物,比例为1 ∶1。在10%水合氯醛腹腔注射麻醉后,用橡胶管经肛门插入小鼠结肠内约3.5 cm,注入0.1 ml灌肠液。注射TNBS后,橡胶管保留在原位30 s。接下来,小鼠倒置60 s以确保结肠持续暴露在TNBS混合物中。最后将小鼠放回笼子自由饮食。
1.3.2SjSEA的获取 参照文献[6]方法日本血吸虫虫卵从感染血吸虫的兔肝脏中无菌采集。在少量的磷酸盐缓冲液(phosphate buffer, PBS)中将血吸虫虫卵研磨成粉末,再将其放入-80 ℃冰冻30 min。此步骤反复操作3次。在370 r/min、15 min、4 ℃条件下离心获取上清得到日本血吸虫虫卵粗蛋白。用BCA蛋白浓度测定试剂盒测该虫卵粗蛋白的浓度,其中的脂多糖用内毒素去除凝胶清除。
1.3.3实验分组和实验方法 Balb/c小鼠分为3组:正常对照组(control):PBS灌肠+PBS腹腔注射;TNBS造模组(TNBS):TNBS溶液灌肠+ PBS腹腔注射;TNBS+SjSEA 干预组(TNBS -SjSEA):TNBS溶液灌肠+SjSEA 腹腔注射。 TNBS+SjSEA 干预组在诱导TNBS结肠炎后6 h和24 h腹腔注射50 μg SjSEA (在PBS中稀释至100 μl),正常对照组和TNBS造模组均腹腔注射等体积PBS。在治疗期间,观察动物的体质量和临床疾病活动指数。3 d后无痛处死小鼠,检测结肠长度、MPO、MAO(宏观炎症评分Macroscopic score)和MIO(微观炎症评分Microscopic score,MIO)及HE染色。为了探讨SjSEA的免疫机制,用流式细胞术检测脾淋巴细胞的Th1/Th2细胞和Treg的比例。
1.3.4疾病活动指数 实验期间每日观察小鼠体质量变化、大便性状,每日观察或用粪便隐血试纸检测血便情况,按文献[7]方法行疾病活动指数(disease activity index, DAI)评分。
1.3.5宏观炎症评分 造模3 d后无痛处死小鼠,取其结肠在PBS中仔细清洗。MAO包括结肠粘连程度、结肠溃疡程度、结肠壁厚和粘膜水肿程度。参照文献[7],每个指标的评分从0(正常)到3(严重)。评分范围从最低0分(无炎症表现)到最高12分(严重炎症表现)。结肠长度的改变也是评价结肠组织炎症的指标之一[7]。
1.3.6镜下组织学评分 造模3 d后无痛处死小鼠,取远端结肠用多聚甲醛固定,石蜡包埋后行HE 染色,按照Obermeier et al[8]制定的标准进行组织学MIO。
1.3.7MPO活性测定 无痛处死小鼠后打开腹腔并取结肠,制备10%结肠组织匀浆,结肠MPO活性通过四甲基联苯胺法[7]检测。
1.3.8淋巴细胞分离及流式细胞仪(Flow cytometry, FACS)分析 在无菌台将实验小鼠的脾脏无菌移除,并用1 ml注射器内芯研磨。通过200目滤网,加入红细胞裂解液对脾细胞悬液的红细胞进行裂解。用70 μm尼龙滤网滤至1.5 ml EP管中,悬浮于RPMI -1640培养基中并调成浓度为 1×106/ml的细胞悬液。加入细胞刺激剂刺激5 h,破胞膜后分别加入PE-IFNγ、APC-IL-4 抗体固定。对于Treg、脾淋巴细胞加入FITC标记的抗小鼠CD4单克隆抗体和APC标记的抗小鼠CD25单克隆抗体。破核膜后用PE标记的抗小鼠Foxp3单克隆抗体染色。FACS检测,并利用Flowjo软件进行分析。
2 结果
2.1SjSEA对结肠炎小鼠DAI、体质量变化、MAO、结肠长度的影响造模3 d后,TNBS造模组出现明显的结肠炎症状,如出现稀便或肉眼血便等症状以及体质量下降。在TNBS诱导的结肠炎小鼠中,结肠宏观表现为粘膜溃疡、结肠增厚和水肿,以及严重的腹腔粘连。结果显示:三组之间在下述指标差异均有统计学意义,DAI(F=71.91,P<0.001);体质量变化(F=45.24,P<0.001);MAO(F=66.35,P<0.001);结肠长度(F=13.84,P<0.001)。TNBS-SjSEA组与TNBS-PBS组相比,MAO显著降低,引起的结肠炎严重程度明显减轻(P<0.05),见图1C。评价炎症指标还包括 DAI、体质量变化、结肠长度变化。与 TNBS 模型组比较,TNBS- SjSEA组小鼠DAI水平明显降低,体质量回升和结肠长度缩短明显改善(P均<0.05),见图1。
2.2SjSEA对结肠炎小鼠MPO的影响与正常组比较,TNBS模型组小鼠的结肠匀浆MPO水平明显升高(P<0.05),提示造模成功。结果显示:三组之间均有统计学意义,MPO(F=32.33,P<0.001)。与TNBS模型组比较,SjSEA干预后的匀浆MPO活性显著降低(P<0.05)。见图2A。
2.3SjSEA对结肠炎小鼠结肠组织形态学的影响HE 染色后光镜下可见TNBS模型组的小鼠结肠组织病理提示结肠黏膜及黏膜下层炎性细胞浸润、聚集成团,局部水肿、糜烂,并伴有溃疡形成。SjSEA治疗后小鼠结肠上皮结构较完整,部分细胞肿胀,有少量细胞坏死、炎细胞浸润,与TNBS模型组比较有显著改善,见图 3。TNBS组镜下组织学评分(MIO)为(6.17±0.75),TNBS-SjSEA组MIO水平为(3.83±1.47)。结果显示:三组之间差异均有统计学意义,MIO(F=63.84,P<0.001)。与TNBS组比较,SjSEA治疗组MIO水平明显降低(P<0.05)见图2B。
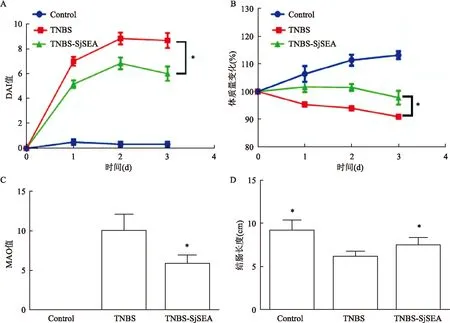
图1 各组小鼠DAI、体质量变化、MAO、结肠长度的变化
A:各组小鼠的DAI分数;B:各组小鼠的体质量变化;C:各组小鼠的MAO大小;D:各组小鼠的结肠长度变化;与TNBS造模组比较:*P< 0.05
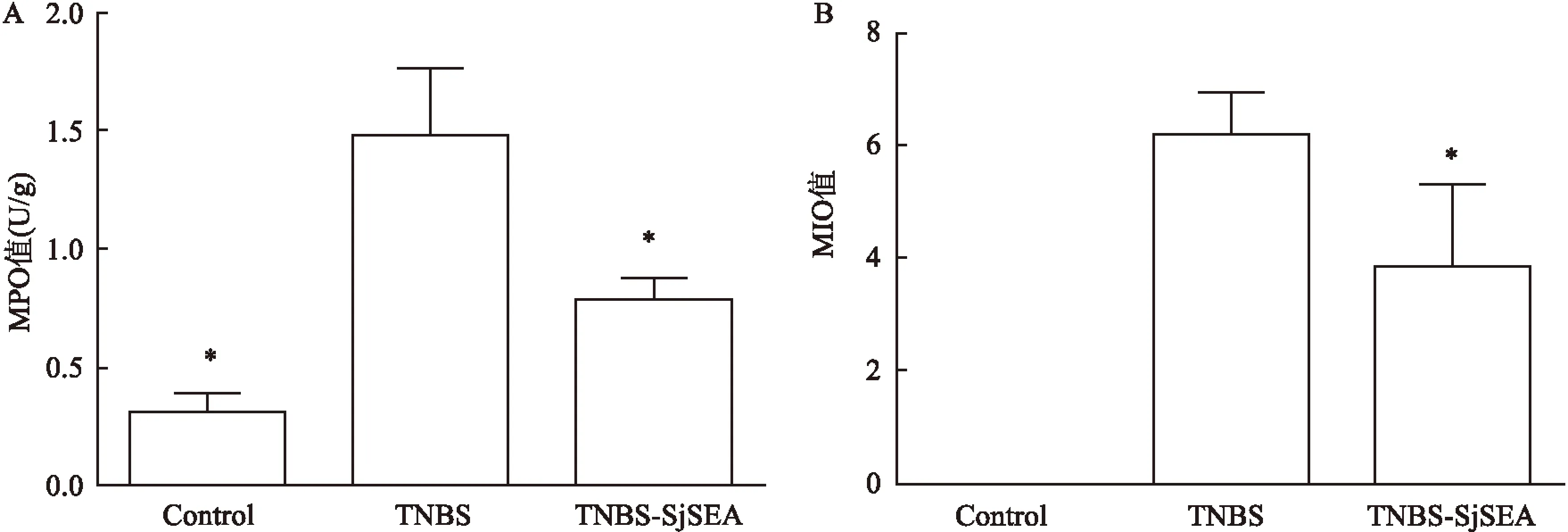
图2 日本血吸虫虫卵可溶性抗原对结肠炎小鼠MPO及MIO的影响
2.4SjSEA对小鼠脾脏T淋巴细胞亚群和Treg比例的影响经单因素方差分析,结果显示:三组之间在下述指标中差异有统计学意义,CD4+IFNγ+(F=27.59,P<0.001);CD4+IL-4+(F=8.84,P<0.05);CD4+CD25+Foxp3+(F=21.17,P<0.01)。TNBS造模组小鼠脾脏CD4+IFNγ+占CD4+比例为(2.91±0.66)%,与正常组的小鼠脾脏CD4+IFNγ+(0.44±0.17)% 相比,显著增加(P<0.05);与造模组相比,治疗组脾脏CD4+IFNγ+(0.68±0.37)%显著降低(P<0.05),见图4。治疗组脾脏CD4+IL-4+占CD4+比例为(1.31±0.40)%,与造模组相比,显著升高(P<0.05),见图4。SjSEA治疗组CD4+CD25+Foxp3+比例(17.57±4.94)%明显高于造模组小鼠脾脏(5.70±1.32)%(P<0.05),见图5。
3 讨论
IBD是由UC和CD组成的肠道自身免疫症性疾病。尽管临床上有5- 氨基水杨酸类、糖皮质激素、免疫抑制剂等多种药物用于治疗IBD,但仍有部分患者治疗效果不尽人意,不能达到维持缓解的治疗目的,并且药物副作用较多。TNBS诱发的小鼠结肠炎模型以 Th1 为主的免疫应答为主,类似于人类CD[3]。据报道,日本血吸虫半胱氨酸蛋白酶抑制剂(rSjrcystatin)[7]、旋毛虫重组蛋白 P53(rTsP53)[9]等可明显减轻 TNBS 诱导的小鼠结肠炎症。近年国外相继开展了蠕虫及蠕虫源性分子治疗IBD的临床试验。一项小样本临床试验报道[10]:4例CD患者和3例UC患者经口服用猪鞭虫卵后,所有患者的临床活动指数均有下降,达到了临床缓解。另一项随机双盲、安慰剂对照临床研究[11]显示:接受单剂量(可多达7 500个)猪鞭虫卵对CD患者的治疗具有较好的疗效及安全性。考虑到活蠕虫感染对患者的不利因素(如侵袭性等),用无毒无害、成分相对简单的蠕虫源性分子代替活蠕虫治疗IBD成为趋势。本课题组探讨了SjSEA)对TNBS 诱导的小鼠结肠炎的保护作用,实验结果显示,SjSEA可以减轻TNBS诱发的小鼠结肠炎的严重程度,其中Th2细胞和Treg发挥了显著的免疫调节作用。
为评估SjSEA对结肠炎小鼠临床症状的影响,记录小鼠体质量变化、结肠长度变化,并给予临床疾病评分、宏观疾病评分、镜下组织学评分、MPO检测及结肠组织HE染色病理检查。TNBS引起的小鼠结肠炎以腹泻、便血、体质量减轻和粘膜溃疡为主要特征,炎症过程还伴随促炎细胞因子、DAI、MPO、MAO和MIO的急剧增加。本研究结果显示,在小鼠实验性结肠炎模型组中引起的上述炎症参数明显增加,50 μg SjSEA 6 h、24 h两次腹腔给药后,治疗组小鼠结肠炎的临床症状有所缓解,炎症指标均明显降低,与既往的文献报道一致[7]。
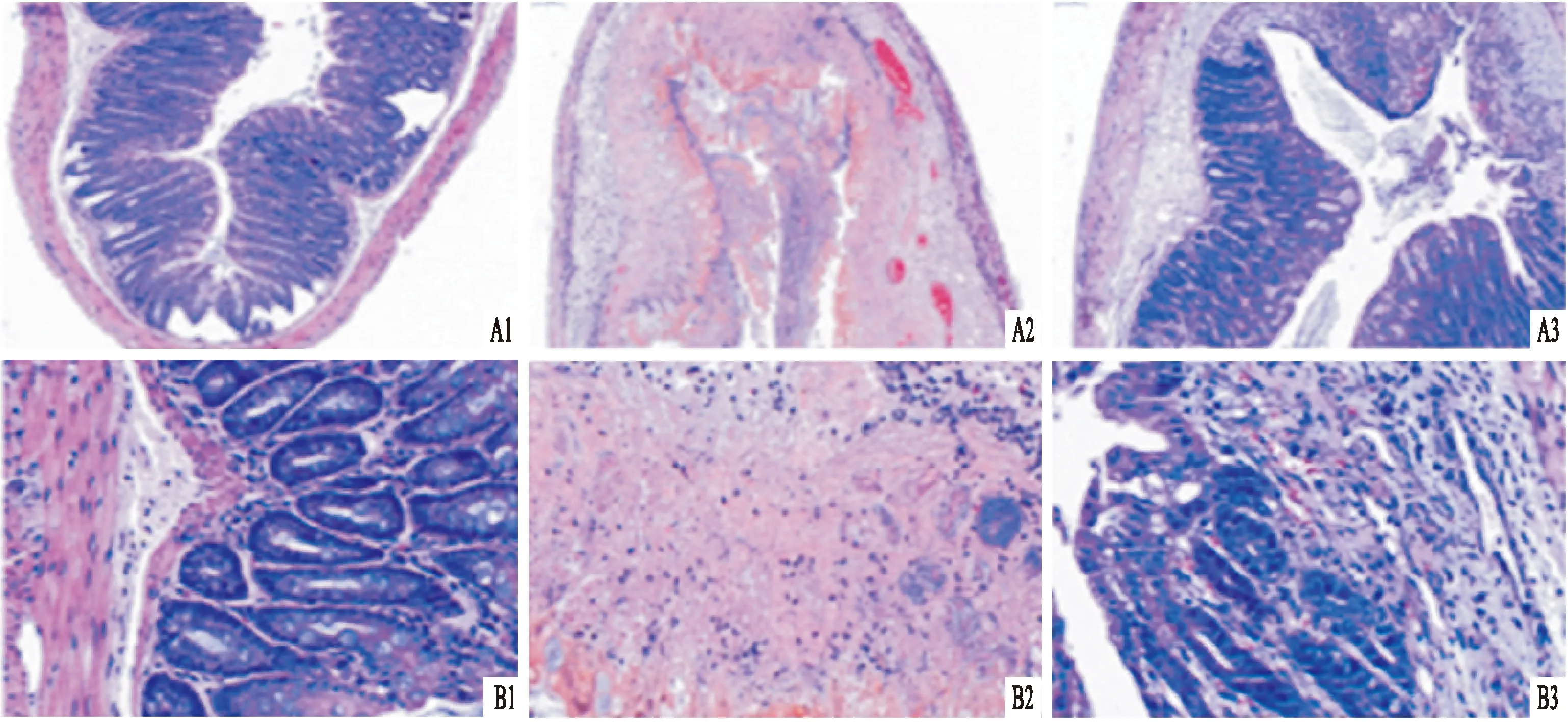
图3 各组小鼠远端结肠的HE染色
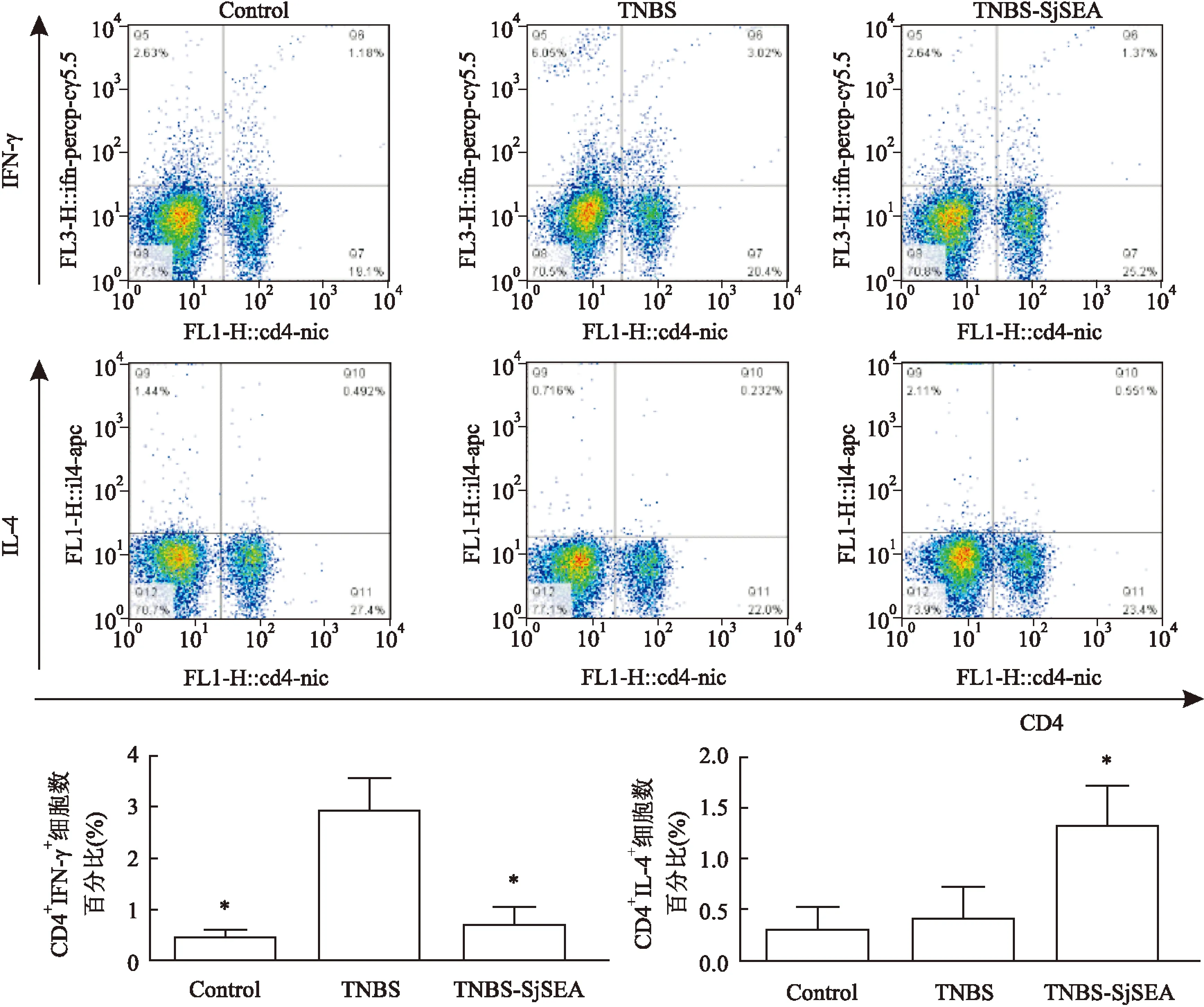
图4 各组小鼠脾脏Th1(CD4+IFNγ+)、Th2(CD4+IL-4+)占CD4+比例

图5各组小鼠脾脏Treg占CD4+比例
与TNBS造模组比较:*P<0.05
为了进一步探讨SjSEA抗炎作用的免疫机制,特别是Th1、Th2和Treg细胞之间的平衡,测定了脾脏的T淋巴细胞亚群和Treg比例,实验结果表明:与PBS处理的结肠炎小鼠相比,在SjSEA处理的结肠炎小鼠的脾脏淋巴细胞中,CD4+IFNγ+明显降低,CD4+IL-4+显著升高,表明SjSEA处理后的结肠脾脏淋巴细胞中Th1反应(IFNγ)下调、Th2反应 (IL-4)上调。在不同的蠕虫种类中包括曼氏血吸虫卵和日本血吸虫卵观察到了类似的结果[5,12]。同时证明了蠕虫感染可通过下调Th1免疫应答,激活以IL-4和/或IL-13的大量增殖起主导的Th2免疫应答[4]。
蠕虫及其虫源性蛋白也可诱导Treg的增殖,促进调节性细胞因子(IL-1)和转化生长因子β(Transforming growth factorβ, TGF-β)的分泌,抑制Th1细胞和Th17细胞免疫反应所引起的自身免疫性疾病[3]。Denning et al[13]证明了Treg通过阻止Th1效应细胞的积累可改善结肠炎。本研究中SjSEA干预后的脾脏淋巴细胞与PBS处理的结肠炎小鼠相比,Treg比例显著升高,与以往文献报道一致[7]。因此,本研究的流式细胞检测数据证实了:SjSEA可以通过诱导Th2反应来恢复受干扰的肠道免疫平衡,而Th2反应驱动Th1的下调,也可诱导产生Treg减轻结肠炎症。因此,本研究结果表明,Th2细胞和Treg在SjSEA发挥对结肠炎症的保护机制中起重要作用。

