sFasL及其受体在双阴性T细胞杀伤胰腺癌细胞中的作用及意义
胡丕波,陈 炯,邬高华,周海波,赵金钱,杨旭东
近年来虽然医疗水平在不断的进步,癌症的治疗效果逐年提高,但是胰腺癌却是其中的一个例外,其起病隐匿,病情发现较晚,且极易发生转移,常规方法治疗预后不佳,5年生存率一直低于5%[1-2]。国际上热门的“免疫疗法”成为癌症目前治疗手段中最有前景的方法之一。“过继免疫”的提出更让人们看到了治愈肿瘤的曙光。其中双阴性T细胞(double negative T cell,DNT cell)由于其明显的抗肿瘤作用引起了众多研究者的关注。杨仁保 等[3]在利用裸鼠模型进行的体内实验中显示DNT细胞可以杀伤胰腺癌细胞,但是其具体的杀伤机制尚无定论。Chang et al[4]研究报道了可溶性的FasL与其受体Fas结合介导肺癌细胞的凋亡,这为课题组提供了新的思路。该研究的目的是探索sFasL/Fas是否参与了DNT细胞杀伤胰腺癌细胞。
1 材料与方法
1.1病例资料人胰腺癌细胞株Panc-1、BXPC-3、Capan-1(中科院上海细胞库)。人胰腺癌组织蜡块标本和癌旁组织蜡块标本各60例(距离癌组织>1 cm)。均取自2014年3月~2017年8月安徽医科大学附属省立医院胆胰外科行切除术且病理证实为胰腺癌的组织。其中男34例,女26例;年龄(60.15±12.32)岁。所选患者术前均未进行过放疗、化疗等抗肿瘤治疗。同时收集这60例胰腺癌患者的临床病理资料。分离DNT细胞的人外周血标本取自未服用药物、无免疫性疾病的健康人群。肿瘤分期参照美国癌症委员会TNM分期手册第7版。
1.2主要试剂胎牛血清(杭州四季青公司);RPMI1640培养基、DMEM培养基(美国Hyclone公司);FasL ELISA试剂盒(美国R&D Systems 公司);CD4 +、CD8 + 去除液(加拿大Stemcell Technologies 公司);白介素2(interleukin-2, IL-2)、白介素4(IL-4)、抗人T 淋巴细胞表面CD3 (OKT3)抗体(美国eBioscience 公司);人外周血淋巴细胞分离液(天津灏洋公司);兔抗人Fas抗体(英国Abcam公司);蛋白提取试剂盒(南京Keygen 公司);实时定量PCR试剂盒(日本TaKaRa公司);逆转录试剂盒(美国Thermo公司);TRIzol(美国Invitrogen 公司)。
1.3实验方法
1.3.1细胞培养 DNT细胞的培养采用OKT3抗体吸附法。将CD4、CD8去除液(50 μl/ml)加入肝素钠抗凝的10 ml健康人外周血中,静置孵育20 min后,缓慢加入到含有等量淋巴细胞分离液的离心管中,保持液面分层然后离心,吸取中间云雾层细胞两次洗涤,用含10%胎牛血清的RPMI1640培养基重悬细胞,然后接种到OKT3包被的培养瓶中,在37 ℃、5%CO2恒温条件下静置培养,每隔3 d滴加IL-2(1 μl/ml)和IL-4(1 μl/ml)促进生长。2~3 d换液,6 d移至较大的培养瓶中,12~13 d使用细胞。胰腺癌细胞培养:3株胰腺癌细胞均使用含10%胎牛血清的DMEM培养基静置于37 ℃、5%CO2条件下恒温培养,2~3 d换液传代。
1.3.2Fas mRNA 检测 采用qRT-PCR法,首先按照TRIzol试剂盒说明书提取3株胰腺癌细胞的RNA,根据逆转录试剂盒说明书操作合成cDNA。使用qPCR试剂盒进行扩增反应,反应体系为10 μl。Fas上游引物:5′- TTGCTTAGGGTTCCCTCCTG-3′,下游引物:5′-AAACTGGAGAGCAGACAGCA-3′。β-actin上游引物:5′-GGGAAATCGTGCGTGACATTAAGG -3′,下游引物:5′-CAGGAAGGAAGGCTGGAAGAGTG -3′。qPCR循环参数:95 ℃预变性2 min,95 ℃变性5 s,60 ℃退火10 s,72 ℃延伸30 s,共40个循环。以β-actin为内参,采用2-ΔΔCt计算mRNA表达量,实验重复3次。
1.3.3Fas蛋白检测 采用Western blot法,收取3株胰腺癌细胞并加入RIPA细胞裂解液提取蛋白,按照1 ∶4加入5×上样缓冲液。沸水浴加热10 min冷却后上样,SDS-PAGE电泳分离蛋白质,半干转法将蛋白质转移至PVDF膜;5%脱脂奶粉封闭;滴加Fas一抗,4 ℃过夜;加入适当稀释度的辣根过氧化物酶(HRP)标记的二抗,室温孵育2 h,然后PBST洗涤3次;加入ECL曝光液,曝光显影后,使用Image J软件进行条带分析。
1.3.4sFasL检测 采用ELISA法,将DNT细胞(5×106/ml)的培养液(换液过夜)作为实验组,将未培养DNT细胞的培养液(换液过夜)作为对照组,各取100 μl进行检测,按照ELISA试剂盒进行操作,读取OD值,计算两组sFasL的浓度。
1.3.5人胰腺癌组织Fas蛋白检测 采用免疫组化法,取胰腺癌石蜡切片脱蜡后柠檬酸盐高压修复,缓慢冷却至室温,然后使用内源性过氧化物酶阻断剂消除内源性过氧化物酶活性(30 min),PBS冲洗3次,再滴加一抗Fas(1 ∶200),4 ℃过夜,次日室温下放置30 min,PBS冲洗3次,随后滴加二抗孵育30 min,PBS冲洗3次,加入适量DAB显色,自来水冲洗,苏木精复染,烘箱烘干,最后中性树脂封片。
1.4统计学处理采用SPSS 19.0软件进行分析,两组均数比较采用t检验,3组均数比较采用方差分析,定性资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1DNT细胞镜下形态DNT细胞从健康人外周血中分离提取,最初细胞数量较少(1×105/ml),呈现悬浮生长状态,经过IL-2和IL-4的促进生长作用,细胞数量缓慢增加,13 d左右的可达到饱和状态(细胞数量为5×106/ml),见图1。
图1 DNT细胞形态 ×200
2.2FasmRNA在3种胰腺癌细胞中的表达差异PCR结果显示mRNA在3种胰腺癌细胞中表达均有表达,3组之间的差异有统计学意义(F=211.56,P<0.05),相互比较结果显示Capan-1表达量低于BXPC-3(P<0.05),Panc-1表达量高于BXPC-3(P<0.05),见图2。
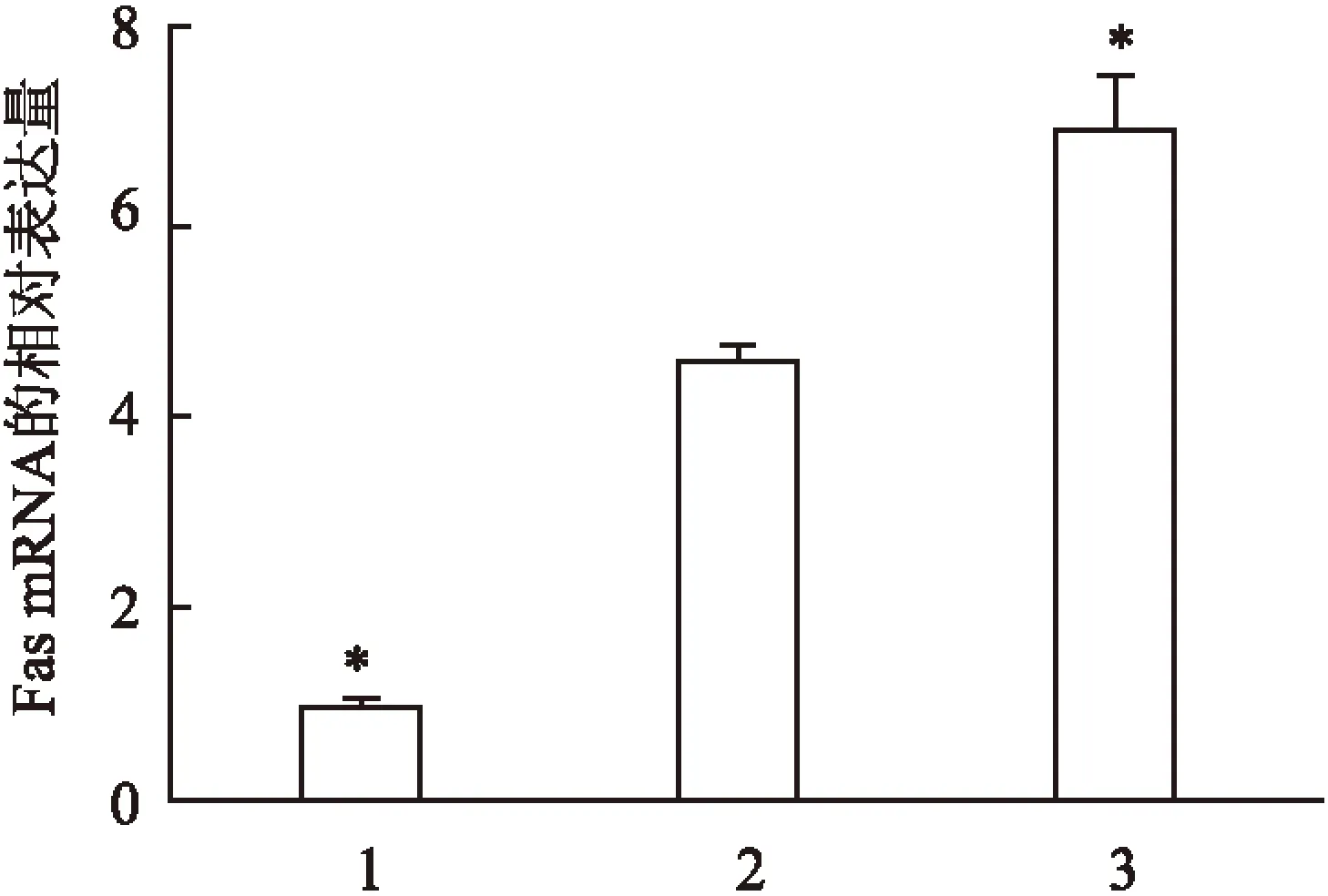
图2 3种胰腺癌细胞中Fas mRNA的表达情况
1: Capan-1; 2: BXPC-3; 3: Panc-1; 与BXPC-3细胞比较:*P<0.05
2.3Fas蛋白在3种胰腺癌细胞中的表达差异Western blot结果显示Fas蛋白在3种细胞中均有较高表达,由低到高顺序为Capan-1、BXPC-3、Panc-1。见图3、4。
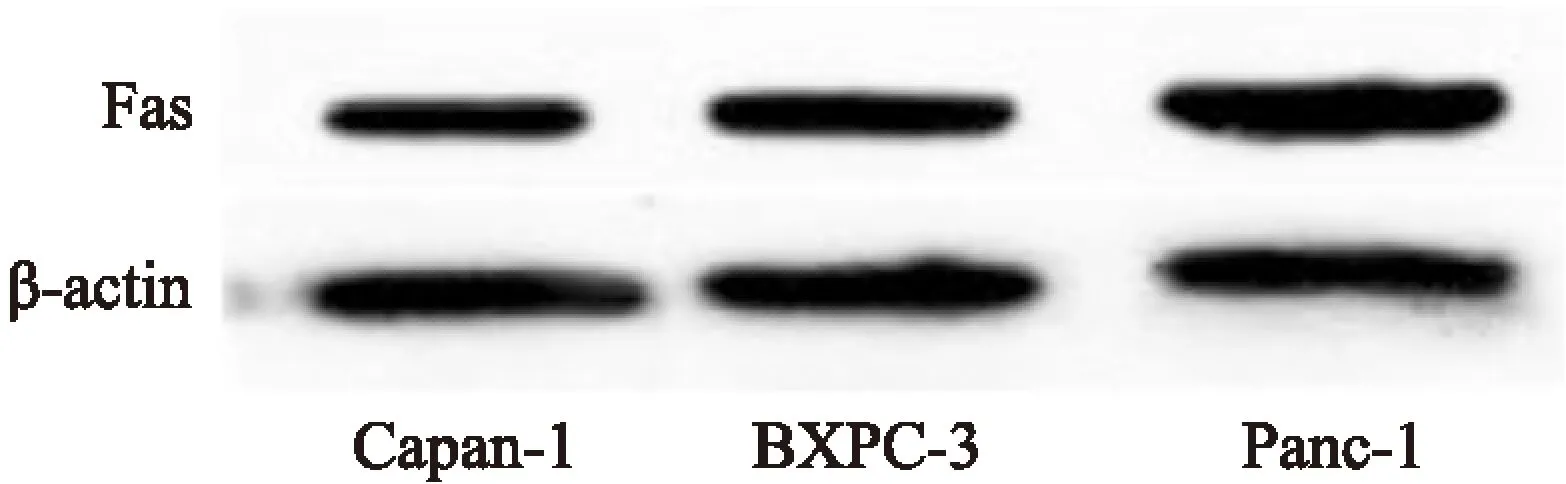
图3 3种胰腺癌细胞中Fas蛋白的表达情况
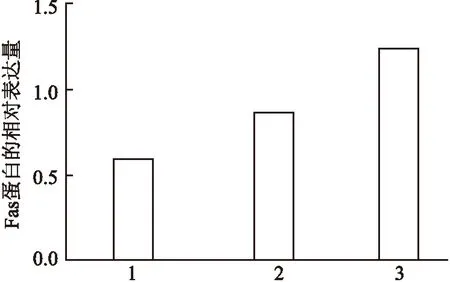
图4 3种胰腺癌细胞中Fas蛋白的表达量1:Capan-1; 2: BXPC-3; 3:Panc-1
2.4sFasL在DNT细胞培养液中的含量ELISA法检测了20例健康人外周血来源分离培养的DNT细胞(5×106/ml)上清液以及未培养DNT细胞的上清液,结果显示培养DNT细胞组上清液中sFasL含量为(64.52±2.21)pg/ml,对照组上清液中含量为(55.68±1.95)pg/ml,差异有统计学意义(t=3.00,P<0.01)。见图5。
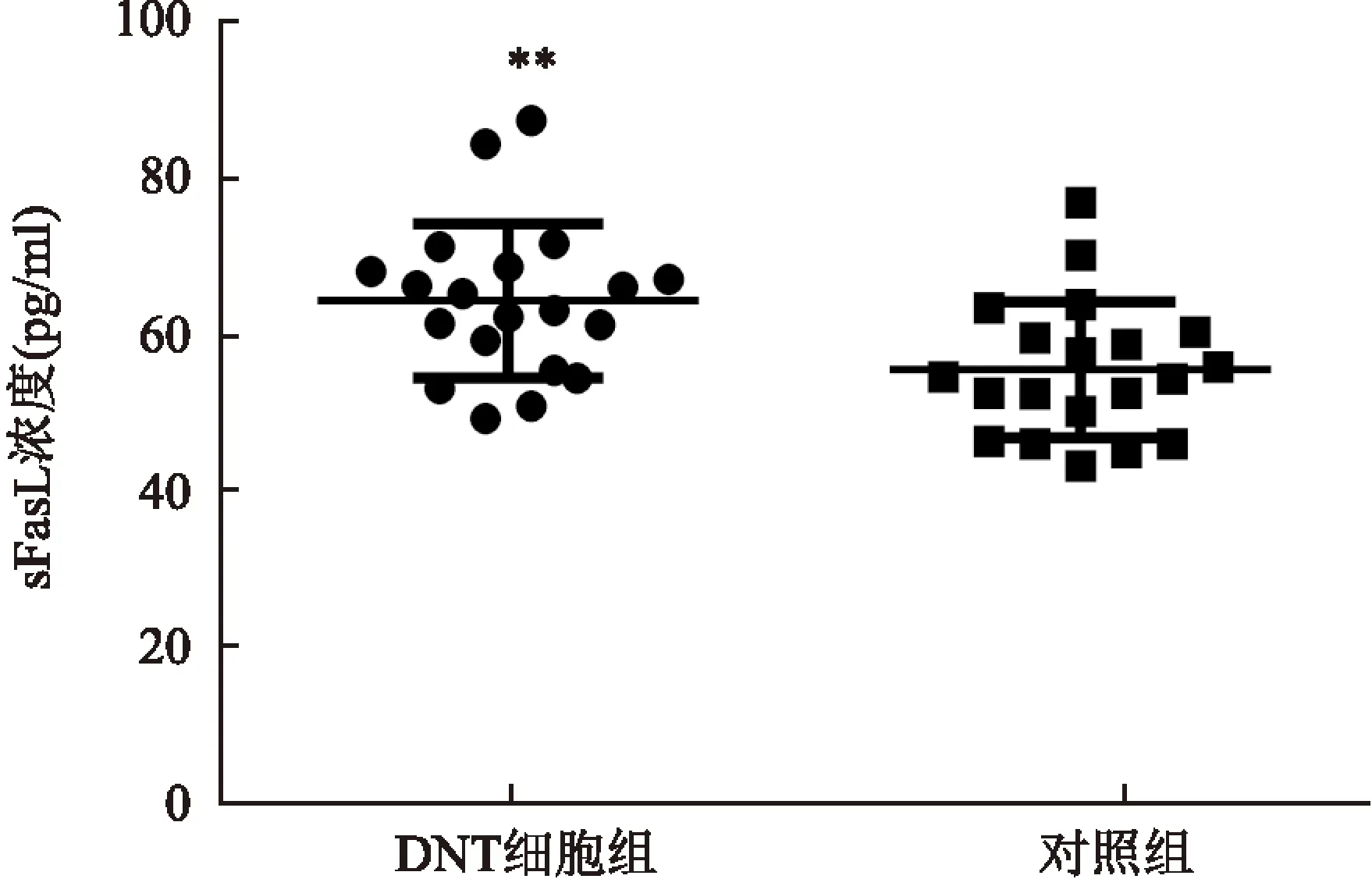
图5 DNT细胞上清液和对照组中sFasL的含量与对照组比较:**P<0.01
2.5Fas在胰腺癌和癌周组织中的表达免疫组化结果显示Fas蛋白主要的表达部位是在细胞质,胰腺癌组织的阳性表达率为42%(25/60),在癌周组织的阳性表达率为68%(41/60),差异有统计学意义(χ2=8.62,P<0.05)。见图6。
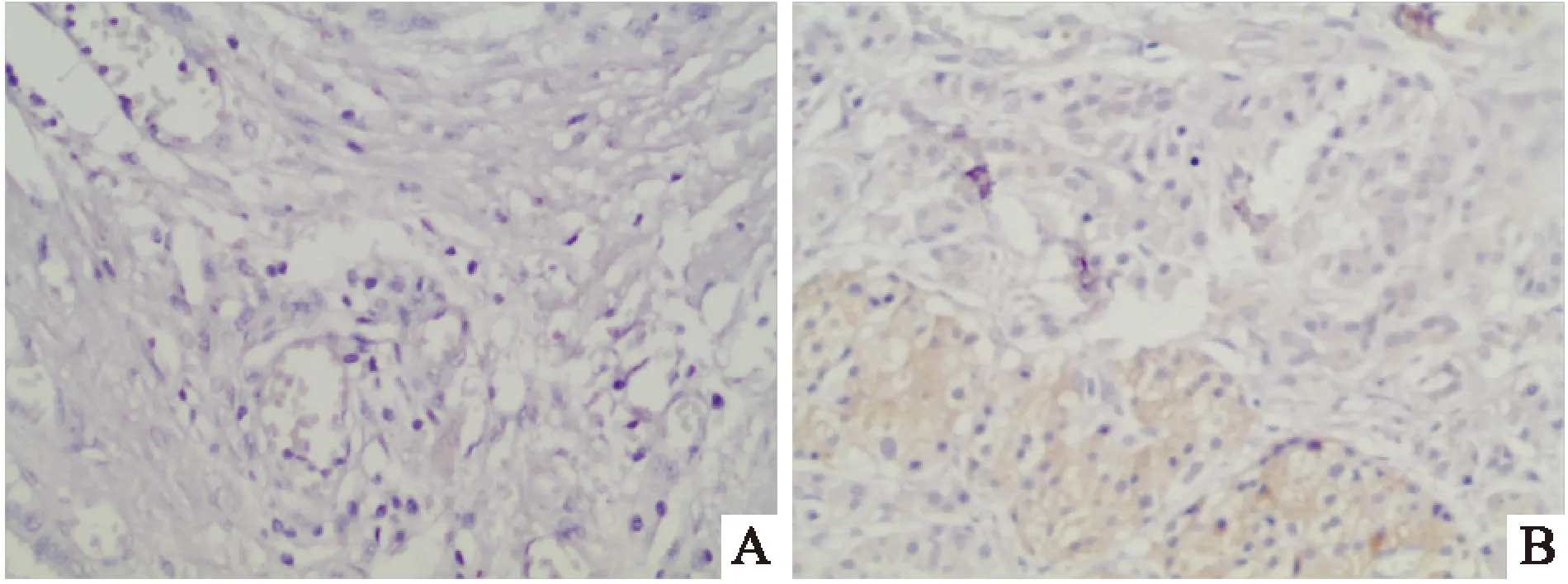
图6 Fas蛋白在胰腺癌和癌周组织中的表达情况 ×200
A:Fas在胰腺癌组织中的阴性表达;B:Fas在胰腺癌周组织中的阳性表达
2.6Fas的表达与临床资料的相关性Fas在胰腺癌组织中的表达与肿瘤的分化程度、神经浸润有关(χ2=5.659、6.251,P<0.05),而与患者性别、年龄、肿瘤位置、肿瘤分期、有无淋巴结转移等无关。见表1。
表1胰腺癌组织中Fas蛋白的表达与临床病理关系(n)
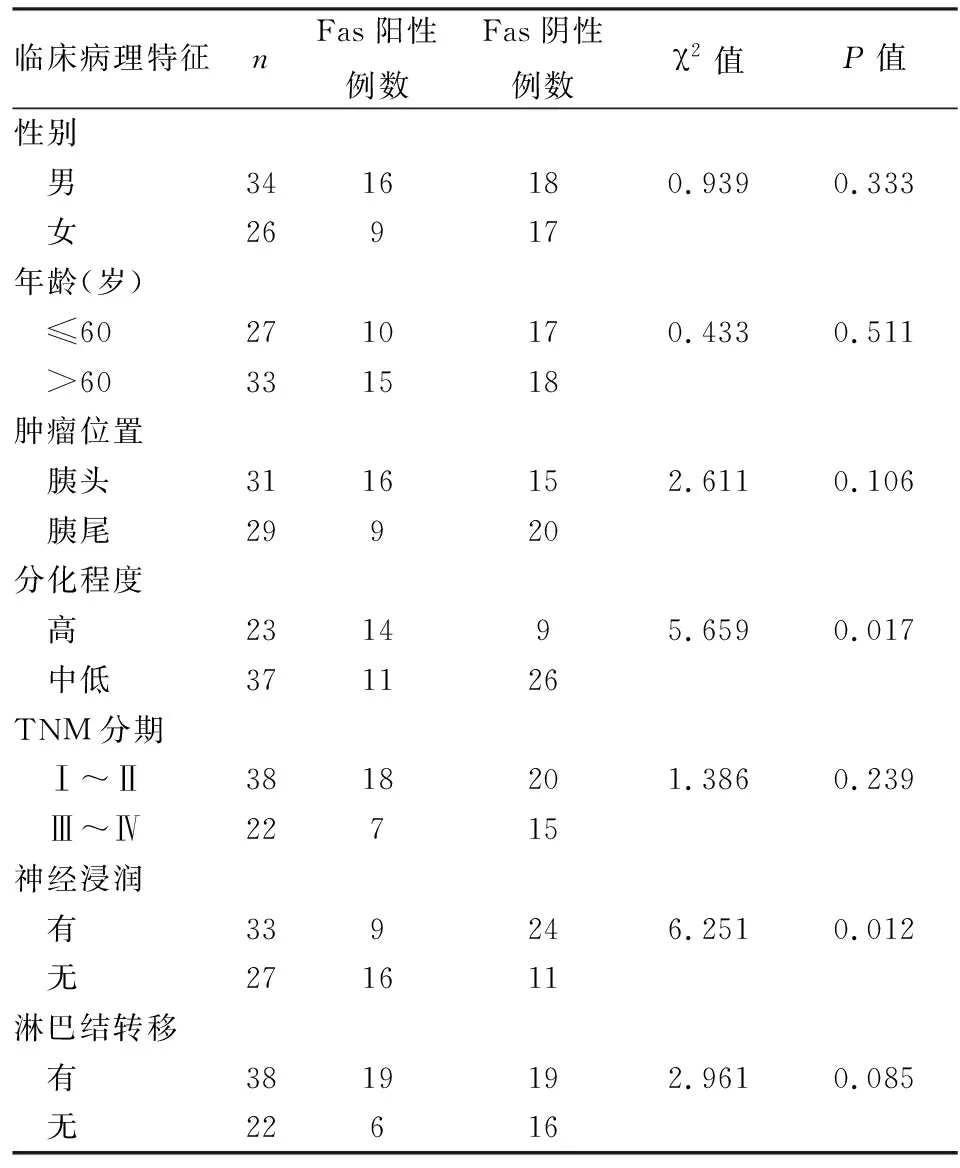
临床病理特征nFas阳性例数Fas阴性例数χ2值P值性别 男3416180.9390.333 女26917年龄(岁) ≤602710170.4330.511 >60331518肿瘤位置 胰头3116152.6110.106 胰尾29920分化程度 高231495.6590.017 中低371126TNM分期 Ⅰ~Ⅱ3818201.3860.239 Ⅲ~Ⅳ22715神经浸润 有339246.2510.012 无271611淋巴结转移 有3819192.9610.085 无22616
3 讨论
胰腺癌是恶性程度极高的消化道肿瘤,虽然现代外科技术的发展使胰十二指肠切除术围手术期死亡率降至5%以下,但是30年来胰腺癌的长期存活率并未发生显著改变。DNT细胞在各项疾病中均起到了关键的治疗作用,特别是其抗肿瘤作用已成为人们关注的点。Lee et al[5]研究发现DNT细胞可以抑制急性白血病细胞的生长。Xu et al[6]通过实验证明了DNT细胞通过NK细胞活化性受体(NKG2D) 及其配体主要组织相容性复合体I类相关基因A(MICA)途径杀伤胰腺癌细胞。最近有研究[4]报道sFasL/Fas可以介导杀伤肺癌细胞。而本研究在DNT细胞上清液中检测出了sFasL的表达,同时在胰腺癌细胞中检测出其受体Fas的高表达,所以笔者有理由推测DNT细胞可以通过分泌sFasL与胰腺癌细胞表面的Fas结合介导杀伤胰腺癌细胞。
Fas是属于TNF受体超家族成员的I型跨膜蛋白,与肿瘤坏死因子(TNF)受体具有一定的同源性。Fas的基因位于10号染色体,其基因分子长度为25 kb,共编码了325个氨基酸。Fas蛋白可分为膜表达型(mFas)和可溶型(sFas)两种形式。mFas分为3个部分:胞外部分、跨膜部分、胞内部分,其中胞内含有死亡结构域,可传递细胞凋亡信号。FasL属于TNF配体超家族,是一种分子量40 ku的Ⅱ型跨膜蛋白,其基因位于1号染色体,共编码281个氨基酸,其蛋白分子同样也分为膜型(mFasL)和可溶型(sFasL)。Fas与FasL在体内是天然的受体与配体关系。Fas与FasL结合后,凋亡信号开始传递,受体分子中的死亡结构域构像改变,然后通过与死亡结构域相关蛋白(Fas-associated death domain, FADD)的C末端结合传递信号,信号在FADD中又通过N末端与caspase8结合,开启半胱氨酸蛋白酶(caspase)分子的级联反应,使得细胞凋亡[7-9]。Fas与FasL的结合,是细胞凋亡的关键步骤,所以癌细胞表面Fas受体的表达量对研究FasL是否参与细胞凋亡具有重要意义。
表达Fas的靶细胞与FasL结合后,靶细胞就会被诱导进入死亡程序,维持着人体细胞凋亡与增殖的平衡[10]。本研究在胰腺癌细胞和组织中均检测了Fas的表达情况,其结果为:Fas mRNA在3株胰腺癌细胞中均有表达且存在一定差异,Fas蛋白在胰腺癌细胞中均有较高表达且表达差异与RNA的表达差异一致。而在免疫组化法检测胰腺癌组织和癌周组织的结果中显示:Fas蛋白在胰腺癌组织中表达较癌周组织表达较低,且低分化组织中的表达量明显低于高分化组织。从中可以表明,Fas在胰腺癌组织中的表达下调,与其配体FasL的结合减少,导致胰腺癌细胞凋亡减少,发生免疫逃逸,细胞凋亡与增殖的动态平衡被打破,使得胰腺癌快速的发生发展得以进行。

