p53通过调控长链非编码RNA lncRNAp53urlnc对舌鳞癌细胞的影响
周 洁,朱友明,邹多宏
非编码RNA(noncoding RNA)是人类基因中不编码蛋白质的RNA,是人类基因转录过程中不可缺少的一部分,主要包括短链、中链、长链非编码RNA[1]。长链非编码RNA(long non-coding RNA,lncRNA)是指长度大于200 nt的非编码蛋白,是非编码RNA的重要组成部分,由于其特定的位置及功能,近年来越来越多的实验证明可以运用lncRNA作为肿瘤的生物标志物和治疗的靶向[2]。p53是一种重要的抑癌基因,自1979年被首次报道以来,p53作为抑癌基因的功能逐渐被揭示,且有研究[3]显示lncRNA的一部分与p53基因通路相一致,这暗示着lncRNA与p53基因在细胞水平上存在联系。鉴于此,本课题组运用基因芯片技术筛选了一个表达受p53正调控的新lncRNA(ENST00000437008),命名为lncRNAp53urlnc(p53 upregulated lncRNA),作为研究对象。该研究主要是为了验证p53和lncRNAp53urlnc之间的关系,探讨其对舌鳞癌细胞的影响,希望为临床应用提供一定的实验基础。
1 材料与方法
1.1细胞人舌鳞癌细胞系SCC3、人胚胎肾细胞系293T、大肠杆菌DH5α均由安徽医科大学口腔医学实验室提供和保存。
1.2主要试剂和仪器高糖DMEM、胎牛血清(美国Gibco公司);PBS缓冲液(美国Solarbio公司);胰蛋白酶、嘌呤霉素四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂(美国Sigma公司);慢病毒包装试剂(上海和元技术有限公司);蛋白定量试剂盒、CO2恒温孵箱(美国Thermo公司);shlncRNAp53urlnc质粒、shctrl质粒、PCR引物(上海生工生物工程股份有限公司);actin抗体、p53抗体(美国Santa Cruz公司);山羊抗兔二抗 (北京中杉金桥生物技术有限公司);RNA提取试剂盒(美国Promega公司);逆转录试剂盒、qRT-PCR试剂(日本TaKaRa公司);DNA片段回收试剂盒、质粒提取试剂盒(美国Axygen公司);二甲基亚砜(dimethylsulfoxide,DMSO)(上海碧云天生物技术有限公司);实时荧光定量 PCR 仪(美国Stratagene 公司);落地恒温振荡器(上海一恒科学仪器有限公司)。
1.3方法
1.3.1细胞培养 应用含10%胎牛血清的高糖DMEM培养液培养SCC3和293T细胞,置于37 ℃、5% CO2恒温恒湿培养箱内培养。当细胞增殖融合达培养皿80%时,使用0.25%胰蛋白酶消化细胞,按1×104/cm2密度传代培养。取生长状态良好的SCC3和293T细胞用于本研究。
1.3.2药物处理 为了寻找到新的受p53调控的lncRNA,本课题组对含有p53诱导上调系统的H1299细胞进行基因芯片分析(H1299细胞以及相应的基因芯片分析由中国科学技术大学吴缅实验室完成与提供),发现了大量的受p53诱导上调和下调的lncRNA。本课题组对其中上调和下调倍数较高的lncRNA进行了验证,其中一条lncRNA(ENST00000437008)上调变化倍数较明显,本课题组将其命名为lncRNAp53urlnc(p53 upregulated lncRNA),lncRNAp53urlnc是一个位于3号染色体长度为838 bp的长片段非编码RNA,lncRNAp53urlnc共含有5个外显子。收集生长状态良好的对数期H1299细胞,制成细胞悬液,以1×106个/孔细胞数接种到6孔板继续培养。次日,使用含1 μg/ml盐酸阿霉素的PBS处理H1299细胞,分别于0、6、12 h收集相应时间点获取H1299细胞的RNA和蛋白,使用Western blot法检测细胞中p53的表达,使用qRT-PCR检测细胞中lncRNAp53urlnc的表达。
1.3.3重组质粒载体的构建 本实验主要使用polk.1和flag质粒载体构建6个质粒载体,具体分为以下3组:① plko.1-shp53及plko.1-shp53-ctrl(中国科学技术大学吴缅实验室获取);② flag-p53及flag空载体(中国科学技术大学吴缅实验室获取);③plko.1-shlncRNAp53urlnc及plko.1-shlncRNAp53urlnc-ctrl。载体引物由上海生工技术服务有限公司设计和合成。Sh-lncRNAp53urlnc-1与Sh-lncRNAp53urlnc-2序列如下: Sh-lncRNAp53urlnc-1:5′-CCGGTATGGGAGGTCTCTGAGATCTCGAGATCTC AGAGACCTCCCATATTTTTG-3′;Sh-lncRNAp53urlnc-2:5′-AATTCAAAAATATGGGAGGTCTCTGAGATCTG AGATCTCAGAGACCTCCCATA-3′。
1.3.4慢病毒包装和转染SCC3
1.3.4.1慢病毒包装 收集对数期生长状态良好的293T细胞,选择合适的密度接种于6孔板上,带细胞增殖融合至培养皿50%时,分别取携带上述目的基因片段的载体(2 μg)和病毒包装质粒(2 μg pGag、2 μg pRev、1 μg pVsvg)共转染293T细胞,完全培养基培养48 h,收集上清液,0.45 μm PVDF滤器过滤,分装,-80 ℃冰箱储存。
1.3.4.2慢病毒转染 转染前1 d,收集对数期生长状态良好的SCC3细胞,选择合适的密度接种于6孔板上,带细胞增殖融合至培养皿30%时,加入各病毒液以及2 μl的8 μg/ml polybrene,孵育4 h后加入嘌呤霉素筛选1~2周。
1.3.5qRT-PCR检测 慢病毒转染后,分别提取转染后各组SCC3细胞中的总RNA,进行qRT-PCR定量检测各组lncRNA的表达水平。使用TRIzol提取试剂盒,按操作指南,分别提取各组细胞的总RNA。采用PrimeScriptTMRT-PCR kit逆转录试剂盒合成相应cDNA 。qRT-PCR检测lncRNAp53urlnc和actin基因的相对表达量,实时定量仪检测。所有测定进行3次重复。所有PCR引物由上海生工生物工程公司进行设计,引物序列见表1。
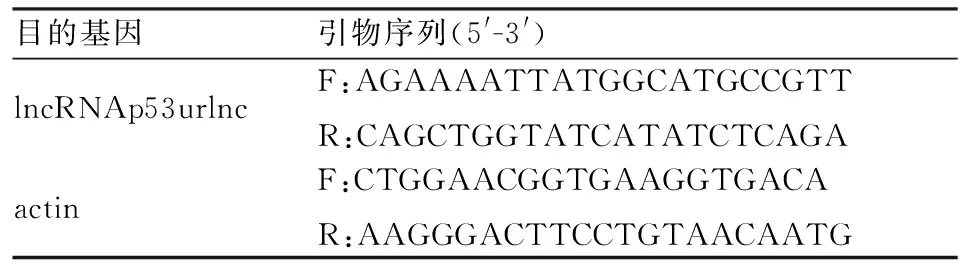
表1 基因扩增引物序列表
1.3.6Western blot检测 慢病毒转染后,分别于第3天收集细胞,PBS液离心漂洗细胞3次。使用RIPA蛋白裂解液提取蛋白,BCA试剂盒测定各样本蛋白的浓度,选择12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白。根据蛋白分子量的大小选择电泳时间,然后转膜至PVDF膜。5%脱脂蛋白在室温下封闭2 h后,将膜在p53和actin特异性一抗中4 ℃孵育过夜。TBST清洗3次,加入对应二抗,室温孵育1 h,TBST清洗3次。发光检测仪曝光后收集相应发光信号,分析各组p53相对表达量。所有测定进行3次重复。
1.3.7MTT法检测 选择对数生长期状态良好的SCC3细胞分别转染shlncRNAp53urlnc和shctrl后,按2×103个/孔均匀接种于96孔板,每组设3个复孔,每孔加入200 μl的DMEM培养液,置于37 ℃、5% CO2恒温恒湿培养箱中,分别培养0、6、12、24、48、72 h后,加入MTT(5 mg/ml)20 μl/孔,继续培养4 h后吸去孔内培养液,加入DMSO 150 μl/孔,避光低速震荡10 min。使用酶联免疫检测仪测定各孔吸光度值,绘制各组细胞生长曲线。所有测定进行3次重复。
1.3.8集落形成实验检测 选取生长状态良好的对数期shlncRNAp53urlnc和shctrl组的SCC3细胞,常规消化传代,细胞计数后调整细胞浓度,以3×102个/孔接种于6孔板中,每孔加含10%胎牛血清DMEM培养液2 ml,培养14 d。吸去培养液,PBS清洗3遍,4%多聚甲醛固定15 min后使用1%结晶紫染液染色4 h,清洗晾干,肉眼观察,拍照。
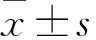
2 结果
2.1p53上调lncRNAp53urlnc表达阿霉素处理H1299细胞后,分别获取H1299细胞的RNA和蛋白,使用Western blot法检测细胞中p53的表达,使用qRT-PCR法检测细胞中lncRNAp53urlnc的表达。经过0、6、12 h梯度时间点显示,p53和lncRNAp53urlnc的表达均随着时间而增大,与芯片结果一致。见图1。
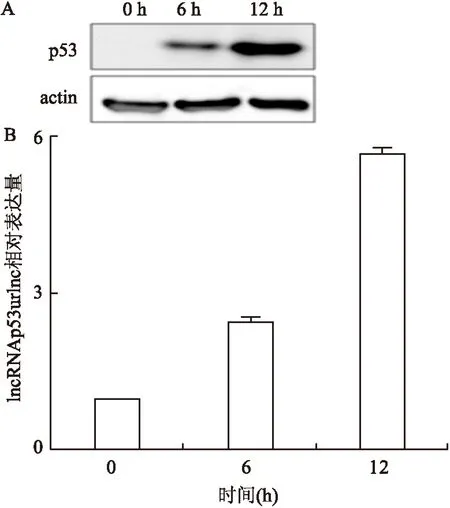
图1 阿霉素处理H1299细胞后p53和lncRNAp53urlnc的变化
A:加入阿霉素后p53的表达情况;B:加入阿霉素后lncRNAp53urlnc的表达情况
2.2敲低和过表达p53对SCC3细胞中lncRNAp53urlnc表达的影响为了研究lncRNAp53urlnc与口腔癌的关系,本课题组包装shctrl和shp53病毒,并分别感染SCC3细胞,使用Western blot法检测细胞中p53的表达,qRT-PCR法检测细胞中lncRNAp53urlnc的表达。结果显示,shp53组p53表达明显低于shctrl组,同时shp53组lncRNAp53urlnc的表达也明显低于shctrl组(shp53组: 0.283±0.419,shctrl组:1.030±0.638,F=217.558,P=0.001),见图2 ;flag空载体和flag-p53转染SCC3细胞后,使用Western blot法检测细胞中p53的表达,qRT-PCR法检测细胞中lncRNAp53urlnc的表达,结果显示:flag-p53组p53表达水平明显高于flag组,同时flag-p53组lncRNAp53urlnc的表达水平也明显高于flag组(flag-p53组:4.725±0.188, flag组:1.021±0.970,F=851.028,P<0.001),见图3。以上结果表明:lncRNAp53urlnc的表达与p53呈正相关性。
图2 敲低p53表达对SCC3细胞中SCC3细胞中lncRNAp53urlnc表达的影响
A:shctrl组和shp53组p53蛋白的表达;B:shctrl组和shp53组lncRNAp53urlnc的表达;与shctrl组比较:**P<0.01

图3 过表达p53对SCC3细胞中lncRNAp53urlnc表达的影响
A:flag组和flag-p53 组p53蛋白的表达;B:flag组和flag-p53 组lncRNAp53urlnc的表达;与flag组比较:***P<0.001
2.3shlncRNAp53urlnc干扰lncRNAp53urlnc的表达使用qRT-PCR法检测shlncRNAp53urlnc组和shctrl组中lncRNAp53urlnc的表达水平,结果显示shlncRNAp53urlnc组lncRNAp53urlnc的水平明显低于shctrl组(F=191.201,P<0.05)。这表明shlncRNAp53urlnc成功下调lncRNAp53urlnc的表达。见图4。
2.4shlncRNAp53urlnc对SCC3细胞生长的影响MTT细胞增殖实验检测感染shlncRNAp53urlnc病毒后SCC3细胞增殖能力,结果显示shlncRNAp53urlnc组细胞增殖速度明显高于shctrl组。采用集落形成实验来检测shlncRNAp53urlnc组SCC3细胞集落形成能力,经过14 d显示:shlncRNAp53urlnc组细胞形成的集落数量明显高于shctrl组(F=111.722,P<0.05)。结果表明:敲低SCC3细胞中lncRNAp53urlnc的表达可以促进细胞增殖生长。见图5、6。
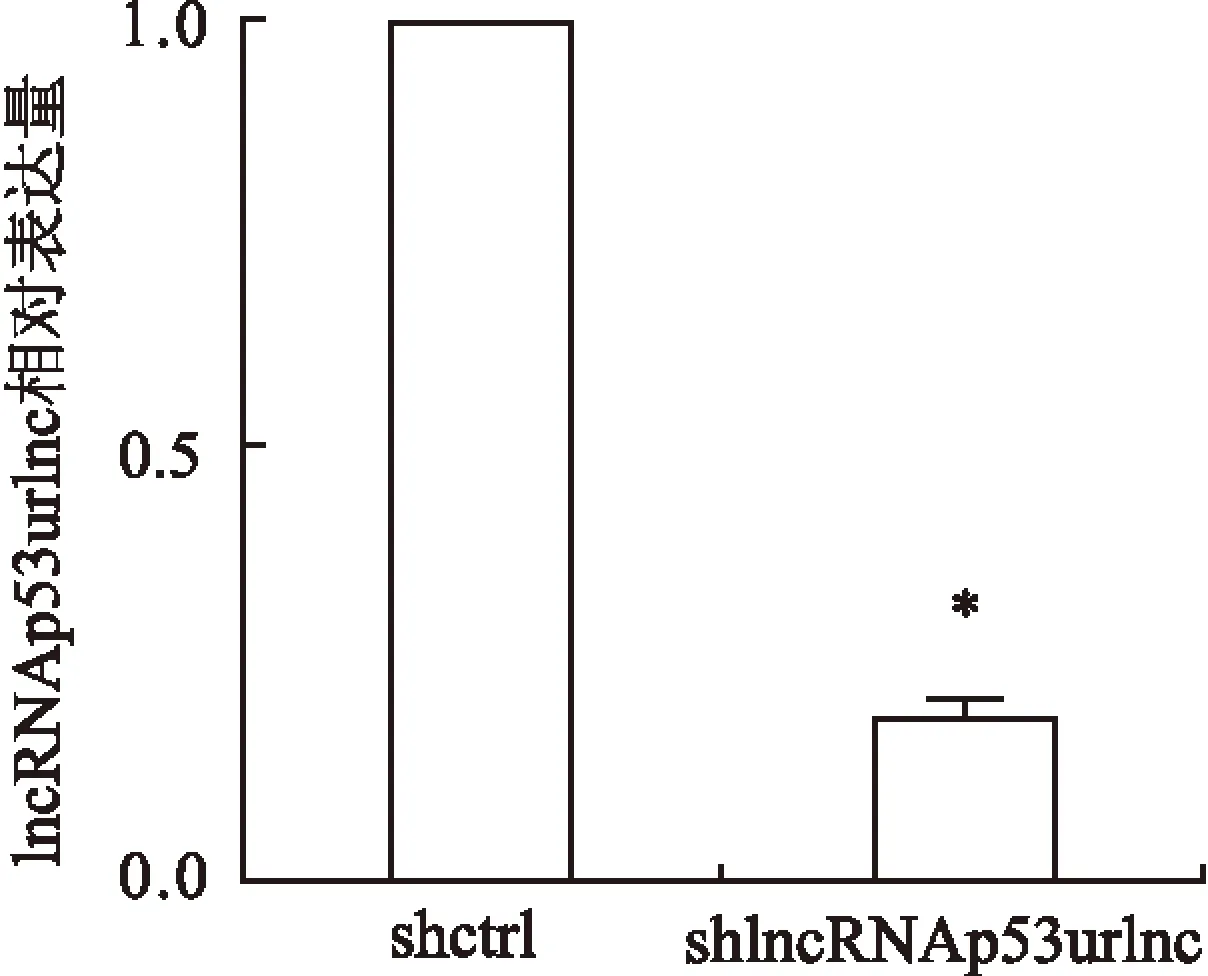
图4 转染shlncRNAp53urlnc目的基因后对SCC3细胞中lncRNAp53urlnc表达的影响
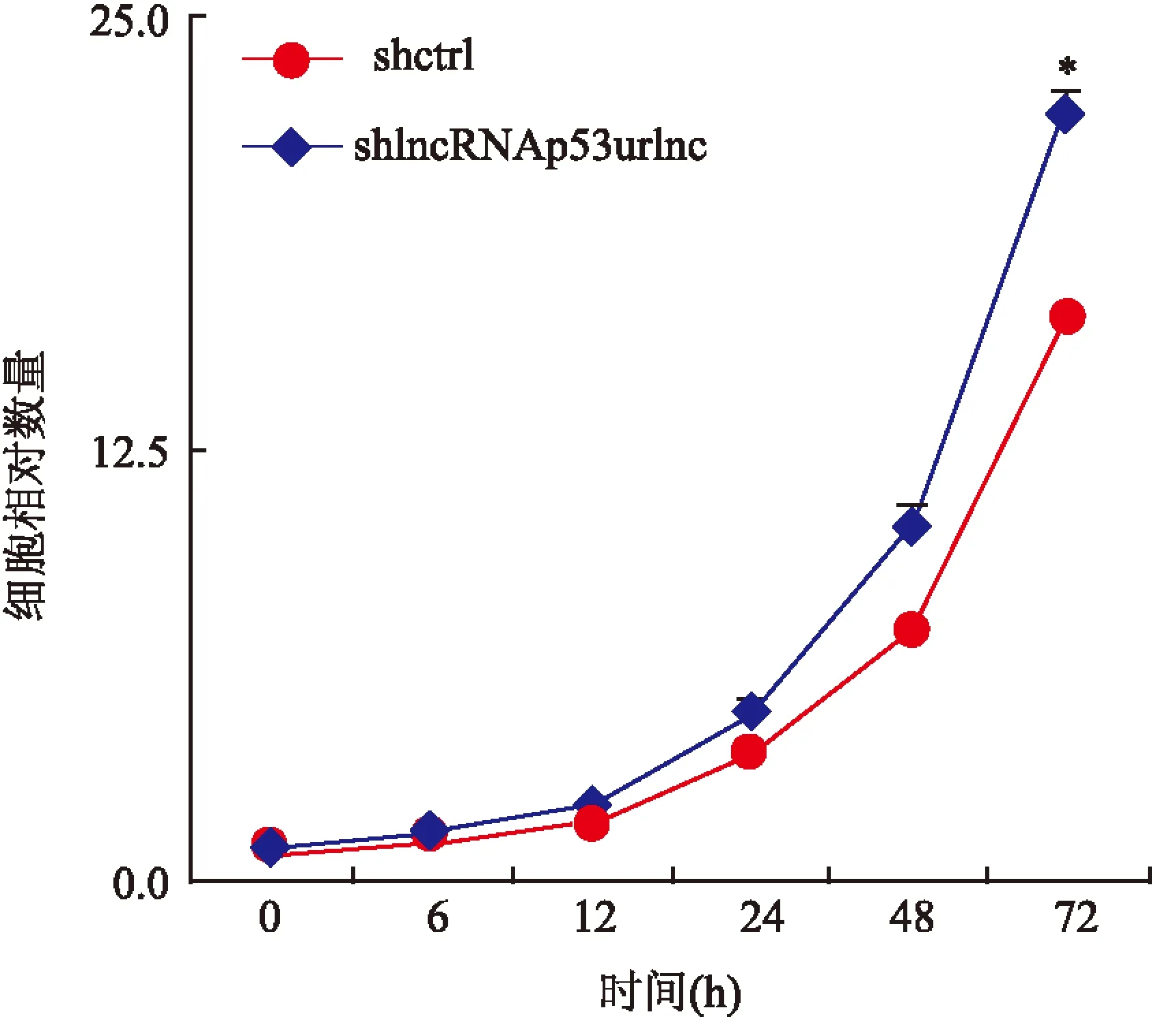
图5 MTT法检测shlncRNAp53urlnc组SCC3细胞数量的变化

图6 集落形成实验检测shlncRNAp53urlnc组SCC3细胞集落情况与shctrl组比较:*P<0.05
3 讨论
p53作为重要的肿瘤抑制基因,可能通过抑制与DNA复制相关的细胞基因或基因产物而发挥作用,包括阻滞细胞周期、促进细胞凋亡、维持基因组稳定、抑制肿瘤血管生成等。长链非编码RNA(lncRNA)是长度大于200个核苷酸的非编码RNA。研究[3]表明, lncRNA 在剂量补偿效应、表观遗传调控、细胞周期调控和细胞分化调控等众多生命活动中发挥重要作用,lncRNA参与了X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰、核内运输等多种重要的调控过程,其表达或功能异常与癌症、退行性神经疾病等关系密切, 具体表现在序列和空间结构上的异常、表达水平的异常、与结合蛋白相互作用的异常等。研究[3]显示lncRNA和p53信号通路存在显著的相关性。
p53的反应过程是一个快速的活化过程,并且对细胞存亡有着精密的调控机制,受多种因素调控,例如蛋白质和RNA等。p53蛋白的翻译后调控是控制p53活化结果的一个重要因素[4-6]。调控p53的一个关键因素就是MDM2蛋白,可以通过泛素蛋白酶体途径结合p53来控制自身的稳定性[7-8]。这样的磷酸化结果可以通过抑制p53泛素化来维持p53的稳定,并且特定残基的磷酸化也许是调节p53激活的一条重要途径[9-10]。除了蛋白质,其他类型的调控分子也可以参与p53的调控,例如microRNA[7]。目前多种肿瘤研究表明,功能性长链非编码RNA与p53存在着密切联系。
长链非编码RNA主要存在于细胞核与细胞质中的一类RNA,通过将染色质复合物调节到合适的目的基因序列中来实现可调节的特异性[10]。lncRNA可以调节转录过程,调节细胞周期,部分lncRNA可以与基因沉默有关的染色质修饰物结合来调节转录抑制,如Polycomb组(PCG)蛋白、组蛋白H3赖氨酸9(H3K9甲基化,组蛋白赖氨酸甲基化酶)等;另一方面,部分lncRNA可以通过与表观遗传活化因子的相互作用来促进转录激活,如H3K4甲基转移酶MLL1复合物[11]。lncRNA-p21是最早发现的影响p53转录的核心组件之一,研究[12]显示lncRNA下调和抑制p53所产生的基因库存在大部分的重叠,这也就说明lncRNA-p21是抑制p53表达的主要RNA,此类RNA主要抑制核糖核蛋白K(hnRNP K),这类蛋白是在p53信号通路中作为阻遏基因,与相关基因结合从而抑制p53的合成。lncRNA以往一直作为癌基因或抑癌基因来研究,但近年来越来越多的实验[3]证明lncRNA和p53信号通路存在显著的相关性。大量研究[13]已证实p53可以诱导促进lncRNA的生成,而lncRNA也可以通过结合特殊位点影响染色质的构象来促进p53是表达,lncRNA与p53的相互作用可以进一步抑制肿瘤细胞的生长。
舌鳞癌是口腔鳞状细胞癌中最常见的一种肿瘤,鉴于p53和lncRNA对肿瘤特殊作用,本课题组进行了本研究并加以验证。实验表明:细胞在用阿霉素诱导后,p53表达逐渐上调,同时伴随着lncRNAp53urlnc的上调。构建重组基因载体,分别敲低和过表达SCC3细胞中的p53基因,结果显示,敲低p53表达时,lncRNAp53urlnc水平下调;过表达p53基因时,lncRNAp53urlnc水平上调,证实lncRNAp53urlnc与p53水平呈正相关性。进一步实验显示敲低lncRNAp53urlnc可以SCC3促进细胞增殖。因此,可以得出结论,p53通过正调控lncRNAp53urlnc来抑制SCC3细胞的增殖。但lncRNAp53urlnc是如何受p53基因调控的分子机制仍有待进一步的研究。

