蓝细菌生物标志物
——2-甲基藿烷类化合物研究进展及其应用
张俊杰 ,邢 磊 ,侯 笛
1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,青岛 266100
2.中国海洋大学 海洋有机地球化学研究所,青岛 266100
蓝细菌(cyanobacteria)是一类可以进行产氧光合作用的古老原核自养型微生物,分布广泛,数量庞大,具有极强的环境适应能力,在海洋湖泊(Bergman,2001;Farrimond et al,2004;Talbot and Farrimond,2007)、极地冻土(Höfle et al,2015)甚至热液温泉(Zhang et al,2007)中都有发现。其起源可以追溯到27亿年前,早在元古代时期,蓝细菌就作为海洋中主要的初级生产者在碳循环过程中发挥重要作用(Summons et al,1999;Tomitani et al,2006)。现代研究显示:仅微微型蓝细菌,例如聚球藻属(Synechococcus)和原绿球藻属(Prochlorococcus),就贡献了全球海洋一半的生产力(Bergman,2001)。此外,部分蓝细菌还具有固氮能力(Capone et al,1997;Neveux et al,1999;Bergman,2001),并且在全球海洋固氮贡献中占有巨大比例。例如:全球海洋每年的总固氮量大概为 240 Tg · a-1(以氮计)(1 Tg = 1012g),而蓝细菌束毛藻属(Trichodesmium)的固氮量就达到 87.4 Tg · a-1,约占海洋总固氮量的36%(Gallon,2001)。因此研究地质时期海洋蓝细菌的分布与含量变化对了解海洋碳、氮循环及重建古环境具有重要意义。
由于蓝细菌大多个体微小,生存周期极短,想要了解其在地质时期的演变和生物地球化学作用,需要借助沉积物中的微生物分子化石——生物标志物(Ricci et al,2014)作为研究媒介。通常讲,生物标志物是指一种由特定生物产生的性质相对稳定的有机化合物,能记录特定的母源信息,并且基本结构能在颗粒物沉降和成岩过程中较好地保存(Schubert et al,1998)。对于蓝细菌而言,目前所研究的生物标志物涵盖了一些支链烷烃(Köster et al,1999;Kenig,2000;Jahnke et al,2004)、异形胞糖脂(heterocystous glycolipids,HGs)(Schouten et al,2013;Bale et al,2015;Rush and Sinninghe Damsté,2017)和 2-甲基藿烷(多醇)(2-Methylhopanoids)(Summons et al,1999;Talbot et al,2003a;Bechtel et al,2007;Talbot and Farrimond,2007)等。支链烷烃主要是某些含有1 — 3个甲基的短链支链烷烃(C17— C20),这些烷烃在大量的蓝细菌和微生物席中都有发现(Shiea et al,1990;Köster et al,1999)。 因 为结构上存在碳数和甲基位置的变化,所以支链烷烃变化较多,仅在眉藻(Calothrix scopulorum)中就检出了21种不同的支链烷烃(Köster et al,1999)。而且不同蓝细菌属种中检出的主要支链烷烃也不尽相同。比如:蓝细菌泥褐席藻(Phormidium luridum)中检测到的主要是7,11-二甲基十七烷(Summons et al,1996),而眉藻中主要是4,13-、5,13-和4,5-二甲基十七烷(Köster et al,1999)。此外,实验还发现部分蓝细菌产生支链烷烃的含量也可能会受到环境因素(二氧化碳浓度)和培养时间的影响(Summons et al,1996)。异形胞糖脂是很多固氮蓝细菌异形胞壁包被层的主要成分,可以很好地保存在古沉积物和微生物席中,所以被用作固氮蓝细菌独有的生物标志物(Bale et al,2015;Rush and Sinninghe Damsté,2017)。异形胞糖脂结构上主要表现为六碳糖(也有的是五碳糖)连接长链(C26— C32)二醇(diols)、三醇(triols)或相应的酮醇(keto-ols)和酮二醇(keto-diols)(Gambacorta et al,1998),不同固氮异形蓝细菌中主要的异形胞糖脂不同,因此这种生物标志物还具有明显的分类指示的特点(Bauersachs et al,2013)。例如:伪枝藻科(Scytonemataceae)中主要含有C30HG triols 和 keto-diols(Gambacorta et al,1998);胶须藻科(Rivulariaceae)中主要是C28HG triols和 keto-ol(Bauersachs et al,2009); 五 碳 糖 结构的异形胞糖脂主要来自海洋环境中与硅藻共生的异形蓝细菌(Schouten et al,2013;Bale et al,2015)等。因此异形胞糖脂仅能作为固氮异形蓝细菌特有的生物标志物(Bauersachs et al,2013;Bale et al,2015)。2-甲基藿烷类化合物是蓝细菌细胞膜的主要成分,相对于支链烷烃和异形胞糖脂具有更全面的指示意义,加上该类化合物广泛地存在于古老地层、沉积物、土壤和微生物席中,在估测蓝细菌的生物量和群落结构,了解地质时期碳、氮循环过程及重建古环境等方面都起到了重要作用(Summons et al,1999;Talbot et al,2003a;Bechtel et al,2007;Talbot and Farrimond,2007;李志阳等,2013;Garby et al,2013;Saito et al,2016)。本文主要针对具有多年研究历史和广泛应用的二甲基藿烷类化合物的研究进展和应用进行了总结,指出目前研究中存在的问题,并展望了未来此类化合物作为蓝细菌生物标志物的研究方向。
1 2-甲基藿烷类化合物
作为被研究最多的蓝细菌生物标志物,2-甲基藿烷类化合物主要分为两类:2-甲基藿烷和它的前体物质——2-甲基藿多醇(2-Methylbacteriohopanepolyols, 简称 2-MeBHPs)。2-甲基藿多醇被大量发现于沉积物和现代实验室培养的蓝细菌中,因此被认为有潜力作为研究蓝细菌及其光合作用进程的生物标志物(Summons et al,1999)。
2-甲基藿多醇是一类具有特殊结构的细菌藿多醇,表现为在细菌藿多醇A环的2号碳上发生甲基化。细菌藿多醇(Bacteriohopanepolyols,简称BHPs)是原核生物的细胞膜脂,作用类似于真核细胞中的固醇类化合物,可以增强细胞膜的稳定性。但是与固醇类化合物不同的是,这类物质主要由细菌产生,并且不需要氧气参与合成过程(Ourisson et al,1987;Rashby et al,2007)。 细菌藿多醇广泛存在于包括蓝细菌在内的多种原核生物内(Talbot and Farrimond,2007),属于五环三萜化合物 (Rohmer et al,1984),结构十分稳定,自然环境下难以降解,易于保存在干酪根中(Summons et al,1999)。常见的细菌藿多醇支链上具有四个官能团,在C-32,C-33,C-34上分别连有羟基,在C-35上可以连接多种基团,如羟基、氨基、氨基酸或是更复杂的氨基糖等(Talbot and Farrimond,2007)。最早发现的细菌藿多醇就是从醋杆菌(Acetobacter xylinum)中分离得到的细菌藿四醇(Bacteriohopane-32,33,34,35-tetrol,图1a,简称为 BHT)(Forster et al,1973)。也有一些藿多醇支链上具有4个以上的官能团,表现为C-31或C-30上多加一个羟基,这类的藿多醇往往具有特定的生物来源。比如:C-35上连接氨基的藿多醇被认为是来自嗜甲烷细菌(methanotrophic)(图 1b)(Neunlist and Rohmer,1985;Talbot et al,2001);侧链上一共有五个羟基和一个氨基(C-35)的被认为仅来自于Ⅰ型甲烷氧化菌(Type I methane-oxidising bacteria,图 1c)(Rohmer,1985;Talbot et al,2001);C-35上接有氨基糖的则被认为是来自于醋酸菌(图1d)(Simonin et al,1994)和蓝细菌(Talbot et al,2003b);至于细菌藿四醇(图1a),虽然广泛存在于沉积物和土壤中,但生物来源复杂,并不能用于指示某种特定的细菌(Talbot and Farrimond,2007)。
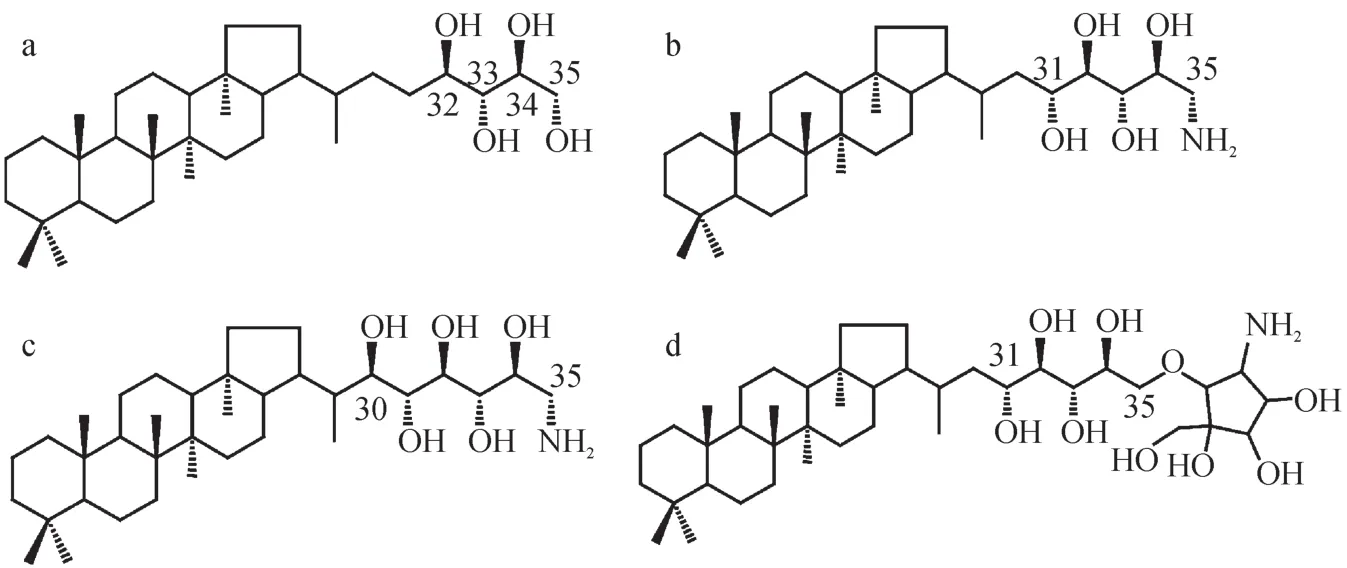
图1 四种结构不同细菌藿多醇(修改自Talbot and Farrimond(2007))Fig.1 Structures of bacteriohopanepolyols (modif i ed from Talbot and Farrimond (2007))
不同于支链上具有复杂的结构变化,细菌藿多醇环上结构变化较少。主要表现是在A环3号碳和2号碳上发生甲基化,分别形成3-甲基藿多醇(3-Methylbacteriohopanepolyols,简称3-MeBHPs)和2-甲基藿多醇(2-Methylbacteriohopanepolyols,简称2-MeBHPs)。前者多来自于甲烷氧化菌(Farrimond et al,2004),而后者则多来自于蓝细菌(Summons et al,1999;Talbot et al,2003a;Talbot and Farrimond,2007),也被视为蓝细菌的生物标志物。不过,在古老地层或沉积岩中,经成岩作用后2-甲基藿多醇的支链会全部或部分丢失(Ricci et al,2014),从而转化成结构更稳定的2-甲基藿烷(2-Methylhopane,简称2-MeH)(图2),因此2-甲基藿多醇被认为是2-甲基藿烷的前体物质。研究者可以通过测定2-甲基藿烷相对含量——2-甲基藿烷指数(2-Methylhopanoid index,简称2-MeHI)来估测蓝细菌的生物量和蓝细菌对环境变化的响应程度(黄咸雨等,2007;谢树成等,2009;Gibson et al,2008;Saito et al,2016)。
2-MeHI的表达公式为: 2-MeHI=2-甲基藿烷 /(2-甲基藿烷 + 藿烷 )×100%(Dumitrescu and Brassell,2005)。
除了典型的2-甲基藿多醇作为蓝细菌的生物标志物,一些支链上具有特殊结构的细菌藿多醇也可以指示蓝细菌的个别属种(Talbot et al,2008)。比如:2-甲基环醇醚(2-Methyl cyclitol ether)目前被证实仅来自于蓝细菌Anacystis Montana(Herrmann et al,1996);细菌藿五醇仅来自于蓝细菌的念珠藻属(Nostoc muscorumand and Nostoc sp.)(Talbot et al,2008); 一 些 侧链有不规则五醇、糖苷四醇等结构的也都被证实来自于蓝细菌(Talbot et al,2008)。对于这些已知来源的细菌藿多醇可以用来重建细菌的生物量和群落结构(Talbot and Farrimond,2007;Blumenberg et al,2013;Talbot et al,2016)。可以用样品中细菌藿多醇的总量代表产生此类化合物的细菌总量。样品中具有特定结构的藿多醇的存在或缺失可以说明与之对应的细菌的存在或缺失。具有特定结构的藿多醇的总量和相对比例可以代表对应细菌的数量和相对比例(Cooke et al,2008a)。

图2 2-甲基藿多醇(2-MeBHP)经成岩作用转变为2-甲基藿烷(2-MeH)(修改自Farrimond et al(2004))Fig.2 Structures of 2-methylbacteriohopanepolyol(2-MeBHP) and 2-methylhopane (2-MeH) (modif i ed from Farrimond et al (2004))
2 2-甲基藿烷类化合物作为蓝细菌生物标志物的应用
2.1 估测生物量与群落结构
近年来,在土壤、沉积岩、陆相湖泊和海洋沉积物中都检测出大量的2-甲基藿烷类化合物,通过测定样品中2-甲基藿烷类化合物的含量可以有效地估测蓝细菌生物量及对沉积物有机质的贡献,并根据与其它藿烷类化合物的比值重建细菌群落结构(Talbot et al,2003a;Farrimond et al,2004;Talbot and Farrimond,2007;Cooke et al,2008a;Coolen et al,2008)。Gibson et al(2008)首次报道了地热硅土烧结矿中的2-甲基藿多醇,认为这些化合物可用于估测烧结矿中蓝细菌的生物总量。有人使用土壤中2-甲基藿多醇占全部藿多醇的比值指示蓝细菌在细菌群落结构中的比例,发现随着土壤深度的增加,蓝细菌的比例不断减小,说明具有光合作用的蓝细菌主要集中在表层土壤(Cooke et al,2008a)。在西班牙Grande湖和南极Druzhby湖沉积物中发现2-甲基藿多醇含量较高,表明蓝细菌对沉积物中有机质的贡献较大,对比其它藿多醇含量也表明蓝细菌在群落结构中占有较大比例(Farrimond et al,2004;Talbot and Farrimond,2007)。在Druzhby湖中高含量的2-甲基藿多醇与此处富含蓝细菌的微生物席有关(Laybourn and Bayliss,1996;Talbot et al,2003a)。而在Grande湖中虽然没有明显的蓝细菌席,但是Grande湖的自然分层环境有利于蓝细菌颤藻目(Oscillatoria)的生长(Farrimond et al,2004),从而使Grande湖表层沉积物具有高含量的2-甲基藿多醇。相对于现代湖泊沉积物,海洋沉积物(采自北冰洋、墨西哥湾和秘鲁沿岸)样品中2-甲基藿多醇的绝对含量和相对含量都略少,表明在某些海洋区域蓝细菌对沉积物有机质的贡献不及陆相湖泊(Farrimond et al,2004)。
因为2-甲基藿多醇在成岩过程中会转化为2-甲基藿烷,所以对于长时间尺度样品就要以2-甲基藿烷来指示蓝细菌(Summons et al,1999;Farrimond et al,2004;Ricci et al,2014)。 分 析波兰沿海的Sarbsko湖中的柱状样,发现距表层3.6 m处(距今约4200 a) 有高含量的2-甲基藿烷,说明该时期蓝细菌数量较多,水体中微生物活动比较活跃(Bechtel et al,2007)。对澳大利亚西部的新太古代时期沉积岩样品分析表明2-甲基藿烷指数在浅水沉积物中的值要高于深水沉积物,说明蓝细菌在海洋透光区具有较高的生产力(Eigenbrode et al,2008)。太平洋沙茨基隆起的样品中2-甲基藿烷高的相对含量证明在阿普第阶海洋缺氧事件的早期,蓝细菌是海洋有机质和生产力的重要贡献者(Dumitrescu and Brassell,2005)。二叠纪—三叠纪之交的岩石样品中发现了2-甲基藿烷指数出现多次波动,说明蓝细菌数量在此期间经历了多次大幅度变化,这可能与生物大灭绝引起的营养输入改变有关(黄咸雨等,2007)。
2.2 重建蓝细菌固氮贡献
湖泊中所发现的固氮细菌仅限于蓝细菌的某些种类,如念珠藻、水华束丝藻(Aphanizomenonflos-aquae)等(Torrey and Lee,1976)。同样,在海洋中具有固氮能力的蓝细菌也只占有小部分(蓝细菌种类有1000多种,具有固氮能力的不过20余种),但是这些蓝细菌对于海洋氮循环仍起到重要作用(Karl et al,2002;侯建军和黄邦钦,2005;Zehr,2011)。如前文所述仅蓝细菌束毛藻属的固氮量就大约占到了海洋总固氮量的36%,另有一些与海洋硅藻共生的蓝细菌,其固氮贡献与也束毛藻属大致相当(Gallon,2001)。2-甲基藿烷指数除了可以用来代表蓝细菌向海洋有机质输入的贡献值(Summons et al,1999),还可以指示蓝细菌的固氮贡献及对海洋氮循环的影响程度。2-甲基藿烷指数的上升可以表明蓝细菌固氮贡献加强(Cao et al,2009;Owens et al,2016)。此外,因为蓝细菌在进行固氮作用过程中氮的同位素分馏很弱,产生的氮盐δ15N接近于0,明显小于海洋平均值(5‰),所以还可以将2-甲基藿烷指数和δ15N值结合起来共同说明蓝细菌的固氮贡献(李志阳等,2013)。南海南部的一根柱状样的分析显示在MIS 5期沉积物中有机氮同位素值较低,而2-甲基藿烷指数有升高的特点,这表明了此期间蓝细菌固氮贡献的加强(李志阳等,2013)。在白垩纪中期的大洋缺氧事件中也发现了类似现象。相对于南海的分析结果,这一事件中所测得的2-甲基藿烷指数升高幅度更大,同时有机氮同位素值更低,表明此时期蓝细菌具有更强的固氮贡献。其原因可能是海洋中的反硝化和厌氧氨氧化作用有效地切断了深层水中的氮盐向真光层输送,使真光层处于低氮盐的环境,固氮蓝细菌更具有竞争优势并大量繁殖,导致其固氮贡献大幅增加(Kuypers et al,2004)。
2.3 重建古环境
研究表明,蓝细菌可能更适宜偏碱性的水体,而偏酸性的湖沼相环境不利于蓝细菌生长(包建平等,2012),所以2-甲基藿烷指数也可以为重建古水体的酸碱性变化提供参考。在二叠纪—三叠纪之交的生物大灭绝时期,2-甲基藿烷指数发生剧烈变化,也被认为是该时期的水体生态系统和营养环境极不稳定的体现(黄咸雨等,2007)。另外,在位于中国南部的青岩和巢湖地层截面中发现,在三叠纪早期2-甲基藿烷指数较高,认为此时期细菌(包括蓝细菌)面临着较大的生存环境压力(例如温度、pH等)(Saito et al,2016)。因为2-甲基藿烷类化合物可以增强细胞膜强度,当生存环境压力变大时,这类细菌往往具有竞争优势,就会表现出地层中2-甲基藿烷含量增加,2-甲基藿烷指数升高(Wu et al,2015)。而到三叠纪早中期,2-甲基藿烷指数变小,意味着此时环境压力减小,这一结果也与生物物种的多样性爆发相一致。但是,通过这种方式仅可以定性推断环境压力的改变,并不能具体指出是哪一方面的变化(Saito et al,2016)。
2.4 指示产氧光合作用的起源
蓝细菌的产氧光合作用使地球由早期的无氧环境转变为现在的富氧环境(Tomitani et al,2006)。根据沉积岩中2-甲基藿烷的出现时间,推测最早的产氧光合作用起源于25亿年前(Summons et al,1999)。Brocks(1999)则根据同样的方法将最早的产氧光合作用时间确定为27亿年前。但是近年来的研究显示2-甲基藿烷作为研究产氧光合作用的标志物是有待商榷的。比如:蓝细菌念珠藻属的2-甲基藿烷主要来自于原垣孢子,而原垣孢子是一种静息细胞,并不会进行光合作用,所以不能用2-甲基藿烷来指示念珠藻的产氧光合作用(Doughty et al,2009)。而且,其它的某些细菌虽然没有原垣孢子的形式并且可以进行光合作用,但不一定产生氧气,例如沼泽红假单胞菌(Rhodopseudomonas palustris)就可以在不产氧的光合作用下产生2-甲基藿多醇(Rashby et al,2007)。此外,在很多不具备产氧光合作用功能的细菌中也发现了可以合成2-甲基藿多醇的基因(Welander et al,2010)。因此,用2-甲基藿烷指示蓝细菌产氧光合作用,还需要更多的证据支持。
3 2-甲基藿烷类化合物作为蓝细菌生物标志物应用的影响因素
2-甲基藿多醇和2-甲基藿烷虽然被广泛用作蓝细菌的生物标志物,但是在应用上依然存在很多问题。主要体现在两个方面:一是2-甲基藿烷类化合物的生物来源问题。2-甲基藿多醇并非所有蓝细菌都可以产生,也并非只有蓝细菌可以产生。最近的研究显示在多种细菌中都发现了参与合成2-甲基藿多醇的基因。二是在边缘海沉积物中的2-甲基藿烷可能会受到陆源输入的影响。因为陆生蓝细菌所产生的2-甲基藿多醇会随河流进入边缘海,为边缘海沉积物中2-甲基藿烷指标带来偏差。
很多研究都已表明并不是所有蓝细菌都可以产生2-甲基藿多醇。虽然细菌藿多醇这类化合物在蓝细菌的5个目(Chroococcales,Pluerocapsales,Oscillatoriales,Nostocales和Stigonematales)中都有发现,然而并不是所有种都会产生。在所研究的58种蓝细菌中有49种可以产生细菌藿多醇,但能产生2-甲基藿多醇的仅有21种(Talbot et al,2008)。此外,蓝细菌并非是唯一能产生大量2-甲基藿多醇的菌种(Rashby et al,2007)。像其它的一些细菌,如甲基营养菌(methylotrophs)、某些固氮细菌、厌氧型紫色非硫细菌(purple non-sulfur bacteria)和土壤细菌(例如根瘤菌(rhizobium)和放线菌(actinomycetes))等也都可以产生(Rashby et al,2007;Talbot and Farrimond,2007;Talbot et al,2008;Welander et al,2010),所以地质记录中的2-甲基藿烷也不能排除其它细菌的贡献(Eigenbrode et al,2008)。
现代分子生物学表明:2-甲基藿多醇的合成与 hpnP 基因有关,这种基因主要负责编码能在细菌藿多醇A环2号碳上进行甲基化的蛋白质。经检测只有少部分的蓝细菌具有这种基因,仅占到被测序蓝细菌菌种的13% (Ricci et al,2014)。同时在其它的细菌中也发现 hpnP 基因,如酸杆菌门和一系列甲型变形菌纲的根瘤菌(Talbot et al,2007;Welander et al,2010)。但是,对澳大利亚西部鲨鱼湾的微生物席(微生物席中主要含有蓝细菌和甲型变形菌) 分析,结果显示甲型变形菌中并未检测到 hpnP 基因,而是在蓝细菌中检测到,所以蓝细菌被认为是该区域2-甲基藿烷类化合物的主要来源(Garby et al,2013)。此外,还有人指出当土壤中氧氮含量较低、渗透性较高时,与植物共生的细菌都普遍具有 hpnP 基因。因此,2-甲基藿多醇是植物和细菌相互作用的结果,难以指示蓝细菌或其它某一菌种,而是指示这种特殊的生态位(Ricci et al,2014)。这些研究表明2-甲基藿烷生物来源复杂,其作为蓝细菌生物标志物的可靠性还需要进一步的研究。
陆地土壤中的2-甲基藿烷类化合物会对边缘海沉积物中海洋蓝细菌数量的估测带来偏差。陆地土壤、湖泊河流中都存在大量的藿烷类化合物(Talbot and Farrimond,2007;Cooke et al,2008b),这些化合物会被河流输送到海洋中成为边缘海有机质的重要来源(Cooke et al,2008b;Handley et al,2010;Saenz et al,2011)。 分 析巴拿马运河河内 — 河口 — 近海区域6个站位的表层悬浮颗粒物显示,河内细菌藿多醇含量约为近海的十倍。河内的2-甲基藿多醇含量高于河口,而在近海样品中未能检测到,说明即便河流输入少量的陆源2-甲基藿多醇也会对海洋沉积物中2-甲基藿多醇的含量产生重要影响(Saenz et al,2011)。
4 结论与展望
蓝细菌是地球上最早具有产氧光合作用的生物,它的诞生和发展对地球生态环境变化起着重要的作用。2-甲基藿烷类化合物作为具有多年研究历史的蓝细菌生物标志物,在指示蓝细菌生物量和古环境变化方面都有了广泛的应用,但是近年来的研究也逐步指出2-甲基藿烷类化合物的不足,而且还有很多问题亟待解决。主要的问题有:(1)2-甲基藿烷类化合物的生物来源问题。(2)在受陆源影响的边缘海区域,如何校正陆源2-甲基藿烷类化合物的影响。解决这些问题还需要通过实验培养并结合分子生物学等手段深入研究。
——固氮微生物

