烃源岩抽提物中藿烷分子碳同位素分析新方法及指示意义
鲁中灯,刘 岩,陈祖林,樊云鹏,文志刚,徐耀辉,牛 金,田永晶,柳 波,谢小敏,谢 巍
1.油气与环境地球化学湖北省重点实验室(长江大学 资源与环境学院),武汉 430100;2.山东省地质矿产勘查开发局 第五地质大队,山东 泰安 250013;3.东北石油大学 非常规油气研究院,黑龙江 大庆 163000;4.中国石油 塔里木油田分公司 实验检测研究院,新疆 库尔勒 841000
1 研究现状
藿烷类化合物是地质体中普遍存在的五环三萜类化合物,可以指示细菌贡献的生物来源,是最常用的一类生物标志化合物。通常藿烷类化合物被用来进行油—油对比[1-2]、油—源对比[3],源—源对比[4]、有机质成熟度指示[5-6]等方面的研究。此外,藿烷类化合物还在环境地球化学[7-13]、生物地球化学[14]、海洋地球化学[15-16]等领域获得大量成功的应用,是一类极具应用价值的生物标志物。
常用藿烷地球化学参数主要有:Ts/(Ts+Tm)、C29Ts/(C29αβ+C29Ts)、C29αβ/C30αβ、C3122R/C30αβ和C35/(C31—C35)等。其中Ts/(Ts+Tm)和C29Ts/(C29αβ+C29Ts)是重要的成熟度参数;C29αβ/C30αβ比值常用于指示缺氧的沉积环境以及进行海陆相简单的划分,并且在一定条件下可作为成熟度指标使用;C3122R/C30αβ是区分海相和陆相烃源岩的重要指标,其值大于0.25对烃源岩的海相原始沉积环境具有较强的指示意义[17];C35/(C31—C35)比值常用作海相烃源岩沉积过程中的氧化还原电位指标。这些参数在油源对比等研究中发挥了巨大作用。然而,大多数生物标志物在未成熟到生油早期阶段具有较强的专属性,但随着成熟度的进一步增大,很多生物标志物达到演化平衡而不再变化,这又极大地限制了生物标志物的进一步应用[18-23]。
生物标志化合物稳定碳同位素中蕴藏着丰富的生物、地质、地球化学信息,通过研究有机化合物碳同位素组成、碳同位素分馏机理,可以揭示复杂的地球化学过程[24]。前人应用色谱—同位素比值质谱技术(GC-IRMS)已对藿烷单体烃碳同位素进行过一些探讨,如史继扬等[3]采用Silicate法分离了广东泥炭样品中的藿烷类化合物,并进行藿烷的单体碳同位素分析,认为其沉积环境中可能生长具有不同碳同位素组成的藿类先质的多种微生物;杜丽等[25]采用尿素络合法去除了吐哈煤岩饱和烃组分中的正构烷烃,同样获取了藿烷分子碳同位素特征,认为在相同沉积环境、相似母质来源的沉积有机质中,萜烷与链烷烃的碳同位素之间存在着明显的同位素差异,即藿烷(五环三萜烷)比链烷烃(包括正构烷烃及类异戊二烯烷烃)更富集轻的碳同位素;WANG等[26]也采用尿素络合法获取了松辽盆地湖相烃源岩中异构烷烃亚组分,并分析了藿烷单体烃碳同位素分布特征,认为甲烷氧化菌导致藿烷单体碳同位素值存在显著偏负的现象;王汇彤等[27]研究了多种类型国产分子筛对甾烷和藿烷的吸附性,发现NaY型分子筛对不同构型的甾烷、藿烷、伽马蜡烷、β-胡萝卜烷吸附行为具有明显差异,是分离富集甾烷、藿烷等生物标志化合物的最佳选择。总的来看,藿烷单体碳同位素数据在解释不同沉积相带中有机质生源、微生物种类和丰度及活跃程度等方面发挥了有效的作用。然而,从前人公开报道的结果来看,藿烷类化合物的分离、富集方法是获取其分子碳同位素的关键过程,但存在实现难度大、实验周期长等不足,且对低藿烷丰度地质样品中的藿烷分离富集较为困难。本文采用5Å分子筛/氧化铝柱层析的新方法,对1个四川海相页岩样品和2个新疆准噶尔盆地二叠系芦草沟组湖相页岩样品抽提物进行了分离,结果表明该方法操作简单、有效,获得的亚组分可直接用于测定藿烷类化合物单体碳稳定同位素比值,有望促进藿烷类化合物在油气地球化学研究中的应用。
2 样品和实验方法
2.1 实验样品
本文所用样品为采自四川盆地西北部矿山梁地区大隆组的1件海相页岩样品,以及新疆准噶尔盆地吉木萨尔凹陷二叠系芦草沟组的2件湖相页岩样品。考虑到成岩与后生作用过程中藿烷异构化对藿烷化合物单体碳同位素可能产生较大的影响[28],所选样品均为生油高峰之前的样品(Ro<1%),且藿烷类生物标志化合物含量较为丰富。样品信息详见表1。
2.2 实验方法
本文采用5Å分子筛/氧化铝柱层析法对藿烷类化合物进行分离和富集。主要步骤如下:①取约100 g烃源岩样品粉碎至80~100 目,用二氯甲烷和甲醇混合溶液[9∶1(体积比)]对其进行72 h索氏抽提,获得可溶有机质;②取25 mg可溶有机质,加入少量二氯甲烷,再加入约20 mL正己烷,以沉淀沥青质;③过滤沥青质后,滤液用N2吹扫浓缩;④柱子在不润湿的情况下,将滤液转入上层填装有5Å分子筛、下层填装有中性氧化铝的层析柱中,使其充分吸附[5Å分子筛∶中性氧化铝=1∶9(体积比),5Å分子筛在400 ℃下活化2 h,100~200 目中性氧化铝在400 ℃下活化4 h];⑤用2 mL正己烷淋洗出链烷烃馏分,用1.5 mL正己烷∶乙醚=1∶1(体积比)洗脱液淋洗得到富含藿烷化合物的亚组分;⑥重复上述④、⑤步骤进行藿烷化合物提纯;⑦将富集的藿烷化合物用N2吹扫浓缩到约100 μL,用于后续检测。
将分离、富集的藿烷化合物进行GC-MS和GC-IRMS检测。GC-MS分析采用的仪器为美国Aglient公司的7890A5977B型气相色谱—质谱联用仪,分离色谱柱为HP-5MS石英毛细管柱(30 m长,0.25 mm内径,0.25 μm膜厚),进样口温度设置为315 ℃,柱箱初始温度为50 ℃,载气为99.999%的氦气。GC-IRMS测定使用的是Isoprime GV型色谱—同位素比值质谱,分离色谱柱为HP-5MS色谱柱(60 m长,0.32 mm内径,0.25 μm膜厚);色谱升温程序为起始温度50 ℃,保持1 min,以3 ℃/min升至310 ℃,恒温20 min,载气为99.999%的氦气,恒流模式。
3 结果与讨论
3.1 烃源岩地球化学特征
川西北KSL海相页岩中Pr/Ph为0.79,藿烷系列分布较为完整,Ts/Tm为0.24,C29Ts/C29αβ为0.15,C29αβ/C30αβ为0.77,C31R/C30H为0.4,显示出典型的低熟海相沉积有机质特征;g/C30H为0.06,g/C31H为0.12,C27αααR、C28αααR、C29αααR规则甾烷呈现近“V”型分布,C27αααR/C29αααR为1.04;甾烷/藿烷比值为0.34,表明细菌贡献较大。准噶尔盆地二叠系芦草沟组2件湖相页岩中Pr/Ph为0.71~0.87,藿烷分布具有C30αβ明显偏高的特征,Ts/Tm为0.22~0.24,C29Ts/C29αβ为0.12~0.14,C29αβ/C30αβ为0.62~0.65,C31R/C30H为0.20~0.24;g/C30为0.26~0.18,g/C31为0.63~1.09;C27αααR、C28αααR、C29αααR规则甾烷呈现近反“L”型分布,C27αααR/C29αααR为0.23~0.38,陆源贡献远强于KSL样品;甾烷/藿烷为0.28~0.47,同样指示了细菌生源的重要贡献。
从2组样品有机地化参数对比来看(图1),KSL为典型海相沉积有机质,而J36芦草沟组是半咸水湖相沉积有机质,均代表各自的沉积环境特征。但2组样品中甾烷/藿烷比值相当,表明细菌生源贡献基本相当;藿烷面貌差别不大,通过常规藿烷生物标志物难以进行有效的区分。
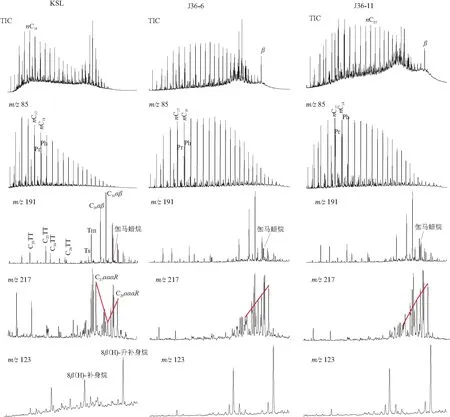
图1 四川盆地海相页岩(KSL)和准噶尔盆地湖相页岩(J36)地球化学特征
3.2 藿烷单体化合物的分离及单体碳同位素测试结果可靠性
为反映海相和湖相页岩细菌生源的差异,本文采用5Å分子筛/氧化铝柱层析法对KSL二叠系海相页岩和新疆准噶尔盆地二叠系芦草沟组J36湖相页岩进行藿烷化合物的分离、富集,研究两类不同沉积环境中藿烷化合物碳同位素特征。为了验证分离富集藿烷的可靠性,将分离后得到的藿烷化合物进行GC-MS检测。结果表明,通过对各化合物进行结构鉴定,确定分离出的化合物为目标藿烷系列化合物;分离后得到的藿烷能够完整地保留原始油样藿烷m/z191的谱图特征,且能够有效降低甾烷共溢峰的干扰(图2)。
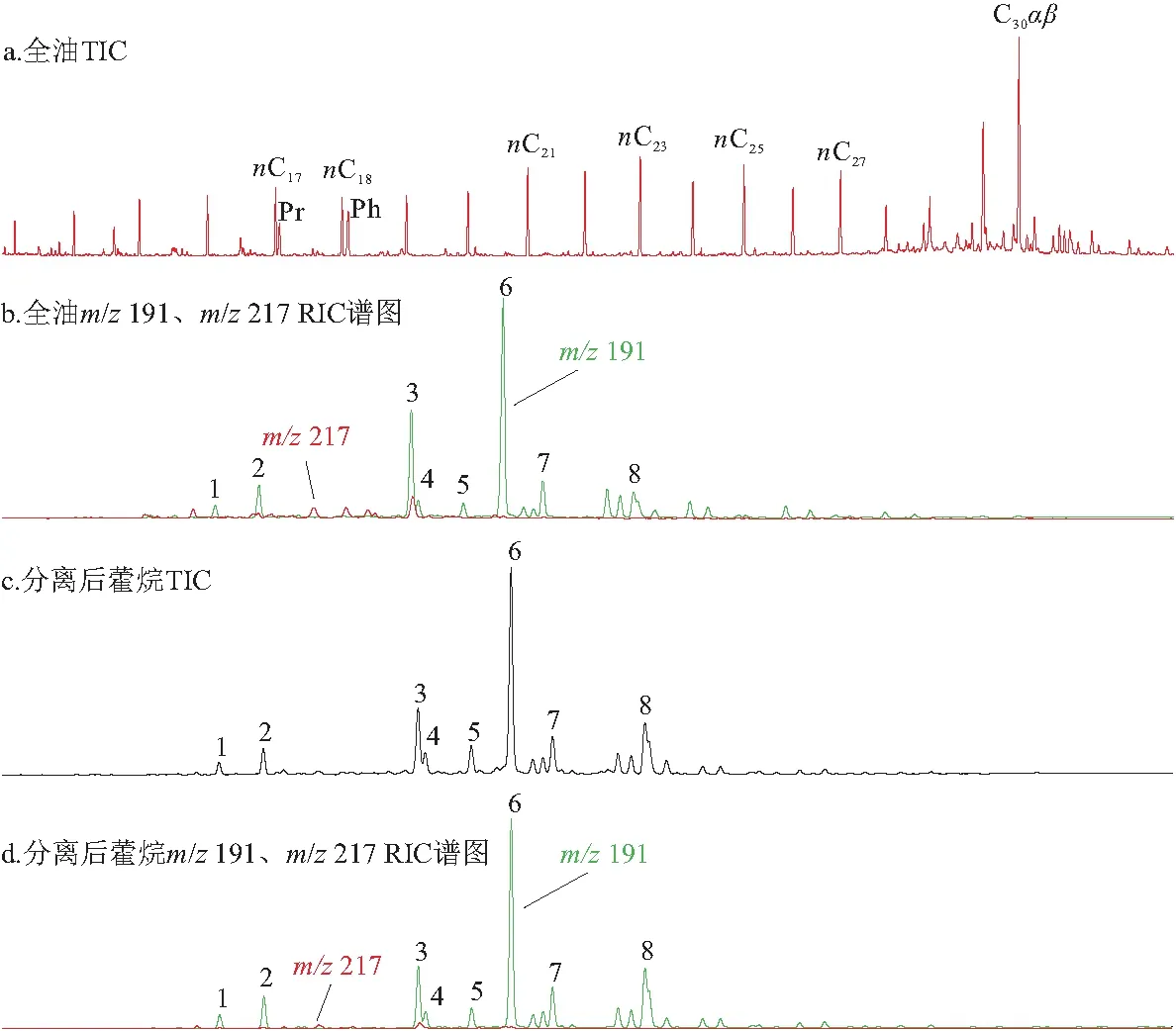
图2 柱色谱法分离准噶尔盆地二叠系芦草沟组湖相烃源岩藿烷化合物效果图
将富集的藿烷化合物进行GC-IRMS测定。图3是饱和烃馏分中藿烷化合物的GC-IRMS的44M[V]图,对于藿烷系列化合物随时间变化的峰信号,分别积分每个峰质量44、45和46的离子流,测定每个化合物碳同位素比值。从图3中可以看出,藿烷系列化合物均能在色谱柱中达到基线分离,其相关化合物的特征峰也较为明显,可以达到单体碳同位素分析的要求。结合GC-MS分析中各化合物出峰的顺序,可以获得藿烷系列化合物的单体碳同位素比值。
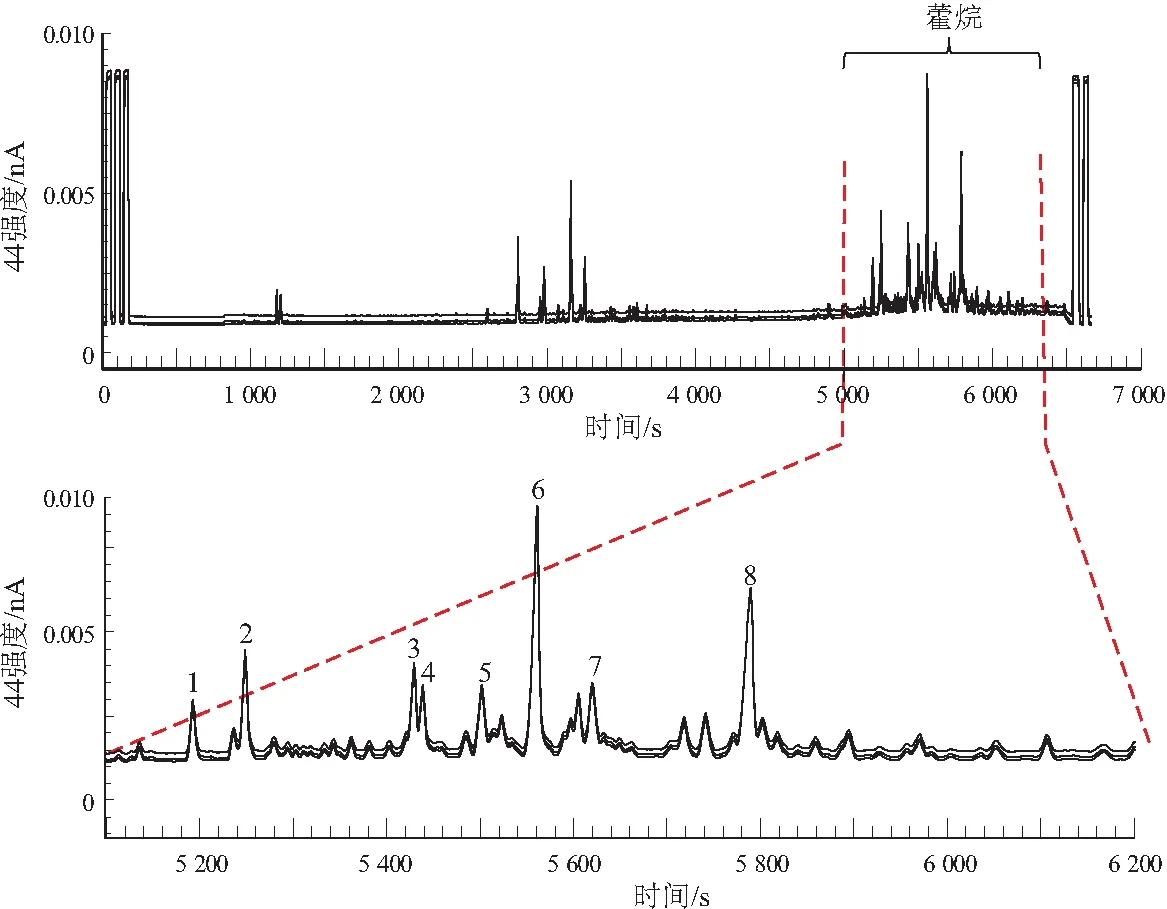
图3 准噶尔盆地二叠系芦草沟组湖相烃源岩藿烷化合物GC-IRMS测定谱图
3.3 藿烷单体碳同位素特征
从藿烷化合物碳同位素比值(图4)来看,KSL大隆组海相页岩的藿烷化合物δ13C值总体较重,分布在-20.5‰~-45.4‰,总体表现为随藿烷碳数增加先变轻再变重的变化趋势,其中C30αβ和C29βα的碳同位素最轻(-39.3‰和-45.4‰),而Ts和Tm的碳同位素值最重(-20.5‰)。从各化合物同位素的对比来看,海相页岩中藿烷类化合物单体碳同位素波动很大,最大相差可达到±24.9‰。其中Ts、Tm表现出较重的碳同位素比值,推测在成岩及后生作用的过程中[28],Ts和Tm在向热稳定性更高的构型转化,从而使得残留的Ts和Tm同位素值向碳同位素值更重的方向转化。另外,藿烷尤其是碳数大于C31的藿烷类化合物来源于组成细菌细胞膜的C35细菌藿四醇,而小于C31的可能有不同的成因来源存在[29]。从藿烷系列的同位素值在大范围内波动情况来看,藿烷可能有不同的成因来源,尤其是升藿烷与降藿烷系列具有明显不同的生物来源。
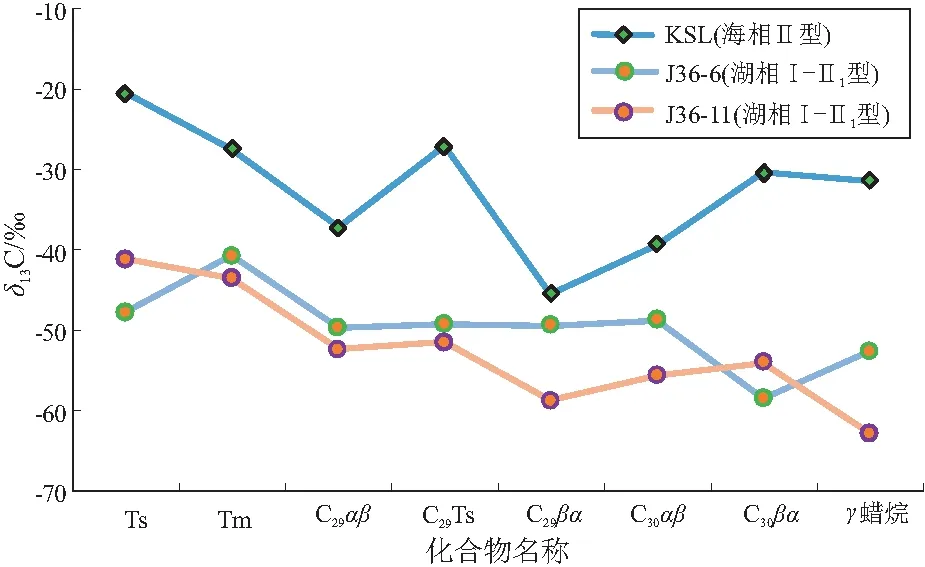
图4 四川盆地海相和准噶尔盆地湖相烃源岩藿烷单体烃碳同位素值对比
芦草沟组湖相页岩藿烷系列单体δ13C总体较轻,分布在-40.7‰~-62.7‰,呈现出随着碳数的增加同位素比值变轻的特点。藿烷类化合物单体碳同位素波动也较大,差值也可达到±20‰以上。其中C30αβ藿烷的碳同位素值与文献报道[30-31]本地区芦草沟组藿烷的碳同位素值一致,也佐证了本文结果的可靠性。推测芦草沟组湖相页岩δ13C较轻的升藿烷系列化合物与甲烷氧化菌的活动有关,δ13C较重的降藿烷化合物(如Ts和Tm)可能来源于不同的细菌,也可能是在成岩与后生作用过程中发生了热分馏作用[28]。
针对藿烷的碳同位素值分布情况,法国第三系湖相梅塞页岩中藿烷化合物δ13C为-35.2‰~-65.3‰[32],美国第三系的湖相绿河页岩藿烷化合物δ13C为-29‰~-59‰[27]。前人认为,碳同位素比值较轻的藿烷(C30αβ)来源于甲烷氧化细菌[32],尤其是好氧甲烷氧化细菌[16],好氧甲烷生物局限于缺氧和含氧带之间的微嗜氧界面[33],是沉积物中发现的类藿烷的假定来源,在地质体中常把3-甲基藿烷作为甲烷氧化菌的标志物[34]。ZHOU等指出珠江口盆地珠二坳陷神狐地区水合物甲烷δ13C值为-71.2‰~-56.7‰[35],严重亏损13C,是甲烷氧化细菌同化了生物甲烷,从而使来源于这类细菌的生物标志化合物特别富集轻碳同位素[36]。根据前人对古菌落的研究,某些类型的微生物使用具有非常特定的13C信号的碳源,或具有导致特定同位素比值的代谢,因此,它们的同位素特征可以用来识别它们的古代生产者(包括初级生产者和二级生产者)[30]。
通过两地区烃源岩中藿烷单体碳同位素特征综合对比分析,认为在不同沉积环境下发育不同程度的藿烷先质,造成藿烷碳同位素的巨大差异;同时,完全相同的藿烷先质及在成岩与后生作用中,也会朝向不同的方向演化[37-40]。即便是在相对简单的海相环境中,藿烷系列单体同位素的巨大差异表明,藿烷系列化合物的成因来源可能比前人认识更加多元。
总的来看,各藿烷化合物在地质体中的赋存状态、干酪根结构中差异化释放藿烷机理、各藿烷化合物的热力学稳定性、成岩作用阶段微生物输入及对有机质的改造等均可造成同位素的变化。不同沉积环境下造成的藿烷先质的不同,及在成岩与后生作用中,藿烷类化合物的演化机理如何,这些都是有待解决的重要研究内容。
4 结论
(1) 采用5Å分子筛/氧化铝柱层析的新方法,可快速获取以藿烷类化合物为主的亚组分,其操作简单、易实现,是获取藿烷类单体化合物碳同位素的有效技术。
(2) 四川盆地大隆组海相页岩的藿烷化合物δ13C值总体较重,且表现为随藿烷碳数增加先变轻再变重的趋势,藿烷类化合物单体碳同位素波动很大。而准噶尔盆地二叠系芦草沟组湖相页岩藿烷系列单体δ13C总体较轻,且呈现出随着碳数的增加同位素比值变轻的特点,藿烷类化合物单体碳同位素波动也较大。藿烷系列单体碳同位素值的巨大差异表明,藿烷成因来源可能比前人认识的更加多元。
(3) 藿烷单体碳同位素值可以反映不同成因藿烷的差异,可以有效区分不同环境中藿烷的特征,在油源对比方面具有较大的应用前景。藿烷单体碳同位素值的获取,将有助于对藿烷类化合物的形成与演化机理的认识。
致谢:本文得到了中国石化石油勘探开发研究院无锡石油地质研究所张志荣研究员及匿名审稿专家的指导与无私帮助,在此一并表示衷心的感谢!

