山东茶园土壤几丁质降解菌的分离、鉴定及产酶特性研究
傅嘉敏,刘腾飞,韩晓阳
(l. 山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东 泰安 271018;2. 山东省果树研究所,山东 泰安 271000)
2017年山东省茶园面积已达2.7×104hm2,茶产业在推动乡村振兴战略、发展农村经济等方面发挥着重要作用。近年来为了满足市场需求,茶农在管理过程中施用大量化肥,影响土壤环境,降低茶叶品质,对茶叶品质安全及农业生态环境安全造成严重威胁[1]。针对农业生产上施肥用药不科学、不合理现象,国家制定了“双减”项目,通过推进减肥减药,逐步改善土壤理化环境,以提高农作物品质。因此,具有特殊功能性的新型菌肥是未来农业发展的方向。
几丁质广泛存在于甲壳类动物的外壳、昆虫的甲壳和真菌的胞壁中[2],其在农业、食品、医药等方面应用十分广阔,主要是通过微生物分泌几丁质酶来进行降解[3]。目前,在细菌、真菌、放线菌中都发现许多具有降解几丁质功能的菌株,譬如环状芽孢杆菌、巨大芽孢杆菌、红色链霉菌、米曲霉等[4-9]。滕少辉等[10]筛选出一株几丁质降解菌,经鉴定为鞘氨醇单胞菌。该菌能有效抑制番茄枯萎病菌,对水稻根系发育有较好的促生作用。Mavingui等[11]发现一株具有几丁质酶活性的多粘类芽孢杆菌,该菌能够有效抑制根部和种苗病害。张立阳等[12]从玉米秸秆中分离出一株枯草芽孢杆菌,它对卷枝毛霉、尖孢镰刀菌、米曲霉、黑曲霉的生长具有抑制作用。闫海洋等[13]筛选出一株几丁质降解菌,它对玉米的生物学性状及产量表现出一定的促进作用,增产达13.08%。
本试验拟从山东茶园土壤中筛选出具有降解几丁质功能的菌株,并通过对菌落形态、生理生化、16S rDNA序列的研究,确定菌株的种属,进而对菌株的产酶特性进行研究,为深入研究几丁质的生物降解及菌剂的开发提供菌种支持。
1 材料与方法
1.1 试验材料
1.1.1 土样采集 2017年7月采集山东农业大学茶园基地土壤,迅速带回实验室进行微生物的筛选。
1.1.2 培养基 几丁质培养基[14]:蛋白胨10 g,K2HPO40.7 g,MgSO40.5 g,KH2PO40.3 g,胶体几丁质5.0 g,琼脂15~20 g,蒸馏水1 000 mL,pH值7.0。
筛选培养基:胶体几丁质20 g,Na2HPO42 g,KH2PO41 g,NaCl 0.5 g,NH4Cl 1 g,MgSO4·7H2O 0.5 g,CaCl2·2H2O 0.5 g,酵母粉0.5 g,琼脂15~20 g,蒸馏水1 000 mL,pH值7.0。
LB培养基:NaCl 10 g,酵母膏5 g,蛋白胨10 g,蒸馏水1 000 mL,pH值7.0。
1.2 试验方法
1.2.1 菌株的初筛 无菌环境下称取土壤样品,采用梯度稀释法[15],在分离培养基上进行菌株的初筛。将初筛后的菌株进行保存,供后续试验使用。
1.2.2 菌株的复筛 将初选得到的菌株制备种子液。按照4%的比例将种子液接种到发酵培养基中,培养7 d后进行酶活检测复筛[16]。每个菌株做3次重复测定。
1.2.3 菌落形态及生理生化鉴定 将菌株点接在几丁质培养基中,30℃培养7 d,肉眼观察菌落形态并作好记录。参考细菌手册[17,18]进行生理生化鉴定。
1.2.4 分子鉴定 采用细菌DNA试剂盒提取菌株总DNA。采用细菌16S通用引物(16S-27F:AGAGTTTGATCCTGGCTCAG;16S-1492R:GGTTACCTTGTTACGACTT),并参照文献[19]的反应体系进行PCR扩增。将PCR产物连接到pMD18-T载体中,进行测序。登录NCBI数据库进行菌株序列的比对,并构建菌株的系统发育树,分析菌株的亲缘关系。
1.2.5 SDS-PAGE蛋白聚类 首先将菌株进行富集培养,然后离心,加入缓冲液进行细胞裂解。采用聚丙烯酰氨凝胶电泳进行电泳分离。阅读PAGE胶上条带信息,对菌株进行聚类分析[20,21]。
1.2.6 产酶条件优化 菌株首先接种于液体种子培养基中,28℃、160 r/min振荡培养至菌液OD=0.05;将种子液按照4%的接种量接种于培养基中进行发酵条件试验。
(1)pH值对几丁质降解菌产酶能力的影响试验:设定pH值为5、6、7、8,温度为25℃,转速200 r/min,设置3个重复,置于振荡培养箱中培养2~3 d,采用DNS法测定酶活性。
(2)温度对几丁质降解菌产酶能力的影响试验:设定温度分别为15、20、25、30、35、40℃六个处理,pH值均为7.0,摇床转速为200 r/min,培养时间2~3 d ,采用DNS法测定酶活性。
(3) 转速对几丁质降解菌产酶能力的影响试验:设定转速为140、160、180、200 r/min,pH值均为7.0,温度30℃,同样设置3个重复,置于振荡培养箱中培养2~3 d,采用DNS法测定酶活性。
(4) 混合菌对几丁质降解菌产酶能力的影响试验:将J4和J17菌株分别培养至菌液OD=0.05,将J4与J17按照1∶1的比例接种4%于培养基中进行产酶试验,与J4菌株和J17菌株单独培养的产酶能力做比较,采用DNS法测定酶活性。
1.3 数据处理
数据采用 IBM SPSS软件进行方差分析,采用Mirosoft Excel 2010 作图。
2 结果与分析
2.1 菌株的筛选
2.1.1 初筛 本试验从土壤中分离出20株菌株,并编号为J1—J20(见表1)。经透明圈法筛选出4株几丁质降解菌菌株,分别为J4、J15、J17、J19。
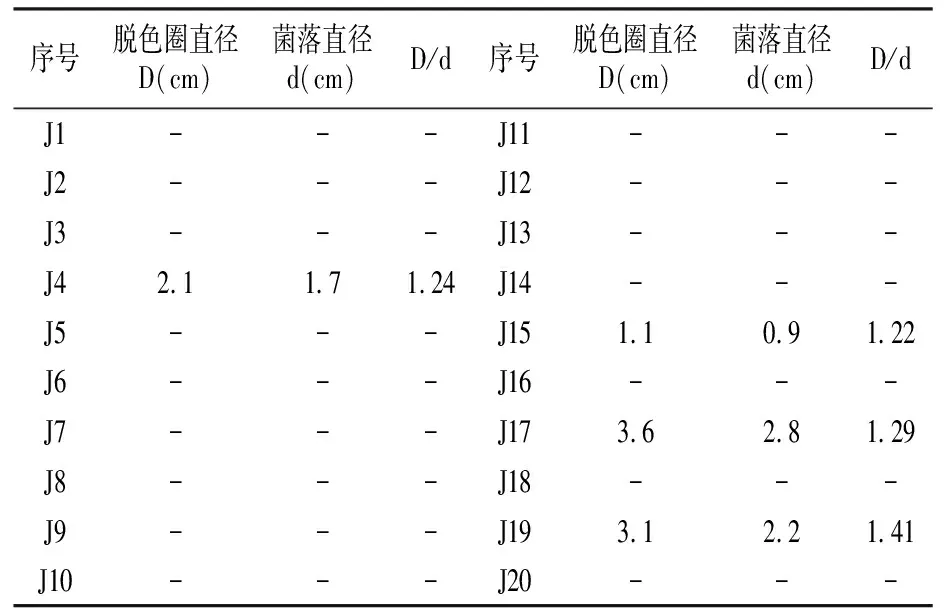
表1 菌株初筛结果
注:“-”为无脱色圈出现。
2.1.2 复筛 (1) 菌株酶活测定:由表2可以看出,J4、J17、J19 3株菌产酶能力存在显著差异。其中J4菌株酶活最高,可达49.31 U/mL,显著高于J17和J19,J17显著高于J19。
(2) 菌株聚类 SDS-PAGE:细胞蛋白电泳可将细菌从蛋白水平上进行区分。由图1可见,菌株J4、J17和J19被分成2大类群。菌株J17、J19属于类群Ⅰ,J4属于类群Ⅱ,说明菌株J17与J19有可能属于同一种属。
综上分析,本试验选择J4和J17作为终选菌株,并做进一步鉴定及产酶特性研究。
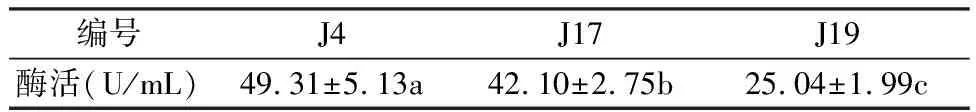
表2 菌株酶活结果
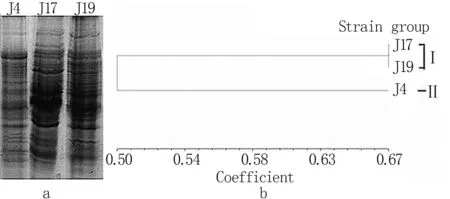
图1 几丁质降解菌全细胞蛋白电泳图谱(a)及聚类分析树形图(b)
2.2 菌株的鉴定
2.2.1 菌落形态鉴定 由图2可见,J4菌落为淡黄色圆形,其表面光滑,边缘整齐,不透明,菌落呈凸起状。J17菌落为乳白色椭圆形,其表面褶皱,边缘不整齐,不透明,菌落呈凸起状。

图2 菌落形态
2.2.2 菌株生理生化鉴定 菌株J4为革兰氏阴性菌,好氧,V-P阳性,可利用N-乙酰葡萄糖胺、阿拉伯糖、纤维二糖、蔗糖、葡萄糖,脲酶为阴性,能水解淀粉。菌株J17为革兰氏阳性菌,好氧,接触酶阳性,V-P阳性,可利用葡萄糖、蔗糖、阿拉伯糖、半乳糖,能水解淀粉。
2.2.3 菌株分子鉴定 经测序检测,菌株J4和J17的序列长度为1 400 bp和1 420 bp。将所得序列进行 BLAST 比对,结果表明,J4属于鞘氨醇杆菌属,J17属于芽孢杆菌属。从菌株系统发育树可知(图 3),菌株J4与Sphignobacterium亲缘关系最近,菌株J17与Bacillus亲缘关系最近。

图3 菌株系统发育树
2.3 菌株产酶特性研究
2.3.1 pH值对终选菌株产酶能力的影响 由图4a可知,J4、J17菌株随pH值的升高,酶活增加,在pH值7.0时有较高的产酶能力,酶活可达4.31 U/mL和4.34 U/mL,高于或低于pH值 7.0时酶活均有不同程度的下降。表明pH值7.0为J4、J17菌株产酶的最适pH值。
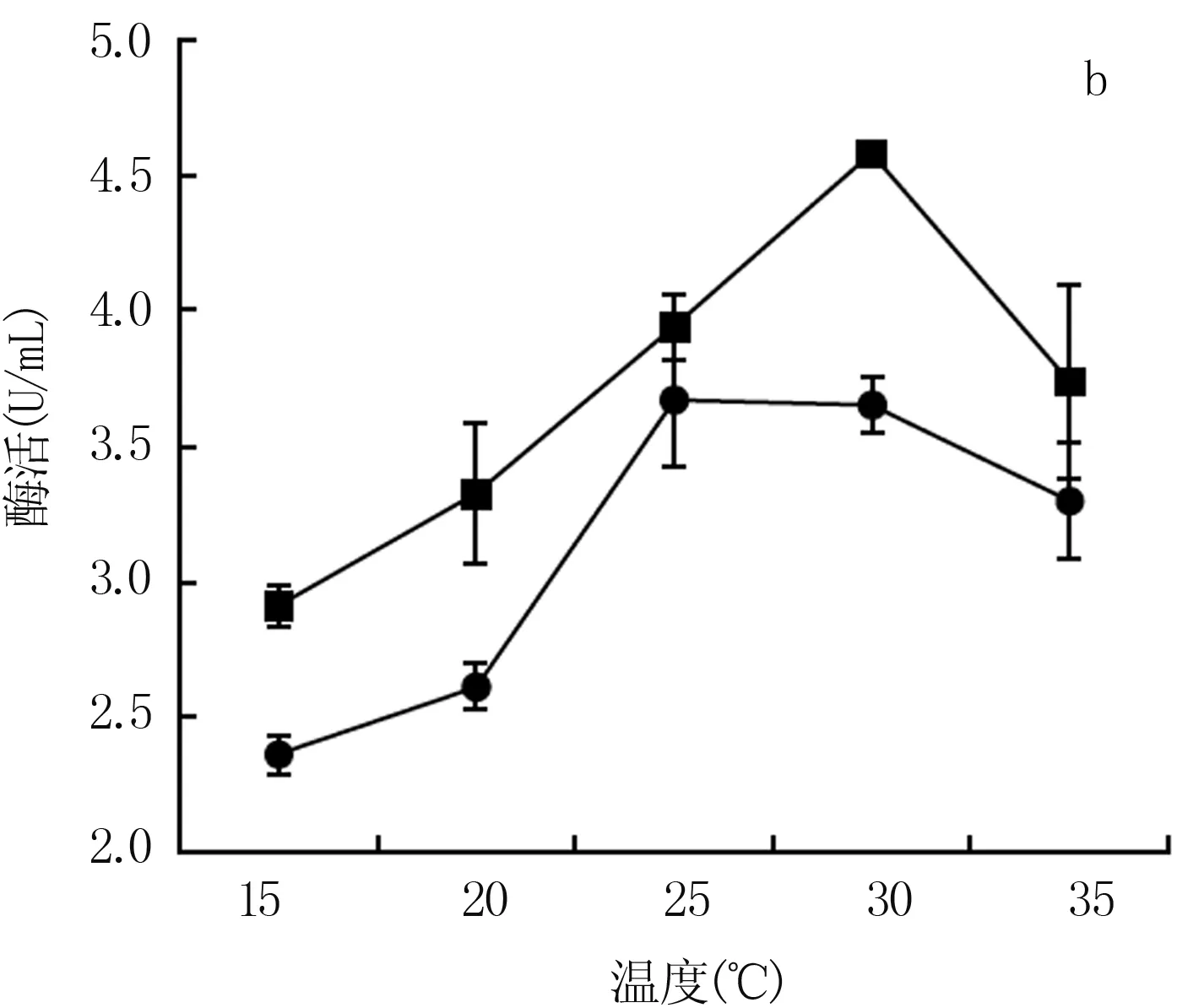
2.3.2 温度对终选菌株产酶能力的影响 由图4b可知,温度影响着菌株的产酶能力。随着温度升高,菌株J4的产酶能力呈直线上升,在30℃时达到最高,之后出现下降,表明在30℃下J4的产酶能力最高。菌株J17在15~20℃产酶能力变化不大,20~25℃产酶能力迅速提升,在25℃时达到产酶能力的最高点。
2.3.3 转速对终选菌株产酶能力的影响 由图4c可知,菌株J4随转速增加,产酶能力有不同程度的增加,在200 r/min时酶活最高;菌株J17随转速增加产酶能力不断增加,在180 r/min时酶活达最高值,之后酶活下降。因此,J4菌株的最适转速为200 r/min,J17菌株最适转速为180 r/min。
2.3.4 混合菌株对几丁质产酶能力的影响 由表3可以看出,J4+J17混合菌株产酶能力与J4、J17单菌株产酶能力相比差异显著,分别高出9%和23%。说明两菌株混合后产酶能力得到提升。

表3 混合菌株对几丁质产酶能力的影响

3 讨论与结论
几丁质广泛存在于自然界中,所降解产物对病害的抑制和植株的生长发育,具有良好的促进作用。滕少辉等[10]筛选出一株几丁质降解菌,经鉴定为鞘氨醇单胞菌。Mavingui[11]和张立阳[12]等分别发现了具有几丁质酶活性的高效菌株,经鉴定均属于芽孢杆菌属,这些菌株对病害的防治以及植株的生长都有良好的促进作用。本试验从山东茶园土壤中筛选出具有几丁质降解功能的菌株J4和J17。通过形态鉴定、生理生化鉴定和分子鉴定,发现J4和J17分别属于鞘氨醇杆菌属(Sphignobacterium)和芽孢杆菌属(Bacillus)。本研究得到的菌株与前人从自然界中筛选到的结果有一致性,说明这两个属中普遍存在着具有几丁质降解功能的菌株。
前人从自然界中筛选到诸多具有几丁质降解功能的菌株,从试验结果来看,各菌株的产酶能力存在较大差别。张立阳等[12]筛选到的Bacillussubtilis,几丁质降解酶活可达3.23 U/mL;孙菽蔚等[22]筛选到的Pseudoaltermonas,酶活可达116.2 U/mL;王海东等[16]筛选到的Aeromonashydrophlilla,产酶条件优化后酶活可达0.39 U/mL。本试验通过对J4和J17产酶条件进行优化,确定了菌株J4在pH 值7.0、温度30℃、转速200 r/min条件下培养,其产酶活性达到最高。菌株J17在pH值 7.0、温度25℃~30℃、转速180 r/min条件下培养,其产酶活性达到最高。两株最高酶活分别可达5.43 U/mL和4.80 U/mL。试验结果与前人有较大差别,有可能与菌株存在的环境、分离筛选所用的底物等方面存在着差异[16],从而导致酶活差异较大。

