白藜芦醇纳米结构脂质载体的制备
何建丹,赵海燕,朱迪冰,王少兵
(中南民族大学 药学院,湖北 武汉 430074)
1 引言
白藜芦醇(Resveratrol,Res)是一种非黄酮类多酚化合物,来源于花生、葡萄、虎杖等植物中[1,2],具有抗癌、抑菌、抗炎症、保护心血管、调节雌激素、保护神经和肝脏、抗氧化、美白等多种生理功能[1~4]。然而,由于白藜芦醇生物半衰期短(8~14 min),肝脏代谢迅速,导致其生物利用度仅为1%[4,5]。基于脂质的纳米系统如固体脂质纳米粒(SLN)由于其亚微米尺寸,易于扩大和制造,使用生理性脂质和控制释放性质而提高了亲脂性化合物的口服生物利用度[5,6]。Pandita D等制备的白藜芦醇固体脂质纳米粒(Res-SLN)与药物悬浮液相比白藜芦醇生物利用度提高了8.035倍[5]。
SLN采用天然或合成的固体脂质为载体,将药物包裹或分散于其中制成的固体胶粒结构体系。与其他胶体给药系统相比,具有颗粒尺寸小,生物相容性好、控制药物释放、增强药物靶向性等优势。但由于单一固体脂质易形成完美的晶格结构,导致在SLN储存过程药物被排挤出晶格,存在载药量低、易泄露等缺点[7~10]。纳米结构脂质载体(NLC)是在SLN基础上发展起来的第二代脂质纳米载体,在固体脂质载体中引入了一定比例的液体脂质,打破了原有晶格,减少药物的泄露并提高载药量和物理化学稳定性[10,11]。
本研究通过单因素和正交试验,以粒径、包封率和载药量为指标考察白藜芦醇纳米结构脂质载体的制备工艺和制剂处方。
2 实验部分
2.1 实验材料
仪器:高效液相色谱仪(Agilent 1100型,美国Agilent公司),电子天平(CP 214,上海奥豪斯),高速离心机(TGL-16C,上海安亭科学仪器厂),移液枪(Genex Beta,中国)。超滤离心管(Amicon○R Ultra-0.5,美国MILLIPORE公司)
试药:白藜芦醇(纯度99%,阿拉丁试剂(上海)有限公司),十二烷基硫酸钠(天津市致远化学试剂,批号20140520),单硬脂酸甘油酯(天津福晨化学试剂厂,批号20140922),油酸(国药集团化学试剂有限公司,批号20170320),吐温80(国药集团化学试剂有限公司,批号20141105),甲醇(色谱纯,美国天地);其它试剂均为市售分析纯。
2.2 色谱条件
色谱柱:Dikma Platisil ODS(250 mm × 4.6 mm, 5 μm),流动相:甲醇-0.3%磷酸水(65∶35),柱温:25 ℃,流速:1.0 mL/min,检测波长:306 nm,进样量:10 μL。
2.3 纳米结构脂质载体的制备方法
采用溶剂蒸发-低温固化法制备Res-NLC[12~14]::取处方量的白藜芦醇、固液脂质溶解于适量的有机溶剂中构成油相,在高于固体脂质熔点5~10 ℃温度下使其充分溶解。取处方量表面活性剂溶于一定量的水中形成均匀的水相。当水相加热至和有机相相同的温度时,将有机相在高速均质条件下缓慢地注入水相中,均质一段时间后,磁力搅拌使有机溶剂完全蒸发得半透明纳米乳。将所得初乳在机械搅拌下快速分散到0~2 ℃水中,冷搅拌后得白藜芦醇纳米结构脂质载体的溶液。
2.4 包封率和载药量的测定
超滤离心法[5,9]:取Res-NLC制剂加入1%十二烷基硫酸钠(SDS)超声使其充分溶解游离药物,再取此溶液加入至超滤离心管(MW∶100 KD),中,10000 r/min离心10 min,从外管取超滤液并用流动相稀释,液相检测得游离药物含量Wfree。另取适量Res-NLC混悬液,甲醇超声破乳5 min,测得药物总量Wtotal。
包封率计算公式:EE%=(Wtotal-Wfree)/Wtotal×100%;
载药量计算公式:DL%=(Wtotal-Wfree)/[(Wtotal-Wfree)+Wlipid]×100%。
2.5 粒径与粒径分布
取Res-NLC混悬液适量,通过0.45 μm的微孔滤膜过滤后,用超纯水稀释,置于超声波清洗仪中振荡5 min,使粒子分散均匀后用动态光散射仪(DLS)进行测定。
3 结果与讨论
3.1 单因素试验
3.1.1 制备工艺考察
按2.2节制备方法,由于选择的脂质熔点均在65 ℃左右,且白藜芦醇在高温下不稳定,故以70 ℃作为制备温度,保持其他条件不变,分别改变剪切时间、均质速度、注入方式、磁力搅拌时间、冷搅拌速度及时间制备Res-NLC溶液,测定药物的粒径或包封率,试验结果见表1和表2。由结果可知,其最佳制备工艺为在70 ℃时,将油相用注射器在12000 r/min均质速度下注入水相中剪切30 min,随后磁力搅拌0.5 h蒸发有机溶剂,并立即将形成的初乳在1000 r/min机械搅拌下冷搅拌30 min。

表2 白藜芦醇在不同制备工艺下的包封率(n=3)
3.1.2 制剂处方考察
(1)辅料的筛选。
保持处方中其他组分不变,分别选择不同固体脂质、表面活性剂和有机溶剂制备Res-NLC,分别考察每组制备的纳米粒的包封率。结果见表3。由表3可见,单硬脂酸甘油酯(GMS)作为固体脂质制备Res-NLC的包封率和载药量都较高于硬脂酸。GMS本身就是一种乳化剂,具有一定的自乳化性,可以在一定程度上起到增溶的作用,因此本实验选择GMS作为固体脂质。选择与GMS化学结构差别较大的油酸作为液态脂质,可以在纳米颗粒中产生更多的晶格缺陷,这些晶格缺陷可用于储存药物,提高纳米颗粒的载药量。表面活性剂为吐温80时制备的Res-NLC的包封率最高,因此选择吐温80作为表面活性剂。乙醇作为有机溶剂制备的NLC包封率较高,且相较于其他有机溶剂基本没有毒性,故选择乙醇为有机溶剂。
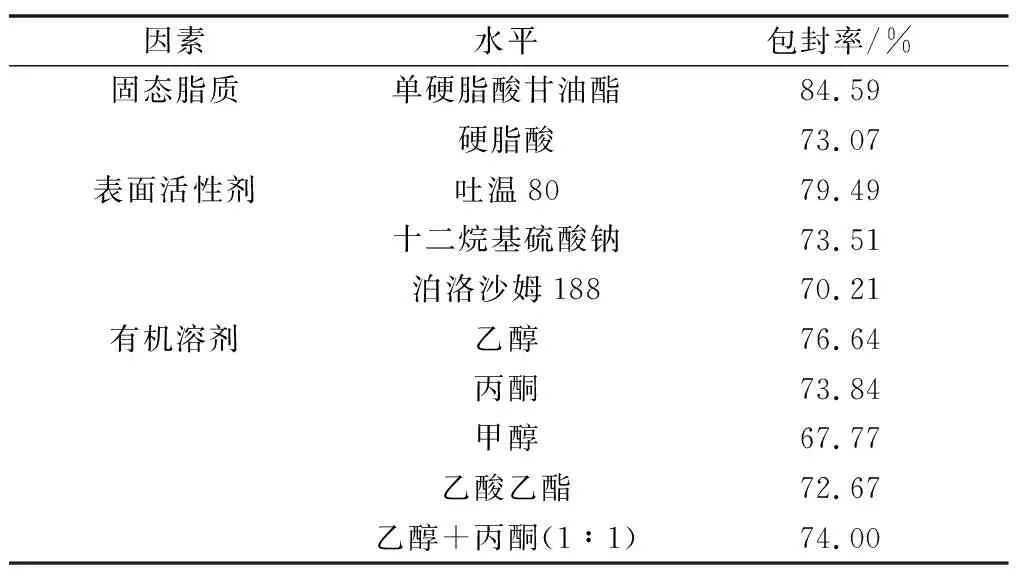
表3 白藜芦醇在不同辅料中的包封率(n=3)
(2)辅料用量的选择。
保持处方中其他组分不变,分别改变固液脂质、药脂比、表面活性剂和有机溶剂用量制备Res-NLC,分别考察每组制备的纳米粒的包封率和载药量,结果见表4。

表4 Res-NLC在不同辅料用量中的包封率和载药量(n=3)
当固体脂质:液体脂质=1∶1时,药物的包封率最大。液体脂质的浓度过低时,不足以破坏单硬脂酸甘油酯的晶格结构,而过多的液体脂质可能不利于纳米混悬液冷却形成纳米结构脂质载体,因此选择固液脂质比为1 : 1制备Res-NLC。
脂质总量对制剂包封率和载药量的影响结果表明随着脂质总量的增大,包封率逐渐增大,当脂质量较大时,溶解的药物量随之增大,当脂质量达到一定浓度时,投药量一定,所以包封率增加缓慢,而载药量随着辅料的增加而减小。
Res-NLC包封率和载药量随着药物用量的增大而减小,当投药量大幅度增加时,会有更多的药物向外水相逸失,因此造成包封率下降,当药物浓度过低时,载药量较低。随着表面活性剂用量的增大,包封率逐渐增大。
乳化剂可以改变脂质纳米粒中脂质的结晶行为,抑制颗粒形状的改变,避免脂质裸露于颗粒的表面,降低颗粒间发生聚集的可能性进而影响颗粒的稳定性。但是乳化剂含量过高时,多出的乳化剂只有一部分覆盖在颗粒的表面,另一部分可能以胶束的形式存在于体系中,这一部分乳化剂在体系中起不到稳定颗粒的作用,反而会无谓的增加毒性。
随着有机相浓度的增大,包封率先增大后减小。当有机溶剂为2 mL时,包封率最大。原因可能是当有机溶剂含量过低时,溶解的白藜芦醇有限,使其达到过饱和状态,使包封率降低,又保证使用有机溶剂较低原则,因此选择有机相为2 mL制备Res-NLC。
3.2 正交试验
根据单因素考察结果,选择脂质总量、药脂比、吐温80的用量、纳米乳与冷却水的比例为影响因素,固定其他因素进行正交试验设计和分析(表5和表6)。
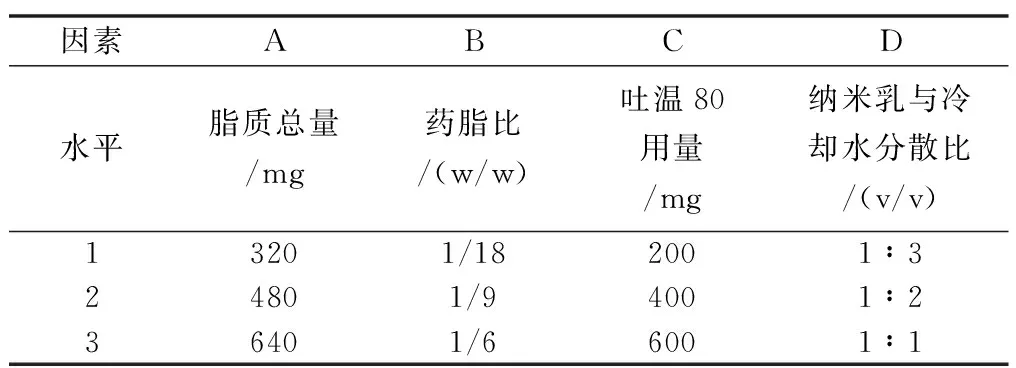
表5 制备Res-NLC正交设计的因素和水平
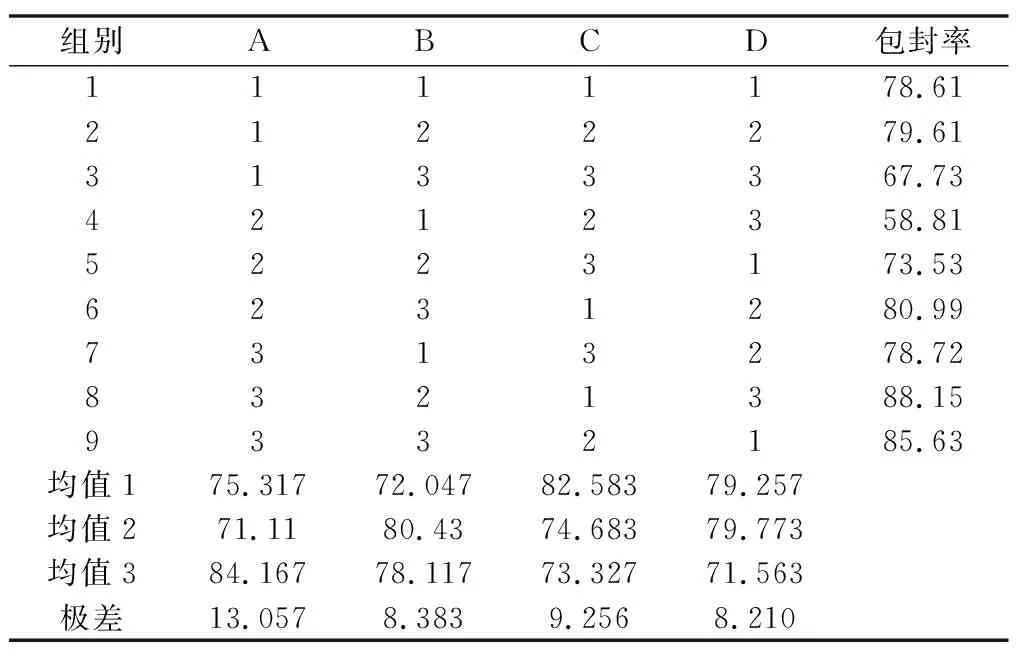
表6 正交设计制备Res-NLC的最佳条件研究
由表6中的极差值可得知,各因素影响的主次顺序是A>C>B>D,因此说明脂质用量、表面活性剂用量、药脂比、纳米乳与冷却水的比例对包封率的影响依次减弱。由此得知各因素的最优化组合A3B2C1D2;即脂质总量为640 mg,投药量70 mg,表面活性剂用量200 mg,纳米乳与冷却水分散比为1∶2。
4 Res-NLC和Res-SLN的比较分析
在最佳制备工艺和最优处方下制备Res-NLC和Res-SLN,测定其包封率、载药量和粒径,结果如表7。
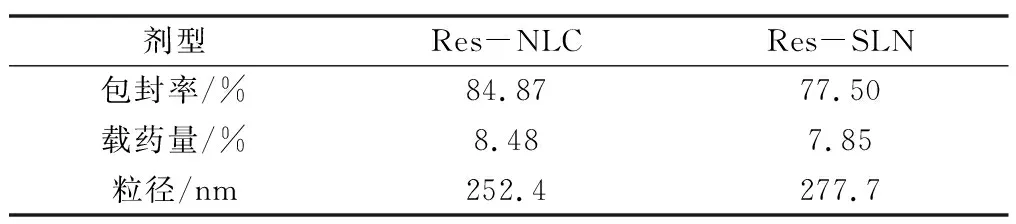
表7 Res-NLC和Res-SLN的包封率和载药量(n=3)

图1 Res-NLC的粒径分布
结果显示,Res-NLC的包封率和载药量均高于Res-SLN,其粒径略低于Res-SLN。
5 讨论
研究采用单因素和正交试验设计法,以包封率、载药量和粒径为指标筛选白藜芦醇纳米结构脂质载体的最佳工艺和最优处方,并比较最优处方下制备的Res-NLC和Res-SLN,所制备白藜芦醇纳米结构脂质载体包封率为84.87%,载药量为8.48%,均高于白藜芦醇固体脂质纳米粒,粒径为252.4nm,属于亚微米结构,适合口服给药和胃肠道吸收。其理化指标符合药典关于纳米粒子的质量标准。

