川崎病患儿外周血Th17细胞、γδT17细胞的变化及意义的研究*
刘志强,彭宇,邹峥,柯江维
(江西省儿童医院,南昌 330006)
川崎病(Kawasaki disease,KD)又称为皮肤黏膜淋巴结综合征 (mucocutaneous lymphnode syndrome,MCLS),临床上以持续性发热、口唇潮红、球结合膜充血、手足硬肿脱屑等皮肤、黏膜、淋巴结的炎性症状为主要表现。KD是一种自限性的以全身性血管炎为主要病理改变的疾病,5岁以下小儿最常见于,多数预后良好,部分可导致冠状动脉受累,大量流行病学资料显示川崎病引起的心血管系统并发症已成为发达国家儿童后天性心脏病最主要的病因[1]。KD的病因及发病机制至今尚未完全清楚,近年来研究表明,可能与一种或多种感染原触发机体的异常免疫应答反应密切相关。IL-17A是一种重要的促炎因子,Th17细胞和γδT17细胞是目前已知的主要的分泌IL-17A的细胞。本研究通过分析KD患儿外周血Th17细胞、γδT17细胞及其产生的IL-17A的变化,探讨Th17细胞、γδT17细胞与KD炎症损伤的关系。
1 材料和方法
1.1 一般资料 选取2015年3月至2017年9月来我院风湿免疫科住院治疗的川崎病患儿107例作为病例组,其中男65例,女42例,平均年龄2.7岁。入组标准:符合川崎病或不完全川崎病诊断标准[2]。另选同期来我院门诊体检的健康儿童63例作为对照组,其中男37例,女26例,平均年龄2.9岁。两组间儿童的性别、年龄比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,同时征得家长的同意并签署知情同意书。
1.2 主要仪器和试剂 TD5A-WS离心机 (湖南赛特湘仪离心机仪器离心机有限公司),FACSCantoⅡ流式细胞仪(美国BD公司),酶标仪(美国赛默飞世尔科技有限公司),洗板机(安图实验仪器有限公司),恒温孵育箱(美国赛默飞世尔科技有限公司),PE anti-human TCRγδ (美国 BD 公司),Alexa Fluor 488偶联 anti-human IL-17A McAb(美国BD公司),PerCP anti-human CD3 McAb (美国BD公司),PE anti-human CD4 McAb (美国BD公司),Human IL-17A ELISA Kit(杭州联科生物科技股份有限公司)。
1.3 研究方法
1.3.1 外周血Th17细胞、γδT17细胞的分析 所有研究对象入院时采集静脉血2ml,肝素抗凝,用淋巴细胞分离液出单个核细胞(PBMCs),用含10%胎牛血清的RPMI 1640培养液调整细胞密度为2×106/ml,取1ml细胞悬液铺至24孔细胞培养板,每孔加入豆蔻酰佛波醇乙酯(终浓度50ng/ml)、离子霉素(终浓度 1μg/ml)及莫能菌素(终浓度10μg/ml)吹打混匀,置于37℃、5%CO2条件下细胞培养箱内培养5h。收集培养后的各组细胞于流式上样管中,1000r/min离心5min,洗涤后用PBS重悬。取30μl细胞悬液加入到一流式上样管中,分别加入PerCP anti-human CD3 McAb及PE anti-human TCRγδ各 5μl进行胞外染色,另取 30μl细胞悬液加入到另一流式上样管中,分别加入PerCP antihuman CD3 McAb及PE anti-human CD4 McAb各5μl进行胞外染色,室温避光孵育20min;PBS洗涤后加入细胞固定剂和破膜剂,加入Alexa Fluor 488偶联anti-human IL-17A McAb,室温避光孵育20min,PBS洗涤后加500μl PBS重悬细胞,同时设立阴性对照和同型对照组;流式细胞仪检测,所有数据采用FACSDiva软件分析。
1.3.2 血清IL-17A测定 所有研究对象入院时用普通管采集静脉血1ml,3000r/min离心3min分离后得到血清,放-80℃冰箱保存,采用酶联免疫吸附法检测血清IL-17A表达水平。严格按照试剂盒步骤要求进行操作,制作标准曲线,测算标本的OD值所对应的浓度值进行数据统计。
1.4 统计分析 采用SPSS 19.0软件进行统计分析,结果用均数±标准差表示,组间差异采用单因素t检验,P<0.05表示差距有统计学意义。
2 结果
2.1 病例组和对照组外周血 γδT、γδT17、Th17、Th细胞含量的比较 γδT、γδT17、Th17细胞在病例组外周血CD3+T细胞中的比例 (11.94±2.37、3.71±1.66、1.82±0.66)显著高于对照组(7.01±0.61、1.22±0.51、0.62±0.28)(P<0.05),Th 细胞在病例组外周血CD3+T细胞中的比例(63.25±9.96)与正常对照组比例(61.98±2.77)相比无统计学差异(P>0.05)。 见表1。
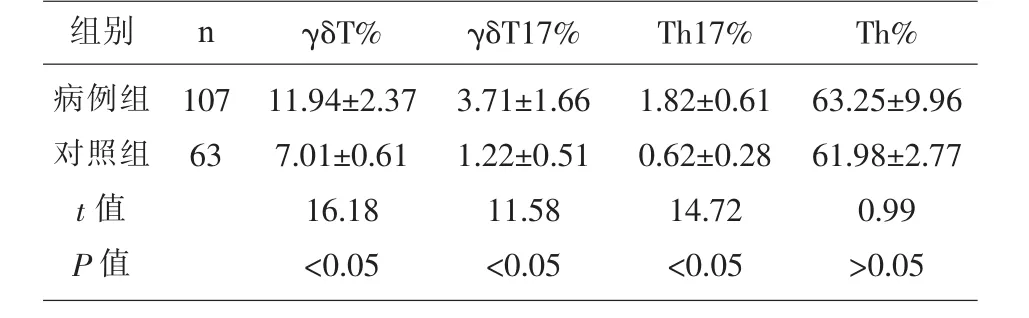
表1 病例组和对照组γδT、γδT17、Th17、Th细胞含量的比较(x±s)
2.2 病例组和对照组血清IL-17A含量的比较IL-17A 在病例组血清中的含量(11.26±3.51ng/l)显著高于对照组中的含量 (4.39±1.07ng/l)(P<0.05)。见表2。
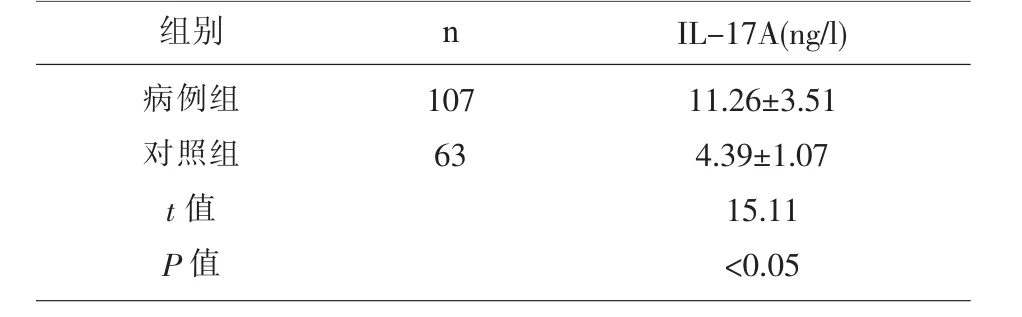
表2 病例组和对照组外周血IL-17A水平比较(x±s)
3 讨论
根据TCR不同,T细胞可分为αβT细胞和γδT细胞两大类。 αβT细胞(包括 CD4+、CD8+T细胞)是参与适应性免疫应答的主要T细胞群体,约占CD3+T细胞的90%~95%。γδT细胞(CD4-T细胞)是一类重要的固有免疫细胞,其百分数仅为CD3+T细胞的1%-10%,与αβT细胞不同,γδT细能更快地启动宿主体内免疫应答。αβT细胞的TCR识别抗原是主要组织相容性复合体(major histocompatibility-complex,MHC)类分子限制性。 而人的γδT细胞不表达谱系标记,对抗原的识别也无需MHC分子的辅助,即无MHC限制性。
γδT细胞具有各种生物学效应,其主要的效应特点是溶解靶细胞的细胞毒活性和分泌不同种类的细胞因子和趋化因子。γδT细胞还被认为是偶联固有免疫和适应性免疫的桥梁,与NK细胞、树突状细胞等免疫细胞共同构成机体抵抗病原微生物的第一道防御屏障[3]。γδT细胞作为免疫反应早期IL-17A的最重要来源,因其在多种感染性疾病和自身免疫性疾病中发挥重要作用而备受关注。研究发现,HIV感染疾病快速进展者中,VδT细胞的比例显著增高,并引起HIV感染者CD4+T细胞减少,进而加速疾病进展[4]。刘红利等[5]研究发现,桥本甲状腺炎患者的γδT细胞通过表达共刺激分子CD40L和ICOS为B细胞提供协同刺激信号辅助其产生抗体,提示γδT细胞在桥本甲状腺炎的发病机制中可能发挥着重要作用。Daguzan等[3]发现巨细胞病毒感染后,γδT细胞在数目明显增多,提示巨细胞病毒感染影响和改变了T细胞亚群的分布。本研究结果显示,与健康对照组相比,KD患儿γδT细胞的比例显著增加,而Th细胞无明显差异。回顾患儿病史,患儿集中在发热持续3-5d就诊,尚处于疾病早期,而γδT细胞是一类重要的固有免疫细胞,它们能更快地(数小时内)启动宿主体内免疫应答,且只需少量细胞就能发挥重要作用。因此我们认为KD患儿发病早期γδT细胞发生了高度活化,γδT细胞参与了KD早期的炎症反应。
IL-17A是一种促炎因子,主要由T细胞诱导合成,是T细胞诱导的炎性反应的早期启动因子,能够募集中性粒细胞,促使T细胞激活,还可以促使上皮细胞、内皮细胞合成和分泌IL-6、IL-8等刺激因子,加重局部炎症反应[6]。王振杰等[7]研究发现风湿免疫相关性血细胞减少症患者血清中IL-17、IL-12表达水平均高于正常对照组人员;提示介导自身免疫的IL-17等炎性因子表达水平和风湿免疫相关性血细胞减少症患者的造血细胞炎性受损相关病变过程关系密切。帅可鑫等[8]对过敏性紫癜患儿随访时发现复发组患儿血清IL-17明显高于非复发组,提示IL-17可以用来检测过敏性紫癜患儿病情。刘岚等[9]亦研究发现IL-17可能参与了巨细胞病毒性肝炎的发病过程,在病毒性肝炎的发病过程中具有重要的临床意义。本研究发现,与健康对照组相比,KD患儿血清IL-17A的含量显著增加,高水平IL-17A与KD的发病密切相关。IL-17A作为促炎因子参与了KD发生,对其浓度进行检测,可以为KD的炎症干预提供有效依据。
Th17细胞是近年发现的一类T细胞亚群,可通过分泌 IL-17 (IL-17A)、IL-17E、IL-6、IL-21 等来促进自身免疫性炎症疾病的发生和发展[10]。一直以来Th17细胞被认为是IL-17A的主要来源。苗静[11]等研究发现,过敏性紫癜患儿急性期血浆IL-17水平增高,Th17细胞功能增强;Th17细胞和IL-17共同参与儿童过敏性紫癜的发病机制。然而进一步研究发现Thl7细胞的作用机制并不能解释宿主免疫早期起重要作用的IL-17的产生。现在已知产生IL-17A的适应性免疫细胞主要包括Th17细胞和Tc17细胞[12];产生IL-17A的固有样淋巴细胞主要包括γδT细胞和NKT细胞,其中γδT细胞产生IL-17A的数量甚至超过Th17细胞[13]。在过敏性哮喘患者的γδT细胞中IFN-γ+/IL-17A+比例大幅度降低[14],说明γδT细胞可能通过分泌IL-17A细胞因子参与哮喘的发病。薛春雪等[15]研究发现,γδT细胞有可能以γδTCR非依赖的作用方式活化,并通过释放IL-17A参与H1N1重症感染小鼠早期肺组织炎性损伤过程。徐玲[16]等研究亦发现,巨细胞病毒感染组IL-17水平较对照组升高,其表达水平与γδT细胞表达呈正相关,提示γδT细胞可能也参与了巨细胞病毒感染患儿IL-17的产生。我们研究发现,相对于健康对照组,γδT17细胞和Th17细胞比例在病例组中明显升高,表明γδT17细胞和Th17细胞均参与了KD早期的炎症反应。有研究表明,当有炎性因子存在时,Th17细胞由CD4+T淋巴细胞分化,并促进细胞因子IL-17的产生,这类炎症因子主要是转化生长因子(TGF-β)[17]。历风元等[18]研究发现慢性阻塞性肺疾病模型组肺组织中TGF-β1的含量较对照组肺组织明显升高。Peters等[19]在研究肺纤维化时证实IL-17通过诱导TGF-β和胶原蛋白产生直接促进肺纤维化。因此,我们认为Th17细胞的增多可能是因为γδT17细胞产生的IL-17A通过TGF-β对其的趋化募集作用所致[20]。
虽然对IL-17A研究主要集中在Th17细胞,但是γδT细胞及其分泌的IL-17A在炎症反应方面的作用越来越受重视,至今它们在儿童KD中的作用尚未完全明确。今后应进一步深入研究Th17细胞和γδT细胞及IL-17A在儿童KD中的发病机制,为临床炎症干预和开发新药提供理论依据。

