UV-B辐射增强对大豆根系活性氧代谢及 抗氧化系统的影响
杨 璐,赵天宏
(1.中国气象局 沈阳大气环境研究所,辽宁 沈阳 110166;2.锦州市生态与农业气象中心,辽宁 锦州 121001; 3.沈阳农业大学 农学院,辽宁 沈阳 110866)
随着工业的发展,氟氯烃类气体被成倍释放到大气中,导致大气臭氧层变薄,部分地区出现臭氧层“空洞”现象[1]。臭氧层对地球最大的作用就是吸收紫外线。紫外线根据其波长,由长至短可分为UV-A、UV-B和UV-C。臭氧层对UV-C(<280 nm)的吸收能力很强,即便臭氧层减少了90%,也鲜有UV-C到达地面;臭氧层对UV-A(320~400 nm)的吸收能力虽然很弱,但UV-A引起的生物学效应可以小到微不足道[2]。因此,臭氧层变薄导致的直接结果是太阳辐射中到达地面的UV-B(280~320 nm)辐射增强,并有继续增强的趋势。
20世纪30年代,国外出现了紫外辐射对植物影响的报道。60年代初期,前苏联杜布罗夫撰写的《紫外辐射对植物的作用》一书,综述了1930-1960年全球紫外辐射对植物影响的有关研究,其中包括紫外辐射对种子的萌发、生长发育等以及对农业的影响[3]。随着臭氧层空洞的发现,UV-B辐射变化对各种生物的影响的研究引起国际科技界广泛关注,主要包括UV-B辐射变化对植物生理生化方面的影响、对植物生长发育、形态结构及产量品质的影响以及对植物群落及生态系统的影响等[4-22],并随之进入高峰期,成为当前全球环境变化研究的重要课题。
国内外鲜有以大豆根系为主要研究对象,在UV-B辐射增强胁迫下,探究其活性氧代谢规律及其抗氧化系统的响应。为今后研究UV-B辐射增强对作物的影响以及大豆根系逆境生理生态等方面提供一定的参考。
1 材料和方法
1.1 试验材料
以大豆(Glycinemax)栽培品种铁丰29为试材。试验在中国科学院沈阳野外农田生态系统生态站进行,对大豆进行UV-B胁迫试验。增强UV-B辐射处理用40 W的UV-B灯管(灯管生产商为:北京电光源研究所,灯管辐射范围为:280~320 nm) 产生的UV-B辐射先通过0.08 mm乙酸纤维素膜过滤,然后照射大豆植株,模拟增强0.32 W/m2的UV-B辐射(相当于试验地夏日平均UV-B辐射的105%左右)。
1.2 试验设计
本试验共设置2个处理,即:CK(UV-B辐射为正常环境强度)和UV(增强UV-B,即UV-B 辐射强度为0.32 W/m2)、每个处理设置3次重复。大豆出苗20 d后开始胁迫试验,9 h/d(8:00-17:00),分别于大豆分枝、开花、结荚和鼓粒期取样。
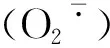
2 结果与分析
2.1 UV-B辐射增强对大豆根系膜脂过氧化的影响
膜脂过氧化是指在自由基诱发下生物膜中的不饱和脂肪酸发生的过氧化反应。膜脂过氧化作用不仅可使生物膜相分离,破坏生物膜的正常功能,而且产生的MDA及其他类似物质也能直接对植物细胞产生毒害作用[25]。
2.1.1 UV-B辐射增强对大豆根系MDA含量的影响 生物体内的自由基作用于脂质而产生的细胞膜脂过氧化反应,其氧化终产物MDA及其他类似物质会引起生物体内的蛋白质、核酸等生命大分子的交联聚合,并且这些物质具有细胞毒性。MDA产生数量的多少可以代表植物体内的膜脂过氧化程度,也可以间接地反映植物组织的抗氧化能力[19]。如图1所示,从大豆的不同生育时期来看,随着生育时期的变化,各处理大豆根系的MDA含量呈上升趋势。且不同处理间,经过UV-B辐射胁迫下的大豆根系的MDA含量高于同时期对照组的MDA含量,即UV>CK。具体表现为:与CK相比,在分枝期,UV处理升高了58.5%;开花期,UV处理升高了53.5%;结荚期,UV处理升高了64.8%;鼓粒期,UV处理升高了69.8%。所有生育时期,UV处理与CK相比,差异均显著。上述结果表明,随着生长发育的推进,大豆根系MDA含量增加,且UV-B胁迫可引起各时期大豆根系中MDA含量高于正常值,即UV-B胁迫能够加剧植物细胞膜脂过氧化程度。
图中标记不同小写字母表示处理间差异达 到P<0.05显著水平。图2-10同。 Different lowercase letters indicate significant differences at 0.05 levels. The same as Fig.2-10.
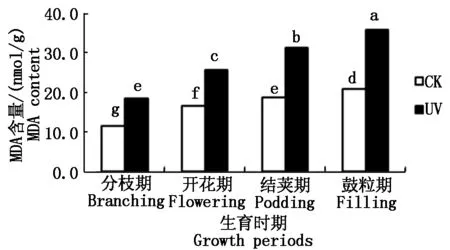
2.1.2 UV-B辐射增强对大豆根系相对电导率的影响 植物根系的相对电导率是反映植物膜脂化程度的重要指标之一,相对电导率越高,说明植物膜脂的透性越高,植物膜脂化的程度越高,对植物细胞的毒害作用越大,植物的抗氧化能力越弱。如图2所示,从大豆的不同生育时期来看,随着生育时期的变化,各处理大豆根系的相对电导率呈上升趋势。且不同处理间,经过UV-B辐射胁迫下的大豆根系的相对电导率高于同时期对照组的相对电导率,即UV>CK。具体表现为:与CK相比,在分枝期,UV处理升高了68.8%;开花期,UV处理升高了81.4%;结荚期,UV处理升高了19.5%;鼓粒期,UV处理升高了26.6%。所有生育时期,UV处理与CK相比,差异均显著。上述结果表明,随着生长发育的进行,大豆根系相对电导率增加,且UV-B胁迫可引起各时期大豆根系中相对电导率高于正常值,即UV-B胁迫可以使大豆根系膜相对透性增加。
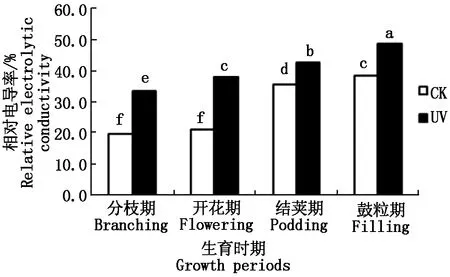
图2 不同处理下大豆根系相对电导率的变化Fig.2 The soybean roots′ relative electrolytic conductivity under different processing
2.2 UV-B辐射增强对大豆根系活性氧代谢的影响
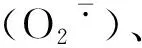
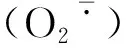
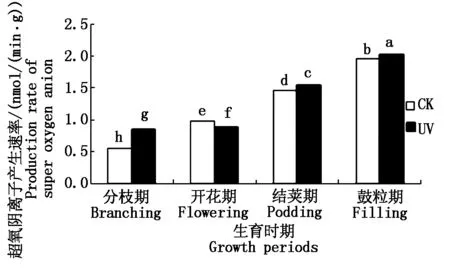
图3 不同处理下大豆根系超氧阴离子产生速率的变化Fig.3 The soybean roots′ super oxygen anion production rate under different processing
2.2.2 UV-B辐射增强对大豆根系H2O2含量的影响 H2O2是活性氧的重要的代表之一,其能够毒害植物组织。增强UV-B胁迫下,H2O2的含量变化,可间接反映大豆根系的受害程度。如图4所示,从大豆的不同生育时期来看,随着生育时期的变化,对照组大豆根系的H2O2含量呈升高趋势,而经过增强UV-B辐射胁迫下的大豆根系的H2O2含量呈先降低、后升高的趋势,且开花期的H2O2含量为最低值。不同处理间,各时期H2O2含量均表现为UV>CK。具体表现为:与CK相比,在分枝期,UV处理升高了69.9%;开花期,UV处理升高了9.9%;结荚期,UV处理升高了5.0%;鼓粒期,UV处理升高了19.9%。所有生育时期,UV处理与CK相比,差异均显著。上述结果表明,随着生长发育的进行,大豆根系H2O2含量整体增加,且UV-B胁迫可引起各时期大豆根系中H2O2含量高于正常值。
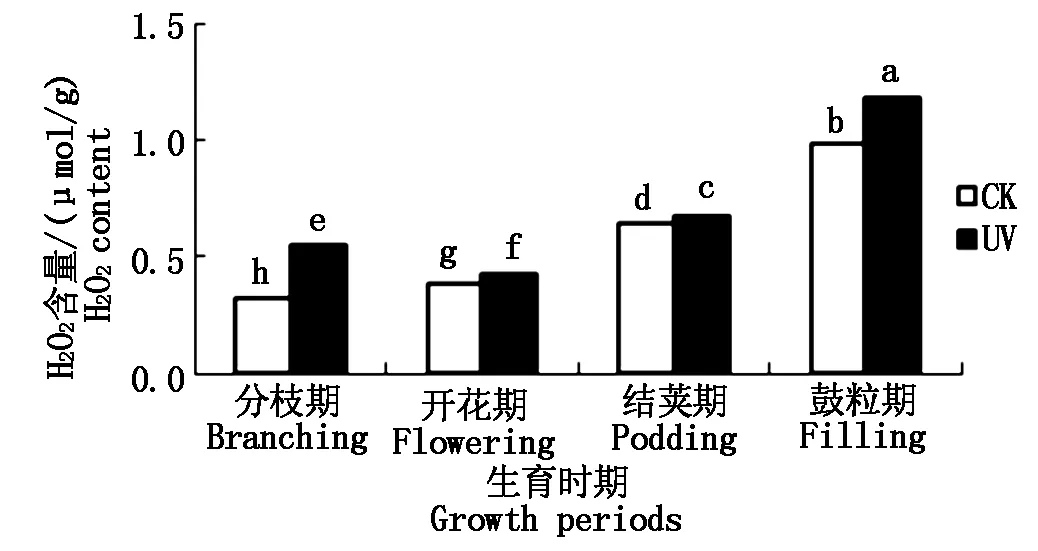
图4 不同处理下大豆根系H2O2含量的变化Fig.4 The soybean roots′ H2O2 content under different processing
2.3 UV-B辐射增强对大豆根系保护酶活性的影响
生物体对活性氧的积累也具有相应的适应能力和抵抗能力,具体表现为在生物体内拥有一套完善的抗氧化防御系统,又称活性氧清除系统,包括酶促系统(SOD、POD、CAT等)和非酶促性的活性氧清除剂(抗氧化剂)[25]。
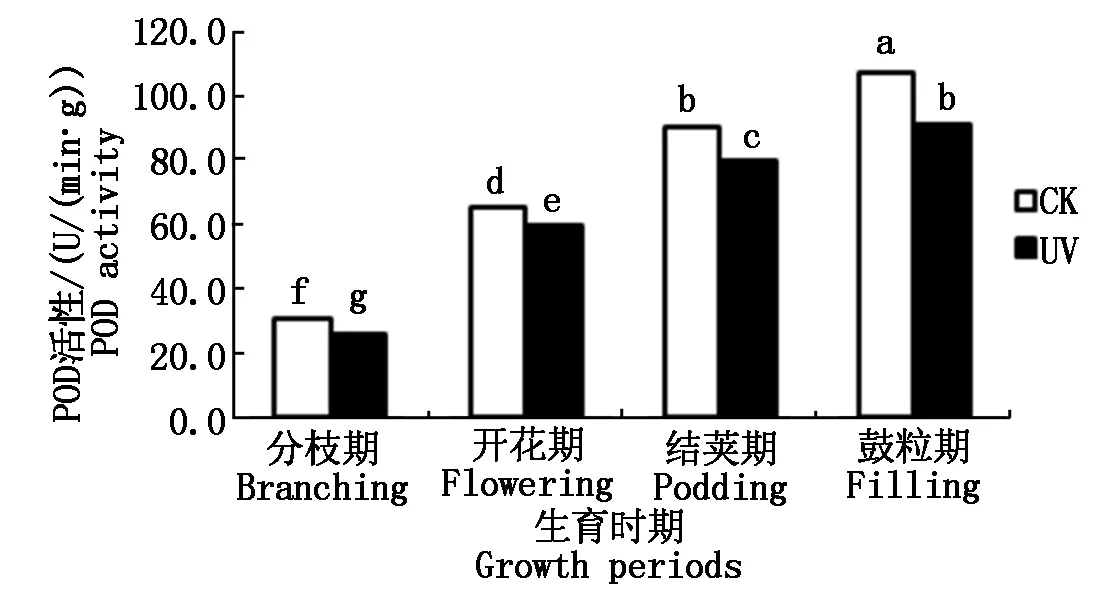
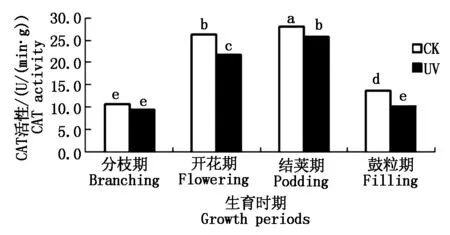
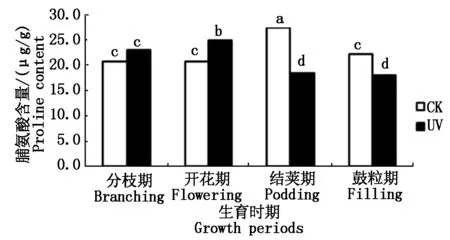
2.3.1 UV-B辐射增强对大豆根系SOD活性的影响 SOD是一种源于生命体的活性物质,是酶促防御系统中最主要的保护酶之一,具有特殊的生理活性,能消除生物体在新陈代谢过程中产生的有害物质,是生物体内清除自由基的首要物质[19]。如图5所示,从大豆的不同生育时期来看,随着生育时期的变化,对照组大豆根系的SOD活性呈先升高后降低趋势,且开花期达到最大值。而经过增强UV-B辐射胁迫下的大豆根系的SOD活性呈降低趋势。不同处理间,分枝期SOD活性表现为UV>CK,其他时期均表现为UV 图5 不同处理下大豆根系SOD活性变化Fig.5 The soybean roots′ SOD activity under different processing 2.3.2 UV-B辐射增强对大豆根系POD活性的影响 过氧化物酶(POD)是生物体内产生的氧化还原酶的一类,它们能催化生物体内很多生理生化反应。POD是以H2O2为电子受体的一种氧化酶。在植物细胞中,POD是酶促防御系统中的主要保护酶之一,它是定位于叶绿体中的专一酶,可将H2O2转化为H2O[19]。如图6所示,从大豆的不同生育时期来看,随着生育时期的变化,各处理大豆根系的POD活性呈上升趋势。且不同处理间,经过增强UV-B辐射胁迫下的大豆根系的POD活性低于同时期对照组的POD活性,即UV 图6 不同处理下大豆根系POD活性变化Fig.6 The soybean roots′ POD activity under different processing 2.3.3 UV-B辐射增强对大豆根系CAT活性的影响 CAT是一种酶类清除剂,又称为触酶,是清除H2O2的另一种关键酶,它催化H2O2分解为H2O和O2。CAT主要存在于生物体细胞内的过氧化体中,主要是清除过氧化体中的H2O2,其他部分产生的H2O2可扩散到过氧化体中而部分被CAT清除[19]。如图7所示,从大豆的不同生育时期来看,随着生育时期的变化,各处理大豆根系的CAT活性呈先上升后骤降趋势。且不同处理间,经过增强UV-B辐射胁迫下的大豆根系的CAT活性低于同时期对照组的CAT活性,即UV 图7 不同处理下大豆根系CAT活性变化Fig.7 The soybean roots′ CAT activity under different processing 2.4.1 UV-B辐射增强对大豆根系AsA含量的影响 抗坏血酸(AsA),即维生素C,维生素的一种,是一种高活性的物质,它作为生物体内应对活性氧伤害而产生的相应保护系统成员之一,参与了许多代谢过程。是近年来植物衰老和逆境胁迫等活性氧伤害研究的重点研究对象[20]。如图8所示,从大豆的不同生育时期来看,随着生育时期的变化,各处理大豆根系的AsA含量呈先升高后降低趋势,结荚期达到最大值。不同处理间,开花期表现为,经过增强UV-B辐射胁迫下的大豆根系的AsA含量高于同时期对照组的AsA含量,即UV>CK,其他时期均表现为UV 图8 不同处理下大豆根系AsA含量的变化Fig.8 The soybean roots′ AsA content under different processing 2.4.2 UV-B辐射增强对大豆根系Car含量的影响 类胡萝卜素(Car)是一种保护性物质,常作为植物细胞内重要的抗氧化物质。它可直接与活性氧反应,清除活性氧[19]。如图9所示,从大豆的不同生育时期来看,随着生育时期的变化,各处理大豆根系的Car含量呈先升高后降低趋势,结荚期达到最大值。不同处理间表现为,经过增强UV-B辐射胁迫下的大豆根系的Car含量低于同时期对照组的Car含量,即UV 图9 不同处理下大豆根系Car含量的变化Fig.9 The soybean roots′ Car content under different processing 2.4.3 UV-B辐射增强对大豆根系脯氨酸含量的影响 脯氨酸是生物体蛋白质的组成成分之一。在生物体受到逆境胁迫的条件下,生物体内的脯氨酸大量积累,因此,生物体内的脯氨酸含量也是反映生物抗逆性的一项重要指标之一[19]。如图10所示,从大豆的不同生育时期来看,随着生育时期的变化,对照组大豆根系的脯氨酸含量呈先基本持平而后升高最后降低的趋势,结荚期达到最大值;而在经过增强UV-B辐射胁迫下的大豆根系的脯氨酸含量趋势为先升高、后降低。不同处理间,分枝期和开花期表现为,经过增强UV-B辐射胁迫下的大豆根系的脯氨酸含量高于同时期对照组的脯氨酸含量,即UV>CK,结荚期和鼓粒期表现为UV 图10 不同处理下大豆根系脯氨酸含量的变化Fig.10 The soybean roots′ Proline content under different processing 本试验中,大豆根系超氧阴离子产生速率在开花期,出现了UV-B胁迫较CK超氧阴离子产生速率低的现象,分析其原因,可能是由于大豆根系在受到UV-B胁迫后,产生的一个应激反应,一些保护性物质包括保护酶等激增,使大豆根系短期内超氧阴离子的产生速率降低,但经过长时间的胁迫,大豆根系的自我保护机制达到限度,无法抵御长时期的胁迫,以致结荚期大豆根系超氧阴离子的产生速率又升高到高于CK,这与前人研究结果相似[26]。H2O2含量也在开花期出现异常波动,开花期H2O2含量低于分枝期和结荚期,可能也是应激反应所造成的。 同理,SOD活性在分枝期与其他生育时期不同,表现为UV-B胁迫下的SOD活性高于CK值。这说明分枝期大豆根系受到胁迫后,活性氧代谢加剧,诱导大豆根系实行自我防护机制,产生SOD清除活性氧,致使开花期大豆根系活性氧含量相对较少,代谢相对较不旺盛。但大豆根系的自我防御系统的抵抗能力是有限的,随着胁迫时间的延长,结荚期开始,活性氧对大豆根系产生的伤害,便无法抵消。同理还有AsA活性和脯氨酸含量的变化。说明UV-B胁迫对大豆根系的酶促系统有一定的负效应,植物体内的保护性酶和保护性物质组成的保护性系统可以在一定范围内清除活性氧,减轻膜伤害。 通过本试验可以得出,UV-B辐射增强对大豆根系活性氧代谢及抗氧化系统的影响结果,并且在UV-B辐射增强对作物的影响以及大豆根系逆境生理生态等方面的研究具有一定参考意义。但由于时间及水平有限,更加深入的生理生化作用机理,尚需要进一步研究。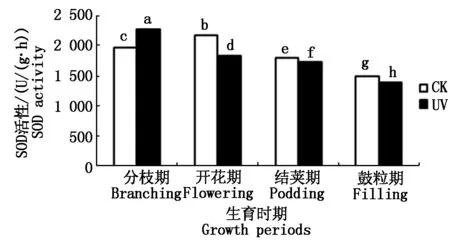
2.4 UV-B辐射增强对大豆根系保护性物质的影响


3 结论与讨论


