农杆菌介导抗除草剂基因bar和抗虫基因cry1ab/ac 转化甘蓝型油菜的研究
陈张彬,张振乾,2,陈 浩,刘忠松,2,熊兴华, 邬贤梦,2,官 梅,2,陈社员,官春云,肖 钢,2
(1.湖南农业大学 农学院,湖南 长沙 410128;2.水稻油菜抗病育种湖南省重点实验室,湖南 长沙 410128)
我国是世界上油菜栽培面积最大的国家,年产菜籽维持在1 200万t以上,目前,菜籽油占我国植物油消费的40%[1]。草害和虫害是目前世界油菜生产上影响菜籽产量的两大问题。我国冬油菜一般在9-10月份播种。此段时间杂草生长迅速,油菜幼苗往往竞争不过杂草,造成油菜生长弱小甚至死亡,严重影响油菜产量。研究表明,长江下游地区冬油菜田草害面积达种植面积的 46.9%,一般年份会造成油菜减产 10%~20%,草害严重时甚至减产50%以上[2]。另外,田间杂草是多种油菜害虫和病菌的宿主,杂草多的田块往往油菜病虫害发生更严重。我国油菜以冬油菜为主,虫害较其他春夏生长的作物要轻。但在苗期菜青虫、猿叶虫等鳞翅目、鞘翅目害虫造成的危害也不小。通过导入外源抗性基因的方法,使油菜产生除草剂抗性和抗虫性,既节省了劳动力又减少杂草和病虫害对油菜产量的影响,无疑是一个低成本且行之有效的方法。
草铵膦乙酰转移酶基因(bar),来源于吸水链霉菌,该基因作为筛选标记已被广泛运用于基因工程领域,含有该基因的油菜在加拿大、巴西、阿根廷、澳大利亚等国家已批准大规模种植[3]。由于种植了抗除草剂油菜,2000-2013年,加拿大油菜单产从1 330 kg/hm2增加到 2 025 kg/hm2[4]。在加拿大种植抗除草剂油菜的收益比普通油菜高13%左右[5-6]。种植抗除草剂油菜增加加拿大菜籽的国际市场竞争力,使加拿大成为全球最大的菜籽出口国。
苏云金芽孢杆菌(Bacillusthuringiensis,Bt)是目前最成功的用于防治害虫的昆虫病原菌。其杀虫能力来自菌体内的Bt毒蛋白,目前共报道了500多个Bt毒蛋白,该蛋白是Bt菌内芽孢形成过程中产生的杀虫晶体蛋白,可与昆虫肠道的特异性受体结合,引起细胞膜穿孔,破坏细胞渗透平衡,细胞肿胀破裂,最终导致昆虫停止进食继而杀死害虫[7]。由于动物肠道无该特异性受体,因此,普遍认为,Bt毒蛋白对动物无不良影响[8]。研究已证实,Bt毒蛋白对鳞翅目(Lepidoptera)、鞘翅目(Coleoptera)、直翅目(Orthoptera)、双翅目(Diptera)、同翅目(Homoptera)、膜翅目(Hymenoptera)多种昆虫,以及线虫、原生动物和螨类等均具有特异性的杀虫活性[9-13]。Bt毒蛋白已被广泛运用在植物抗虫研究中,目前,Bt抗虫棉和玉米在全球的广泛商业化种植,极大地减少了化学农药的使用及生产成本。
本研究所用Bt毒蛋白基因cry1ab/ac(GenBank序列号EU816953)是由cry1ab基因(GenBank序列号X54939)和cry1ac基因(GenBank序列号Y09787)融合而成[14],其编码的毒蛋白Cry1Ab/Ac对鳞翅目害虫有很高的毒性。在cry1ab/ac基因之前,还加上了来源于拟南芥的基因表达增强子序列(拟南芥乙醇脱氢酶基因5′-UTR序列,The 5′-UTR sequence ofAtADHgene),以增加cry1ab/ac在油菜中的表达量。通过农杆菌介导的方法,得到了转bar和转cry1ab/ac基因的油菜材料。
1 材料和方法
1.1 试验材料
植物材料:受体油菜材料为湘油15。
载体和菌株:pFGC5491植物表达载体、大肠杆菌菌株DH5α、农杆菌菌株GV3103为湖南农业大学油料作物研究所保存。
基因和引物:cry1ab/ac融合基因(EU816953)经密码子优化以适合在甘蓝型油菜中表达,AtADH5′-UTR序列信息来自植物表达载体pRI101.AN(TaKaRa,日本)。AtADH5′-UTR连接cry1ab/ac之前,DNA序列由苏州泓迅生物科技股份有限公司合成。根据优化后的cry1ab/ac基因和pFGC5491载体(AY310901)上的bar基因序列设计特异性检测引物,cry1-F:5′-AGGCAAGGATTCTCCCACAGGT-3′,cry1-R:5′-TGGTAGATGTGGATGGGAAGTG-3′,产物大小390 bp;bar-F:5′-AGATC TCGGTGACGGGCAGGAC-3′,bar-R:5′-GGACTGGGCTCCACGCTCTACAC-3′,产物大小250 bp。
1.2 试验方法
1.2.1 Bt毒蛋白基因表达载体pFGC-Bt的构建和农杆菌工程菌的制备 合成cry1ab/ac融合基因和AtADH5′-UTR,加入BamH Ⅰ和NcoⅠ酶切位点。将合成片段用BamH Ⅰ和NcoⅠ酶切,与用同样酶切处理的pFGC5491植物表达载体用T4DNA连接酶连接,构建成Bt毒蛋白基因表达载体pFGC-Bt。利用冻融法将载体转入农杆菌GV3101中。
1.2.2 植物表达载体pFGC-Bt在油菜中的遗传转化 采用农杆菌介导油菜下胚轴的遗传转化法,取萌发好的油菜种子用无菌解剖刀将下胚轴切为0.8~1.0 cm的小段。将切好的外植体完全浸泡入菌液中30 min后转移到铺有无菌滤纸的共培养培养基上,23 ℃黑暗培养3 d。将共培养后的外植体放入愈伤组织诱导培养基中,24 ℃,光照16 h/黑暗8 h。以0.4%浓度的除草剂basta(草铵膦)为筛选压,14 d继代一次。将愈伤组织转移到分化培养基中,24 ℃,光照16 h/黑暗8 h培养,14 d继代一次直至出现绿苗。28 d后将愈伤当幼茎抵抗筛选压生长到3~4 cm 时,切下转移至生根培养基中生根培养14~28 d。
1.2.3 除草剂筛选T1转化植株 表达载体pFGC-Bt上带有除草剂基因bar,因此,转基因植株也会具备一定的除草剂抗性。将T0植株上的种子都收下,播种在盆中,待苗长至二~三叶期时,用0.6%的basta溶液喷洒幼苗,没有死亡的植株留作下一步检测。另外,以0.6%的basta溶液喷洒种在田间的非转基因植株湘油15作为阴性对照。
1.2.4 PCR检测转化植株 PCR检测转化植株:选取表现为basta抗性的植株,CTAB法提取转化植株总DNA,利用引物cry1-F、cry1-R进行PCR扩增(扩增程序:94 ℃ 4 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 45 s ,35个循环;72 ℃ 5 min),1%琼脂糖凝胶电泳检测。
1.2.5 双抗体夹心免疫层析技术检测Cry1Ab/Ac毒蛋白 使用武汉优博生物技术有限公司生产的Bt转基因Cry1Ab/Ac毒蛋白快速检测试纸检测转基因植株是否表达Cry1Ab/Ac毒蛋白。试剂盒对Cry1Ab/Ac毒蛋白的检测限是100 ng/mL。取1 g油菜幼嫩叶片放入研钵,加上1 mL试剂盒所带的蛋白提取液,研磨后将匀浆转入2 mL离心管中,2 000 r/min离心5 min。取上清液进行检测,具体操作见产品说明书。
1.2.6 转基因油菜离体抗虫检测 温室内播种湘油15号和T1转基因油菜,待其生长至5~6片真叶时,取油菜同一部位健康、无病虫害叶片(尽量保证所采叶片大小、老嫩程度一致)。叶片采摘后,立即放入预先铺有双层滤纸(用无菌水保湿)的培养皿中,取非转基因油菜饲喂的10日龄菜青虫,按照1头/皿接种,3日后统计叶片损伤及幼虫发育情况(每个株系生物学重复3次,试验重复3次)。
1.2.7 种子品质分析 菜籽的含油量、脂肪酸组成和硫代葡萄糖苷含量决定其品质。通过索氏抽提法(NY/T 4-1982)和近红外光谱技术对菜籽的上述指标进行了测定。
2 结果与分析
2.1 转基因的获得及basta 筛选转化植株
以甘蓝型油菜湘油15下胚轴为外植体,通过农杆菌侵染、愈伤组织分化出苗、生根培养等步骤,本研究获得了7株T0转cry1ab/ac基因油菜再生苗(图1)。将7株苗上的种子分株收获,全部播种在花盆中,待2~3片叶时,喷洒0.6%的除草剂basta溶液,有部分T1幼苗存活下来(图2)。作为对照,湘油15油菜喷洒0.6%的basta后全部死亡。试验结果表明,经草铵膦喷洒存活下来的T1转基因油菜植株为阳性植株,转bar基因的转基因油菜植株对草铵磷具有很好的抗性(图3)。

A.油菜种子萌发;B.下胚轴外植体; C.愈伤组织形成; D.愈伤组织分化成苗;E.转基因苗。 A.Rapeseed germination;B.Hypocotyl explants;C.Callus formation; D.CallusDifferentiation into seedlings;E.Transgenic seedlings.

图2 除草剂basta处理T1转基因油菜Fig.2 basta treatment to T1 basta-resistant rape

图3 除草剂basta处理湘油15Fig.3 basta treatment to Xiangyou 15
2.2 PCR检测转化植株
用CTAB法提取8株T1转化苗的总DNA,以此为模板,用检测引物进行PCR扩增,1.5%琼脂糖凝胶检测,以湘油15为阴性对照,重组质粒pFGC-Bt为阳性对照。凝胶电泳结果显示,从8株转基因苗中都扩增出cry1ab/ac和bar基因目的片段(图4),说明cry1ab/ac和bar基因已被成功转化到油菜中。
2.3 Cry1Ab/Ac毒蛋白定性检测
Bt转基因Cry1Ab/Ac毒蛋白快速检测试纸应用双抗体夹心免疫层析的原理,在样品泳动过程中,样品中的抗原先与胶体金标记的抗体A结合,继而与检测线上特异性单克隆抗体B结合形成双抗体夹心复合物。如果样本中抗原含量大于限量,对照线(Control line)和检测线(Test line)显红色,结果为阳性;反之,只有对照线显红色,而检测线不显色,结果为阴性。从图5可以看到,11个转基因材料的对照线和检测线都显红色,说明在这11株转基因油菜中都检测到有Cry1Ab/Ac蛋白表达。
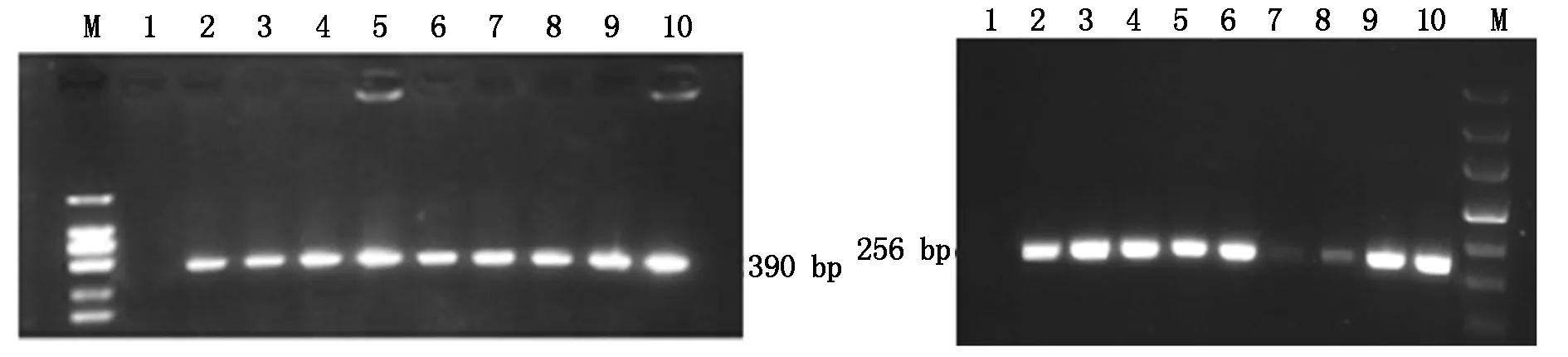
A.cry1ab/ac基因;B.bar基因;M.1 000 bp DNA Marker; 1.阴性对照;2-9.转基因植株;10.阳性对照。 A.cry1ab/ac gene;B.bar gene;M.1 000 bp DNA Marker;1.Negative control;2-9.Transgenic plant;10.Positive control.

1.阴性对照(非转基因油菜湘油15);2.阴性对照(蛋白提取液); 3-13.转基因油菜。 1. Negative control(Non-transgenic rape Xiangyou 15); 2.Negative control(Protein extract);3-13.Genetically modified rape.
2.4 转基因油菜离体抗虫性初步检测
将菜青虫接种在转基因油菜叶片上,以非转基因油菜湘油15叶片为对照。观察发现,菜青虫在湘油15叶片上继续啃食叶片,而在转基因油菜叶片上的菜青虫啃食几口叶片就不再啃食叶片,并且停止爬动。3 d后,湘油15叶片基本上被菜青虫啃食干净(图6-A),而转基因油菜叶片基本完整(图6-B)。此时,湘油15上的菜青虫活动性强,而在转基因油菜上的菜青虫则蛰伏在叶片背面,只在镊子触碰时才会稍微扭动身躯,且个头明显比湘油15叶片上的菜青虫要小。7 d左右,转基因叶片上的菜青虫用镊子触碰完全没有反应,已经死亡。该试验结果说明,转cry1ab/ac基因油菜对菜青虫具有高度抗性。

A.非转基因油菜湘油15;B.转基因油菜。 A. Non-transgenic rape Xiangyou 15;B. Genetically modified rape.
2.5 转基因油菜种子品质分析
使用FOSS公司DS2500F型近红外分析仪对8个转基因材料和对照湘油15种子进行了脂肪酸组成分析,使用索氏抽提法分析了转基因材料和对照的含油量。从表1可以看出,转基因油菜和对照湘油15在含油量、脂肪酸组成和硫苷含量上没有显著差异。

表1 转基因油菜菜籽品质分析Tab.1 Seed quality analysis in transgenic plants
注:脂肪酸含量=平均值±标准差,3次重复。脂肪酸含量中不同字母表示差异达到0.05显著水平。
Note:Values=mean±s(n=3).Different letters indicate significant difference at 0.05 level.
3 结论与讨论
耐除草剂转基因油菜目前在加拿大、澳大利亚、巴西、阿根廷等已被广泛种植,并取得了很好的经济效益。加拿大学者多年的跟踪研究也表明,种植耐除草剂转基因油菜可以减少除草剂和杀虫剂的使用量,同时也减少土地的翻耕次数,做到少耕甚至免耕,从而达到减少机械使用量,减少CO2排放和水土流失,达到环境保护的目的[15]。
Bt类微生物杀虫剂和转Bt基因作物商业化应用几十年后,农作物害虫对Bt生物杀虫剂或Bt毒蛋白抗性也已有大量报道,且这种抗性能够遗传给后代[16]。转基因作物大田抗性试验证明,经过12次繁殖后昆虫便对Bt毒蛋白产生了抗性,转单一Bt基因的作物在生产上一般只能用 8~10 年[17]。cry1ab/ac基因编码615个氨基酸的融合蛋白,前448个氨基酸与CRY1Ab的类似区域基本相同,剩余的449~615个氨基酸与CRY1Ac蛋白相应部分完全一致,没有任何变化[18]。另一个避免昆虫产生抗性的策略是“高剂量效应”。研究人员发现,昆虫在对杀虫蛋白产生抗性,主要是由于昆虫长期取食低剂量杀虫蛋白,在保证存活的状态下产生的[19]。“高剂量效应” 即通过提高抗虫农作物中的杀虫蛋白表达量,使昆虫取食后全部死亡,从而避免抗性昆虫的产生。本研究中,在融合基因上游加上拟南芥乙醇脱氢酶5′-UTR序列,该序列能够显著提高外源基因在植物体内的表达量。在安全性方面,Xu等[20]对Cry1Ab/Ac融合蛋白进行了安全性评估,其结论认为,Cry1Ab/Ac蛋白存在于人类食物或动物饲料中是无害的。目前,cry1ab/ac基因已被广泛应用于转基因水稻、棉花、玉米、大豆等作物[21-24]。
本研究中,成功将人工合成杀虫基因cry1ab/ac插入到含有抗除草剂基因bar的植物表达载体pFGC5941上,构建了同时具备杀虫基因cry1ab/ac和抗除草剂基因bar的重组质粒pFGC-Bt,并利用冻融法导入大肠杆菌中,摇菌扩繁后提取重组质粒转化农杆菌感受态细胞,并利用阳性的农杆菌侵染甘蓝型油菜外植体,将重组质粒导入甘蓝型油菜湘油15中,得到了转基因植株,初步的除草剂喷洒试验和饲虫试验表明,其对草铵膦和菜青虫具有很好的抗性,本研究为进一步培育抗除草剂、抗虫转基因油菜新品种创造了新种质。

