响应面法优化黑豆蛋白提取工艺及功能性测定
富天昕,王长远,冯玉超,李雪
(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
黑豆又称冬子豆、橹豆,外形似卵圆或球形,颜色为深绿或者黑色,我国东北地区出产最多[1]。黑豆素有“植物蛋白之王”的称号,它的蛋白质含量可达到36%~40%,远超鸡蛋和牛奶等食品[2]。黑豆蛋白必需氨基酸组成种类齐全且比例适合,是一种完全蛋白质[3],有助于人体吸收。黑豆也是一种特殊的功能性食品,有医食同疗的作用,具有一定的抗衰老的功效[4]。随着黑豆营养价值和药用价值不断被开发利用,人们对黑豆产品的需求也迅速增加,提高了黑豆的使用价值。黑豆蛋白的提取能够有效改善植物蛋白资源缺乏和来源单一的问题,提高了黑豆的利用价值。
碱溶酸沉法具有成本低、操作简便等特点[5],是目前提取黑豆蛋白最主要的方法。试验以黑豆蛋白提取率为指标,采用碱溶酸沉的方法,应用单因素试验和响应面设计法分析不同因素对黑豆蛋白提取率的影响,优化黑豆蛋白提取条件。研究采用碱溶酸沉法提取出的黑豆蛋白,对其溶解性、乳化性、乳化稳定性、起泡性、起泡稳定性、持水性及持油性进行测定,为高效提取黑豆蛋白及其加工与利用提供理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 原料试剂
黑豆:市售;浓硫酸、碳酸钠、福林酚试剂甲、硫酸铜、磷酸二氢钾、氢氧化钠、正己烷、盐酸、福林酚试剂乙、酒石酸钾钠、十二烷基硫酸钠、牛血清蛋白、氯化钠(均为分析纯):上海麦克林生化科技有限公司。
1.1.2 仪器设备
RH-600A型高速多功能粉碎机:浙江荣浩工贸有限公司;DGG-9150G鼓风干燥箱:上海森信实验仪器有限公司;RE-2000B型旋转蒸发仪:上海亚荣生化仪器厂;RSJ200-4型电子分析天平:沈阳龙腾电子有限公司;TD5A型台式低速离心机:长沙英泰仪器有限公司;JJ-1精密增力电动搅拌器:江苏省金坛市宏华仪器厂;79-1型磁力加热搅拌器:江苏省金坛市虹盛仪器厂;补充型号冷冻干燥机:上海歆睿生物科技有限公司。
1.2 试验方法
1.2.1 黑豆原料成分分析
水分的测定:GB5009.3-2016《食品安全国家标准食品中水分的测定》进行测定;脂肪的测定:GB5009.6-2016《食品安全国家标准食品中脂肪的测定》进行测定;蛋白的测定:GB5009.5-2016《食品安全国家标准食品中蛋白质的测定》标准方法进行;灰分测定:GB5009.4-2016《食品安全国家标准食品中灰分的测定》。
1.2.2 提取黑豆蛋白工艺流程
黑豆→清理→粉碎→过筛→脱脂→碱溶→水浴加热→离心取上清液(4 000 r/min,5 min)→酸沉→静放1 h→离心取沉淀(4 000 r/min,15 min)→将蛋白置于-80℃冷冻→冷冻干燥→黑豆蛋白。
1.2.3 黑豆蛋白提取率
提取率计算公式如下:

式中:M1为提取出黑豆蛋白的质,g;M2为原料脱脂黑豆粉的质量,g;C为固定脱脂黑豆中蛋白质的百分比,%。
1.2.4 提取黑豆蛋白单因素试验
以黑豆蛋白提取率为评价指标,探究不同pH值、液料比、提取温度、提取时间对黑豆蛋白提取率的影响。
1.2.5 提取黑豆蛋白响应面试验
在单因素研究的基础上,确定各因素的水平值范围,采用响应面中心组合试验设计,选取混合液pH值、液料比、提取温度、提取时间4个因素为自变量,以黑豆蛋白提取率为响应值,优化提取黑豆蛋白工艺的最佳参数。其因素水平编码表见表1。

表1 因素水平编码表Table 1 Encode table of factors and levels
1.2.6 提取黑豆蛋白功能性测定
1.2.6.1 溶解性测定
根据氮溶解指数(nitrogen soluble index,NSI)法加以改进,准确取黑豆蛋白粉0.5 g溶于20 mL样品缓冲液里,用1 mol/L氢氧化钠或1 moI/L盐酸溶液各调节pH 值至 2.0、4.0、6.0、7.0、8.0、10.0,经过 45 min 的磁力搅拌,接着在离心机中3 000 r/min进行30 min,测定上清液里的蛋白百分数采纳Foline phenol法,并制作NSI-pH曲线[6]。

1.2.6.2 乳化性和乳化稳定性测定
称取黑豆蛋白2.0 g放在带刻度的离心管里,添加100 mL水,用1 mol/L HCl或1 moI/L NaOH溶液分别调 pH 值至 3.0、5.0、7.0、9.0。磁力搅拌 1 h,在离心机中于4 000 r/min条件下进行20 min,添加25 mL大豆色拉油,液油比为4∶1(体积比),接着在9 500 r/min下高速搅拌2 min,马上在溶液底层抽取50 μL。将抽取的溶液浓度用备好的0.1%十二烷基硫酸钠溶液放大100倍,混合完马上于500 nm波长下测定吸光值A0,以SDS液作对照组。放置于室温下30 min,第二次取样测量吸光值A1。乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)[7]。

式中:T为2.303;ρ为黑豆蛋白样品质量浓度,g/mL;Φ为乳化液中油相的比例0.25;N为稀释倍数;t是时间,min;A0为初次测量乳化液的吸光值;A1为30 min后的吸光值。
1.2.6.3 起泡性和起泡稳定性测定
称取2.0 g黑豆蛋白放在带刻度离心管里,加入100 mL水,用1 mol/L氢氧化钠或1 moI/L盐酸溶液各调节pH值至3.0、5.0、7.0、9.0。磁力搅拌1 h后在离心机中以4 000 r/min离心20 min,然后以9 500 r/min高速搅拌2 min,测定搅拌截止时刻的起泡体积量V0,0.5小时后,第二次测定起泡体积量V1[8]。

1.2.6.4 持水性测定
称取0.5 g样品放与带刻度的离心管中,添加5 mL去离子水与其混合,室温环境下静置30 min,3 800 r/min旋转分离20 min,测定得到的前后水相体积相差量就是样品吸水量。持水性是指单位样品水的吸附量用(water holding capacity,WHC)表示[9]。

1.2.6.5 持油性测定
称量0.5 g样品放到带刻度的离心管里,再添加5 mL油脂,拌匀,常温下放0.5 h,3 800 r/min旋转分离20 min,测定得到的前后油相体积相差量就是样品吸油量。持油性(oil holding capacity,OHC)指单位样品油的吸附量[9]。

2 结果与分析
2.1 黑豆主要成分
黑豆主要成分见表2所示。

表2 黑豆主要成分Table 2 The main components of soybean %
2.2 单因素条件对黑豆蛋白提取率的影响
2.2.1 pH值对黑豆蛋白提取率的影响
温度为 50℃,液料比为 10∶1(mL/g),时间为 60min时,pH值对黑豆蛋白提取率的影响如图1所示。

图1 pH值对黑豆蛋白提取率的影响Fig.1 pH on the effect of protein extraction
黑豆蛋白提取率先随pH值的增大而增加,这是由于碱性条件能使蛋白分子结构变得疏松,碱液对蛋白有增溶的效果。当pH值为9时,提取率达到最大值,之后提取率呈下降势,可能是由于溶液碱性过大会导致蛋白质中的氢键发生断裂,使蛋白质变性[10]。
2.2.2 液料比对黑豆蛋白提取率的影响
液料比对黑豆蛋白提取率的影响如图2所示。

图2 液料比对黑豆蛋白提取率的影响Fig.2 Liquid-solid ratio on the effect of protein extraction
由图2可知,当温度为50℃,pH值为8,时间为60 min时,整体呈先上升后下降的趋势,当液料比为12∶1(mL/g)时,提取率达到最大值。液料比较低的条件下,蛋白的提取率也较低,其原因是溶液较少,体系分散不均,使得蛋白质无法充分溶解[11]。
2.2.3 温度对黑豆蛋白提取率的影响
当 pH 值为 8,时间为 60 min,液料比 10 ∶1(mL/g)时,温度对黑豆蛋白提取率的影响如图3所示。

图3 温度对黑豆蛋白提取率的影响Fig.3 Temperature on the effect of protein extraction
由图3可知,随着温度的升高,提取率呈先上升后下降的趋势,当温度为50℃时,提取率达到最大值为46.8%,之后提取率下降,原因在于温度过高会导致蛋白质的变性[12],从而影响蛋白质的提取。
2.2.4 时间对黑豆蛋白提取率的影响
时间对黑豆蛋白提取率的影响如图4所示。

图4 时间对黑豆蛋白提取率的影响Fig.4 Time on the effect of protein extraction
由图4可知,在温度为50℃,pH值为8,液料比10∶1(mL/g)的条件下,随着黑豆浸提时间延长,蛋白的溶出率越高,当浸提时间为50 min时,提取效果最好。当浸提时间超过50 min时,蛋白质提取率开始下降,说明浸提时间过长会破坏蛋白质的结构,从而使蛋白提取率下降。
2.3 响应面优化试验
2.3.1 响应试验安排及结果
试验应用响应面优化法进行过程优化。以X1pH值、X2液料比(mL/g)、X3提取温度(℃)、X4提取时间(min)为自变量,以分离蛋白提取率为响应值Y,响应面试验方案及结果见表3。
2.3.2 对黑豆蛋白提取率的响应面结果分析
通过统计分析软件Design Expert进行数据分析,建立二次响应面回归模型如下:Y=50.29+0.38X1+0.038 0X2+0.55X3+0.81X4-0.25X1X2+0.048X1X3+0.036X1X4+0.39X2X3+0.50X2X4-0.077X3X4-1.85X12-1.57X22-2.14X32-1.62X42。回归分析与方差分析结果见表4。

表3 响应面试验方案及试验结果Table 3 Design and result of response surface analysis

表4 回归与方差分析结果Table 4 Results of regression and variance analysis

续表4 回归与方差分析结果Continue table 4 Results of regression and variance analysis
由表4可知,方程因变量与自变量之间的线性关系明显,该模型回归极显著(P<0.000 1),失拟项不显著,并且该模型R2=97.28%,R2Adj=94.74%,说明该模型与试验拟合良好。自变量与响应值之间线性关系显著,可以用于该反应的理论推测。应用响应面寻优分析方法对回归模型进行分析,当pH值为9,液料比为12∶1(mL/g),温度 51℃,时间 53 min时,响应面最优值为(50.45±0.32)%。响应面图见5~图8。
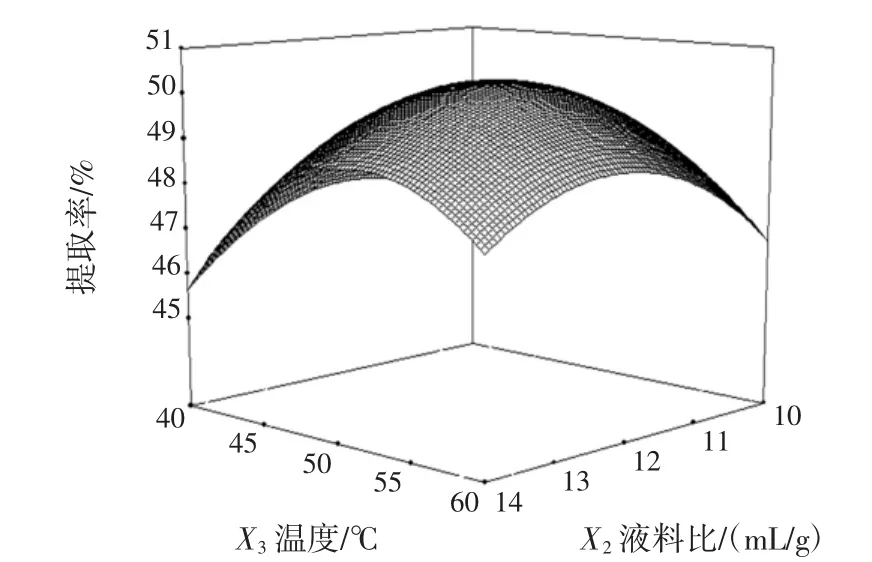
图5 液料比和温度对黑豆蛋白提取率影响的响应面图Fig.5 Response surface plot of combined effects of liquid-soild ratio and temperature on black bean protein extraction
从图5、图6、图7、图8可以看出提取温度、提取时间对提取效率影响显著。在因素水平范围,开始时提取率随液料比的增大逐渐增大,达到最大理论之后缓慢减小。
2.3.3 验证试验
根据响应面得到的最优值,即pH值为9,液料比为 12∶1(mL/g),温度 52℃,时间 53 min的条件下,试验进行了3次平行试验,结果3次试验平均值即黑豆蛋白平均提取率为50.21%,与响应面分析得到的黑豆蛋白提取的理想值(50.45±0.32)%很接近,说明试验效果较好。

图6 液料比和温度对黑豆蛋白提取率影响的等高线图Fig.6 Contour plot of combined effects of liquid-soild ratio and temperature on black bean protein extraction
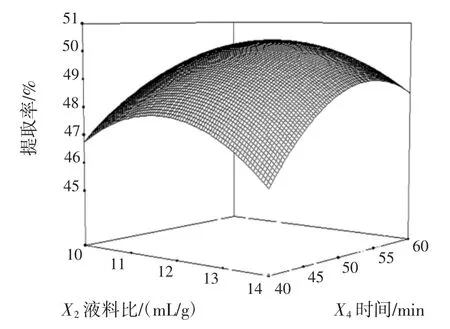
图7 液料比和时间对黑豆蛋白提取率影响的响应面图Fig.7 Response surface plot of combined effects of liquid-soild ratio and time on black bean protein extraction

图8 液料比和温度对黑豆蛋白提取率影响的等高线图Fig.8 Contour plot of combined effects of liquid-soild ratio and temperature on black bean protein extraction
2.4 黑豆蛋白功能性质的测定
2.4.1 溶解性
黑豆蛋白溶解性的测定结果见图9。

图9 黑豆蛋白溶解性的测定Fig.9 Determination of black bean protein solubility
在强酸环境下,蛋白分子多数是作为正极粒子,产生相斥作用,分散性良好,会使溶解性增加;在碱性环境下,蛋白质结构变得比较疏松,表面蛋白质分子带一样电荷,促进蛋白质与结合物分离,使黑豆蛋白质的溶解性提高[13]。因黑豆蛋白等电点pH值在4.5左右,在这个pH值环境下,阻碍了蛋白质多肽链之间静电彼此排斥作用,进而打乱了蛋白质空间结构,使其溶解性降低。
2.4.2 乳化性和乳化稳定性
黑豆蛋白乳化性,乳化稳定性的测定结果见图10。

图10 黑豆蛋白乳化性及乳化稳定性的测定Fig.10 Determination of emulsifying and emulsifying stability of black bean protein
黑豆蛋白乳化性随着pH值的增大而增大。乳化性的持续增涨可能是由于蛋白质内部的疏水基团随着pH值的增大而暴露的更充分,增加了油水界面的吸附量,使界面张力减小,从而提高了乳化性[14]。乳化稳定性则是随着pH值的升高而升高,当pH值为7时达到最高点,随后减小。原因是在pH值小于7时,还没有形成饱满的界面使油滴稳定,故在这个过程中吸附了大量微小的蛋白质颗粒,增加了乳化稳定性[15]。
2.4.3 起泡性和起泡稳定性
黑豆蛋白起泡性、起泡稳定性的测定结果见图11。
蛋白质当pH值是5时,起泡性处于最大,但随pH值的变大,起泡性反而呈下降趋势。起泡稳定性是当pH值处于7时曲线到达最顶点,于酸性范畴pH值的变大,起泡稳定性也相对的升高。但碱性范畴下跟随pH值的变大,起泡稳定性稍微下降。有相关研究表示,没有溶解的蛋白质粒子可以提升起泡稳定性[16]。其次较大分子量的蛋白具有稳定的膜结构,也可提升起泡稳定性[17]。

图11 黑豆蛋白起泡性及起泡稳定性的测定Fig.11 Determination of foamability and foam stability of black bean protein
2.4.4 持水性
蛋白质的持水性是指在食品加工过程中蛋白质中的水分以及添加到蛋白质中水分的保持能力,与食品的质构有密切关系[18]。按照上述2.3.4.4的步骤进行试验,并测得黑豆蛋白质的持水性为WHC(mL/g)=2.10。
2.4.5 持油性
蛋白质的持油性表示蛋白制品吸附油的性能[19]。按照上述2.3.4.5的步骤开展试验,并测得黑豆蛋白质的持油性为 OHC(mL/g)=3.15。
3 结论
试验利用响应面分析方法优化了黑豆蛋白的提取工艺,得到最优提取工艺参数:液料比为 12∶1(mL/g)、pH值为9、提取温度为51℃、浸提时间为53 min。此时黑豆蛋白提取率可达50.45%。试验对提取的黑豆蛋白功能特性进行了测定,结果表明黑豆蛋白的溶解性最高为57.33%;乳化性最大为17.22 m2/g;乳化稳定性最佳为120.17 min;起泡性最好为39.66%;起泡稳定性最优为65.33%;持水性为2.10 mL/g;持油性为3.15 mL/g。说明采用碱溶酸沉法提取的黑豆蛋白具有良好的功能特性,可用于日后进一步的食品加工。此试验为黑豆蛋白在食品工业中的应用提供了一定的借鉴意义。