镉胁迫对盐芥根木栓质代谢的影响
陈宁美,欧阳舒毓,徐维烈,唐 帅,韦善君,冯金朝,徐小静*
(1.中央民族大学 生命与环境科学学院,北京 100081;2.武汉合缘绿色生物股份有限公司,湖北 武汉 430070)
镉(cadmium,Cd)是一种非生物必需的重金属元素,也是重要的环境污染物之一,会对植物产生毒害,并在食物链中富集[1]。受到镉胁迫时,植株生长发育和生理代谢均会受到影响[2-6]。土壤中的镉接触根部后通过共质体和质外体2个途径穿过皮层进入木质部。为抵御镉的毒害,植物会产生一系列生理生化机制限制其吸收和转运,如位于内皮层的凯氏带阻隔镉进入木质部[7-8]。木栓质是构成凯氏带的主要组成之一,分布于内皮层细胞的细胞壁和细胞膜之间,具有较强的离子屏障作用[9]。木栓质组成成分包括未被取代脂肪酸、ω-羟基脂肪酸、α,ω-二羧酸、脂肪醇、甘油、酚类等物质,是一种植物次生代谢产物,属于脂类-酚类多聚物,沉积于植物特定边界组织细胞壁上,如根内皮层、根及块茎周皮、种子皮[10]。
木栓质代谢包括木栓质合成、转运、组装和调控4个方面[10]。参与木栓质单体合成的酶包括细胞色素P450单加氧酶(CYP)[11]、β-酮酯酰-CoA合成酶 (KCS)[12]、脂肪酰还原酶(FAR)[13]、甘油-3-磷酸酰基转移酶(GPAT)[14]、阿魏酰转移酶 (ASFT/AtHHT)[15]。ABC转运蛋白如ABCG1,ABCG2,ABCG5,ABCG6、ABCG20[16-18]参与木栓质形成。在木栓质形成中,转录因子起重要的调节作用,如AtMYB9、AtMYB107转录调控脂肪族和芳香单体的生物合成、运输、木栓质聚合[18]。
盐芥(Thellungiellasalsuginea)属于十字花科植物,是研究植物耐盐分子机制的模式植物[19]。研究发现,盐芥除了能够耐受高盐环境外,也能够耐受低温[20]、干旱[21]及一定浓度的重金属铅[22]等逆境环境。贾文娟[23]研究发现,镉胁迫下,盐芥地上部分和根中大量积累脯氨酸,保护细胞膜和酶的结构,同时叶片中的抗坏血酸、谷胱甘肽、过氧化物酶含量显著增加,以缓解镉胁迫对盐芥的伤害。2012年,通过第二代测序技术获得了盐芥全基因组序列信息,为盐芥抗逆分子机制的揭示提供了极大便利[24]。本研究以盐芥为材料,对不同浓度镉胁迫下根木栓质组成、含量及相关基因表达模式变化进行分析,以探究盐芥根木栓质对重金属镉胁迫的响应,为培育镉耐受植物提供理论依据。
1 材料和方法
1.1 试验设计
试验所用种子为山东型盐芥种子,为中央民族大学植物分子生物学实验室保存。盐芥种子先4 ℃春化处理7 d,然后均匀播种在蛭石与营养土等比混合的花盆里。光照/黑暗处理时间为12 h/12 h,光照强度6 000 lx,温度22 ℃,空气湿度30%~60%。2周后移栽,在上述培养条件下继续培养。盐芥生长6周后,将长势良好、大小均一的植株平均分成3组,1组为正常生长的对照组(CK),其他2组分别用50 μmol/L、100 μmol/L CdAc2溶液处理。将镉胁迫处理24 h的盐芥根用于基因表达分析,每5株为1个平行,每组选3个平行。将镉胁迫处理1周的盐芥根用于木栓质测定,每5株为1个平行,每组选5个平行。
1.2 盐芥根木栓质组分及含量测定
盐芥根木栓质的提取包括脱脂、解聚、衍生化等过程。盐芥根的脱脂参照Li-Beisson等[25]的方法进行:在盛有干燥后的脱脂样品试管中加入25 μL C17: 0 ME标准品(1 mg/mL)作为内标(用以后续定量计算);然后依次加入0.9 mL乙酸甲酯、1.5 mL甲醇钠、3.6 mL甲醇;将试管60 ℃金属浴2 h;冷却后,分别加入10 mL二氯甲烷、10 mL冰醋酸,将混合液pH值调整为4~5;再加入6 mL 0.5 mol/L的NaCl溶液,充分振荡;摇匀后2 000 r/min离心5 min;将有机相取出转移至新试管中;向新试管中加入0.5 mol/L NaCl溶液,充分振荡洗涤,摇匀后2 000 r/min离心10 min(该洗涤步骤重复2次);将上层液体弃掉,加入6 g无水硫酸钠后充分振荡(将有机相中残余水分吸收),2 000 r/min离心5 min;将液体转移至反应瓶内,用氮气吹干,分别加入100 μL吡啶、100 μL乙酸酐,60 ℃金属浴2 h;冷却后,用氮气吹干液体,用甲苯-庚烷(体积比为1∶1)混合液重新溶解反应产物,转移至上样瓶用于GC(Gas Chromatography)检测。
GC气相色谱仪设置的程序条件为:进样量为1 μL;分流比设置为1∶10;进样口和检测器温度均设定为320 ℃;柱箱初始温度为80 ℃,先以15 ℃/min升温至200 ℃,再以1.5 ℃/min升温至230 ℃,接着以5 ℃/min升温至300 ℃。气相色谱柱使用的是30 m×0.25 mm HP-5MS毛细管柱,氮气作为载气。
1.3 盐芥根总RNA提取及mRNA逆转录
盐芥根总RNA提取、cDNA制备分别使用北京全式金生物技术有限公司生产的EasyPure®Plant RNA Kit、TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒。具体操作详见试剂盒说明书。
1.4 实时荧光定量PCR
在NCBI网站(https://www.ncbi.nlm.nih.gov/)中搜索已报道的拟南芥木栓质代谢相关基因cDNA,并利用获得的基因序列搜索盐芥木栓质代谢相关基因的cDNA或ESTs。运用Primer 3对所得的cDNA或ESTs序列设计引物。管家基因UBQ5作为内参基因,其上、下游引物分别为TsAtUBQ5 P1(CAACCCTAACGGGGAAGAC)、TsAtUBQ5 P2 (CCCGTCTTCTTCTTCCTCTTC)。荧光定量PCR反应程序为:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火30 s,循环40次。实时荧光定量PCR反应体系包括2×TransStart®Top Green qPCR SuperMix 5 μL、cDNA 1 μL、上下游引物各 0.2 μL、ddH2O 3.6 μL,总体积为10 μL。试验使用Bio-Rad MyIQ2型荧光定量PCR仪,采用2-△△CT法分析基因的相对表达量。对照组的基因表达量设定为1,处理组中的基因表达量用2-△△CT表示[26],计算不同镉浓度处理下基因的相对表达量。
1.5 数据处理
利用Excel 录入数据,并进行统计分析,利用Origin和Excel进行制图,采用t检验进行差异显著性分析。
2 结果与分析
2.1 镉胁迫对盐芥根木栓质组分及含量的影响
共检测出4种类型的木栓质,即未被取代脂肪酸、脂肪醇、ω-羟基脂肪酸、α,ω-二羧酸,共包括21种木栓质单体,即C16∶0未被取代脂肪酸、C18∶0未被取代脂肪酸、C18∶2未被取代脂肪酸、C18∶3未被取代脂肪酸、C20∶0未被取代脂肪酸、C22∶0未被取代脂肪酸、C24∶0未被取代脂肪酸、C18∶0脂肪醇、C20∶0脂肪醇、C22∶0脂肪醇、16-OH C16∶0 ω-羟基脂肪酸、18-OH C18∶0 ω-羟基脂肪酸、18-OH C18∶1 ω-羟基脂肪酸、18-OH C18∶2 ω-羟基脂肪酸、20-OH C20∶0 ω-羟基脂肪酸、22-OH C22∶0 ω-羟基脂肪酸、24-OH C24∶0 ω-羟基脂肪酸、C18∶0 α,ω-二羧酸、C18∶1 α,ω-二羧酸、C20∶0 α,ω-二羧酸、C22∶0 α,ω-二羧酸。不同浓度镉胁迫下盐芥根木栓质单体含量见图1。C18∶2未被取代脂肪酸、C18∶3未被取代脂肪酸、C22∶0未被取代脂肪酸、16-OH C16∶0 ω-羟基脂肪酸、18-OH C18∶1 ω-羟基脂肪酸、C18∶1 α,ω-二羧酸为盐芥根木栓质的优势组分。进行不同浓度镉胁迫处理之后,优势组分并未发生变化。50 μmol/L镉胁迫时,除了C16∶0未被取代脂肪酸、C18∶2未被取代脂肪酸、C18∶3未被取代脂肪酸、C24∶0未被取代脂肪酸、18-OH C18∶1 ω-羟基脂肪酸、C22∶0 α,ω-二羧酸的含量未发生显著变化外,其他组分与CK相比均显著或极显著增加。其中,极显著增加的木栓质单体中,16-OH C16∶0 ω-羟基脂肪酸、C18∶1 α,ω-二羧酸、C22∶0未被取代脂肪酸分别较CK增加了28.77%、28.45%、26.69%。100 μmol/L镉胁迫时,C18∶0未被取代脂肪酸极显著增加,较CK增加了70.46%,C18∶0脂肪醇含量显著增加,较CK增加了37.91%,C22∶0 α,ω-二羧酸含量显著降低,较CK降低了30.07%,其他组分含量变化不显著。
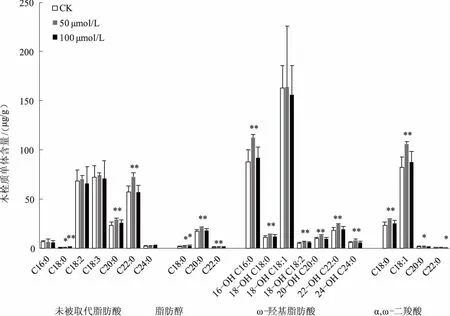
*、**分别表示0.05、0.01水平差异显著、极显著,下同
4种类型的木栓质含量从高到低依次为ω-羟基脂肪酸、未被取代脂肪酸、α,ω-二羧酸、脂肪醇(图2)。50 μmol/L镉胁迫下,盐芥根木栓质总量显著增加,较CK增加了15.32%;脂肪醇、α,ω-二羧酸含量极显著增加,分别较CK增加了23.52%、27.82%;未被取代脂肪酸、ω-羟基脂肪酸的含量变化不明显。在100 μmol/L镉胁迫下,盐芥根木栓质总量略有上升(0.95%),未被取代脂肪酸、脂肪醇、ω-羟基脂肪酸、α,ω-二羧酸的含量与CK相比,差异均不显著。
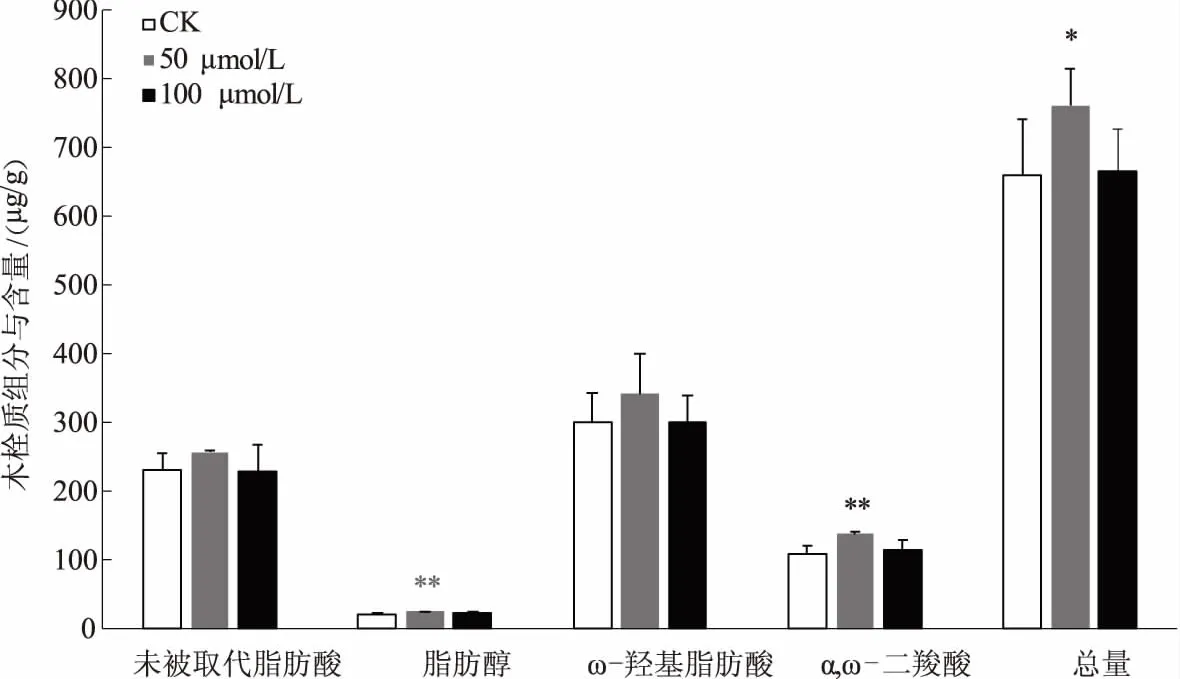
图2 不同浓度镉胁迫下盐芥根木栓质单体类型及其含量
2.2 镉胁迫对盐芥根木栓质代谢相关基因表达的影响
利用同源比对在NCBI网站中选择了16个与根木栓质相关的基因(CYP77A6、CYP86B1、CYP86A4、CYP86A7、FAR4、FAR5、KCR2、KCR20、ABCG2、ABCG6、ABCG20、GPAT5、GPAT6、FACT、ASFT、MYB107)进行表达模式分析。不同浓度镉胁迫下盐芥根中木栓质代谢相关基因的表达结果见图3。50 μmol/L镉胁迫下,16个木栓质代谢相关基因中有15个基因出现显著或极显著上调表达。其中,显著上调表达的基因有:CYP86B1、CYP86A7、FAR4、FAR5、KCR2、ABCG2、GPAT6、FACT、MYB107;极显著上调表达的基因有:CYP86A4、KCR20、ABCG6、ABCG20、GPAT5、ASFT。100 μmol/L镉胁迫下,8个木栓质代谢相关基因出现显著或极显著上调表达,显著上调表达的基因有:CYP77A6、CYP86A7、FACT;极显著上调表达的基因有:CYP86A4、ABCG2、GPAT5、ASFT、MYB107。总体上,50 μmol/L镉胁迫下基因表达上调的幅度超过100 μmol/L镉胁迫下基因表达上调的幅度,有10个基因的相对表达量在50 μmol/L镉胁迫下高于在100 μmol/L镉胁迫下。相对表达量超过CK 5倍的基因在50 μmol/L镉胁迫下共有6个,而在100 μmol/L镉胁迫下只有3个。
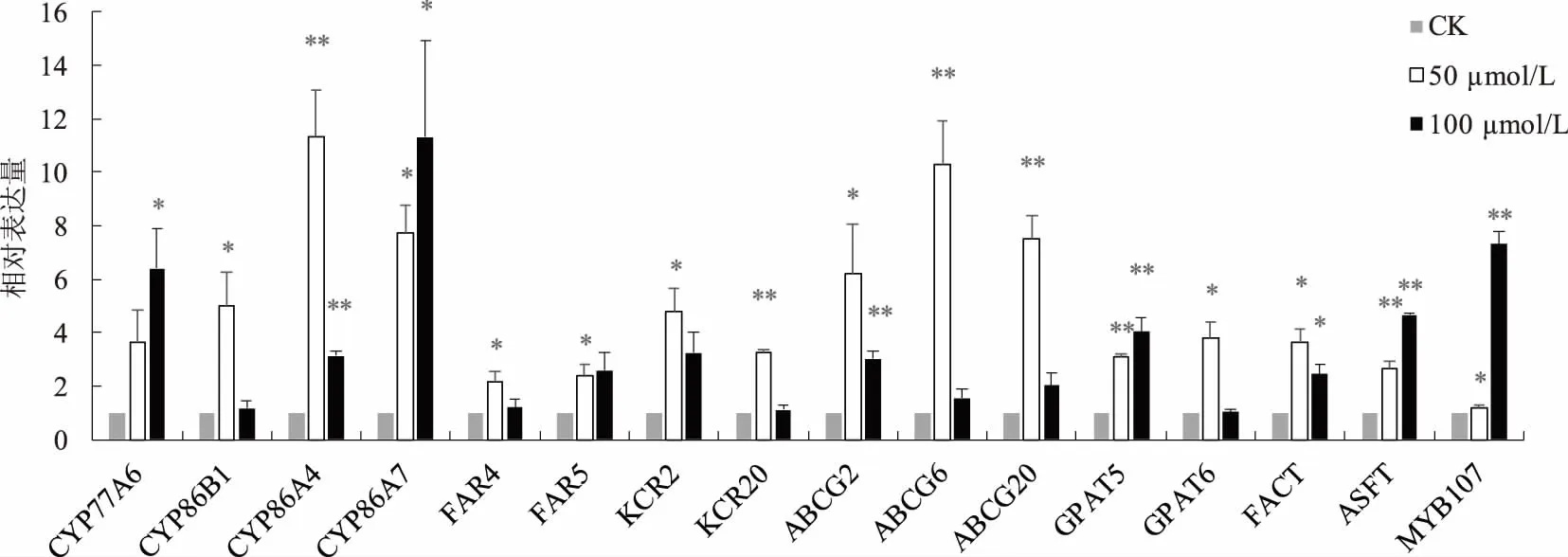
图3 不同浓度镉胁迫下盐芥根木栓质代谢相关基因表达
3 结论与讨论
本研究结果表明,镉胁迫下16个木栓质代谢相关基因均上调表达。CYP77A6、CYP86B1、CYP86A4、CYP86A7均属于细胞色素P450家族,能催化脂肪酸ω-羟基化而形成木栓质单体[31],在50 μmol/L镉胁迫下,其中3个基因出现显著或极显著上调表达,与6个ω-羟基脂肪酸单体含量极显著增加相对应。脂肪酸延长酶催化形成不同碳原子数的脂肪酸,本研究选择的KCR2、KCR20为脂肪酸延长酶(FAE)复合体的异源四聚体之一[25],在50 μmol/L镉胁迫下,出现显著或极显著上调表达,可促使盐芥形成不同碳原子数的脂肪酸。木栓质前体在内质网中合成,进入细胞质后穿过质膜,组装形成木栓质。木栓质前体的运输需要借助转运蛋白。研究发现,拟南芥abcg2、abcg6、abcg20 3个突变体的根和种子中木栓质总含量减少,外表面形成扭曲的片层结构,渗透性增加,说明ABCG2、ABCG6和ABCG20在拟南芥木栓质形成中起至关重要的作用[16]。本研究在50 μmol/L镉胁迫下,ABCG2、ABCG6和ABCG20有较高的相对表达量,从侧面印证3个基因对木栓质形成的贡献。Lashbrooke等[17]研究发现MYB107调控十字花科植物木栓质的沉积。本研究中,2个浓度镉处理下MYB107均上调表达,因此,MYB107可能在调控盐芥根木栓质的形成中起重要作用。GPAT5参与拟南芥木栓质中脂肪酸的积累,特别是ω-羟基化的C22∶0、C24∶0脂肪酸及二羧酸单体[14]。本研究中,GPAT5在2个浓度镉胁迫下均极显著上调表达,与木栓质中部分脂肪酸单体含量的增加相一致。
本研究共检测出21种木栓质单体,在低浓度和高浓度镉胁迫下,根木栓质单体含量变化趋势和相关基因的表达存在差异。在50 μmol/L镉胁迫下,木栓质总含量升高,而100 μmol/L镉胁迫下,木栓质总含量未发生明显变化。对木栓质代谢相关的16个基因进行表达模式分析,发现其在2个浓度镉胁迫下均上调表达。其中,50 μmol/L镉胁迫下有15个基因显著或极显著上调表达,100 μmol/L镉胁迫下有8个基因显著或极显著上调表达,表明低浓度镉胁迫能诱导盐芥根产生更多的木栓质单体,因此可能形成更为致密的木栓质结构,从而阻止镉离子进入体内,而高浓度的镉则表现出对盐芥产生毒害的趋势。

