牛蒡根际土壤解磷菌的筛选、鉴定及生长特性
王样庭,陈 玲,王 陶,李 文*,李同祥,刘 洵
(1.徐州工程学院/江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州 221018; 2.徐州万荷奶牛专业合作社,江苏 徐州 221113)
磷作为一种植物必需的大量元素,对植物的生长、代谢、发育起到至关重要的作用[1-2]。然而,土壤中的磷只有0.1%可被植物所用,大部分磷是以无效磷的形式存在[3]。长期以来,人们通过施用磷肥来解决这一问题,然而,磷会和土壤中的金属离子如Al3+、Fe3+、 Ca2+等结合,转化成无效形式,并造成土壤肥力及生物多样性下降等问题[4]。因此,提高磷的有效性是当务之急[5]。土壤中存在一类解磷微生物,可以将无效磷转变成植物能吸收的状态,从而促进植物的生长[6]。解磷微生物可以分为解磷细菌、真菌和放线菌,其中,解磷细菌按其种属可分为肠细菌属(Enterbacter)、土壤杆菌属(Agrobacterium)、欧文氏菌属(Er-winia)、假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratia)、黄杆菌属(Flavobacterium)、芽孢杆菌属(Bacillus)、微球菌属(Micrococcus)、固氮菌属(Azotobacter)、色杆菌属(Chromabacterium)、沙门氏菌属(Salmonella)、产碱菌属(Alcaligenes)、节细菌属(Arthrobacter)、硫杆菌属(Thiobacillus)、埃希氏菌属(Escherichia);解磷真菌方面的相关研究报道不多,大多为曲霉属(Aspergillus)、根霉属(Rhizopus)、镰刀菌属(Fusarium)、青霉属(Penicillium)、小菌核菌属(Sclerotium)、AM菌根菌(Arbuscularmycorrhiza)等;解磷放线菌的研究主要侧重于链霉菌属(Streptomyces)[7-9]。解磷微生物作为传统磷肥的一个良好的替代品,除了可以释放磷元素供植物生长所需,还可以维持土壤生态系统的长期平衡[10],从而缓解施用磷肥带来的环境问题。因此,筛选高效解磷微生物以研制具有高解磷能力的生物肥料迫在眉睫。通常,分离自不同土壤的解磷菌在生长和解磷性能上呈现出较大的差异。因此,对于不同解磷菌的分离鉴定及生长特性的研究具有重要意义,能够丰富野生解磷菌资源,并为解磷菌的应用提供一定的基础。
牛蒡 (ArctiumlappaL.),俗称东洋参,是菊科牛蒡属草本植物,具有抗氧化、抗炎、抗肿瘤、降血糖、降血脂等多种药理活性[11],江苏省徐州市的沛县、丰县是中国主要的种植地区。对牛蒡根际促生细菌如解磷菌进行研究有助于提高牛蒡的产量,更好地发挥其功效。目前,关于土壤解磷细菌的筛选、鉴定研究较多,多筛选于小麦、大豆、棉花、花生、烟草、油茶、茶树等的根际土壤,并具有较好的解磷特性[12-24],而对牛蒡根际解磷菌的研究鲜有报道。为此,从牛蒡根际土壤中筛选具有优良解磷性能的菌株,并对其进行鉴定,研究其生长特性,以期为开发牛蒡专用菌肥提供一定的理论参考和技术支持。
1 材料和方法
1.1 试验材料
1.1.1 土壤 土样为徐州市丰县牛蒡根际土壤。
1.1.2 培养基 无机磷液体培养基:葡萄糖10.0 g、Ca3(PO4)2 25.0 g、(NH4)2SO40.5 g、NaCl 0.2 g、KCl 0.2 g、MgSO4·7H2O 0.1 g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、酵母粉0.5 g,加蒸馏水至1 000 mL,pH 值6.8~7.2,121 ℃灭菌20 min。
筛选培养基:无机磷液体培养基中加入琼脂粉,使其终质量浓度为18 g/L。
LB液体培养基:蛋白胨5.0 g、NaCl 5.0 g、牛肉浸膏2.50 g,加蒸馏水至500 mL,pH值 7.0左右,121 ℃灭菌20 min。
LB固体培养基:在LB液体培养基中加入琼脂粉,使其终质量浓度为18 g/L。
1.1.3 仪器设备 HYG 旋式恒温调速摇瓶柜(上海欣蕊自动化设备有限公司),HH.B11.600-S-Ⅱ型电热恒温培养箱(上海跃进医疗器械厂),DL-5 低速大容量离心机(上海安亭科学仪器厂),TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司),PCR 扩增仪(BioRad,USA),电泳仪、电泳槽(DYY-2C型)(北京市六一仪器厂),凝胶成像分析系统CDS8000(上海培清科技有限公司)。
1.2 试验方法
1.2.1 解磷菌的筛选
1.2.1.1 初筛 称取5 g土样放入盛有 45 mL灭菌生理盐水的锥形瓶中,置摇床上100 r/min振荡15 min,静置,采用梯度稀释法将上清液分别稀释至10-3、10-4、10-5三个稀释度,取0.1 mL稀释液涂布至筛选平板,倒置于30 ℃培养箱中培养2~4 d,观察透明圈产生情况。解磷圈直径(H)、菌落生长直径(C)的比值(H/C)越大,表示解磷菌解磷能力越强,以此初步测定菌株降解无机磷的能力[25]。
1.2.1.2 复筛 测解磷圈大小只是定性检测菌株的解磷特性,解磷菌解磷能力的衡量还需结合定量法,通过测定上清液中磷的质量浓度来确定菌株解磷能力的强弱。将初筛菌株接种于 LB液体培养基中,于30 ℃、150 r/min恒温振荡器中培养24 h,得种子液。再将种子液以1%接种量接入无机磷液体培养基中,以不接菌的培养基为对照,于30 ℃、150 r/min恒温振荡器中培养0~5 d。8 000 r/min 离心 15 min,采用磷钼蓝比色法测定上清中的磷含量[26]。
1.2.2 解磷菌的鉴定
1.2.2.1 形态特征鉴定 将菌株划线接种于LB平板,于30 ℃恒温培养箱中培养1~2 d,观察单菌落的形态特征,另取新鲜培养物进行革兰氏染色,观察其显微形态。
1.2.2.2 生理生化特性鉴定 生理生化试验参照文献[27-28]的方法进行。
1.2.2.3 分子生物学鉴定 按照文献[29]的方法提取解磷菌基因组DNA,采用细菌16S rDNA通用引物[30]进行PCR扩增。上游引物27F序列为5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物1492R序列为5′-GGCTACCTTGTTACGACT-3′。反应体系为DNA 1 μL、10×EasyTaqbuffer 2.5 μL、上游引物和下游引物各0.5 μL、EasyTaqDNA Polymerase 0.25 μL、高纯dNTP 2 μL,加双蒸水至总体积为25 μL。扩增的反应条件为:94 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min,循环30 次;72 ℃ 10 min。
PCR扩增产物用琼脂糖凝胶电泳检测后,送至生工(上海)生物工程股份有限公司测序,所得序列提交至GenBank数据库,利用BLAST (http://blast.ncbi.nlm.nih.gov)与已有细菌的16S rDNA序列比对;同时,将序列提交到EzBioCloud数据库,进行同源性搜索,找出与所得基因序列同源性最高的已知菌种,同时,提取部分与所测菌株的16S rDNA序列同源性较高的已知菌株的16S rDNA序列,利用ClustalX 1.83软件进行序列多重比对,利用MEGA 6.0软件采用Neighbor-joining法构建系统发育树(自展值为1 000),鉴定解磷菌与已知菌株的同源性。
1.2.3 解磷菌的生长特性
1.2.3.1 解磷菌生长曲线 将解磷菌接入盛有120 mL基础培养基的250 mL锥形瓶中,并设无菌对照,置摇床中30 ℃、150 r/min培养,每隔2 h取样测定OD600值。以时间为横坐标、OD600为纵坐标,绘制解磷菌的生长曲线。
1.2.3.2 温度对解磷菌生长的影响 将种子液以1%的接种量接入LB液体培养基中,分别置于18、20、26、28、30、32、34、37、40、42 ℃下,于摇床中150 r/min培养48 h,以不接菌的培养基为对照,测定菌悬液的OD600值。
1.2.3.3 pH值对解磷菌生长的影响 将种子液以1%的接种量接入pH值分别为4.5、5、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的LB液体培养基中,于摇床中150 r/min培养48 h,以不接菌的培养基为对照,测定菌悬液的OD600值。
1.2.3.4 NaCl质量浓度对解磷菌生长的影响 将种子液以1%的接种量接入NaCl质量浓度分别为0、5、10、20、30、40、50、60、70 g/L的LB液体培养基中,于摇床中150 r/min培养48 h,以不接菌的培养基为对照,测定菌悬液的OD600值。
2 结果与分析
2.1 牛蒡根际土壤中解磷菌的筛选
2.1.1 初筛 将不同稀释度的土壤菌悬液涂布在筛选培养基上进行初步筛选,共获得产解磷圈明显、H/C值介于1.1~1.5的菌株48株,其中,JL-1长势良好,所产解磷圈最明显,经测量,其H/C值为1.5(图1)。
图1 初筛所得菌株产生的解磷圈
2.1.2 复筛 将初筛所得48株菌进行液体发酵,经测定发现,发酵液上清中的磷含量介于26.84~49.56 μg/mL。其中,JL-1的解磷量最高,为49.56 μg/mL,进一步测定其动态解磷过程,结果如图2所示。由图2可知,菌株JL-1具有较强的解磷能力,且解磷速度较快,2 d后解磷量达到峰值,为50.4 μg/mL,之后略有下降,这可能是由于在发酵初期培养基养分充足,菌体呈指数增长,能快速分解磷酸钙;而后随着营养的耗尽,微生物活性下降,其中的可溶性磷有可能和发酵液中的金属离子等结合,成为不溶态,导致解磷总量下降[31]。
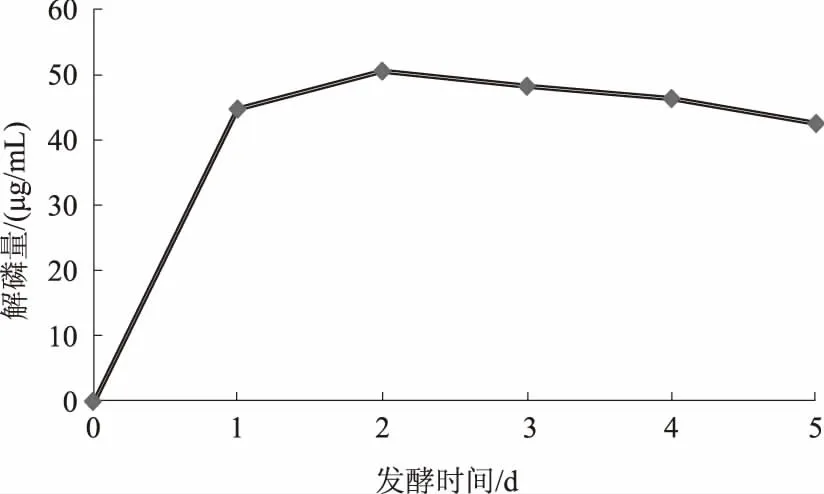
图2 菌株JL-1的解磷进程
2.2 牛蒡根际土壤中解磷菌株JL-1的鉴定
2.2.1 形态特征鉴定 菌株JL-1的菌落形态特征为:淡黄色,略微凸起,边缘不整齐,菌落较为湿润;革兰氏染色呈阴性,菌体呈杆状(图3)。

图3 菌株JL-1的单菌落形态(左)及细胞形态(右)
2.2.2 生理生化特性鉴定 由表1可知,菌株JL-1的葡萄糖产酸、淀粉水解、甲基红、接触酶、明胶液化、柠檬酸盐利用试验均呈阳性,VP、氧化酶、吲哚、H2S产生、脲酶、硝酸盐还原试验均呈阴性。

表1 菌株JL-1的生理生化特性
注:+表示阳性,-表示阴性。
2.2.3 分子生物学鉴定 以菌株JL-1基因组DNA为模板,PCR扩增JL-1的16S rDNA序列,经电泳可见,在1 200~1 500 bp处出现清晰条带(图4)。
经测序,该序列全长为1 337 bp(图5)。

图4 16s rDNA PCR扩增产物

图5 JL-1菌株的16S rDNA序列
将测序得到的序列利用BLAST进行比对,同时,将此序列提交到EzBioCloud数据库,进行序列同源性比对,结果显示,该菌株与不动杆菌属(Acinetobacter)的菌株呈高度同源性,表明此菌株属于不动杆菌属,与此菌株同源性最高的为Acinetobacterindicus,相似性为100% ,选取同源性较高的菌株的16S rDNA序列构建系统发育树(图6),结果发现,JL-1与AcinetobacterindicusCIP 110367 K1530754聚在一起,自展值为100,表现出较近的亲缘关系。结合之前的形态特征、生理生化特性以及16S rDNA比对结果,最终确定该菌株为Acinetobacterindicus。将此菌株的16S rDNA序列提交至NCBI 的GenBank数据库,获得登录号为MF497336。

图6 基于16S rDNA序列构建的系统发育树
2.3 牛蒡根际土壤中解磷菌株JL-1的生长特性
2.3.1 解磷菌株JL-1的生长曲线 菌株JL-1的生长曲线如图7所示,菌株生长迅速,延滞期很短,2 h后即进入对数期,12 h后进入稳定期,22 h后进入衰亡期,当菌体处于对数中后期时,细胞生长迅速,代谢旺盛,此时期的菌体适于作为种子液以利于后续的扩培。

图7 菌株JL-1的生长曲线
2.3.2 温度对解磷菌株JL-1生长的影响 菌株JL-1在不同温度下的生长情况见图8,可以看出,菌株可生长的温度范围较宽,在20~40 ℃条件下皆可生长,且随着温度的升高,菌体量呈现先增加后下降的趋势。其中,在 26~37 ℃条件下,菌体量较高,说明此温度范围有利于菌株的生长;菌株的最适生长温度为30 ℃。
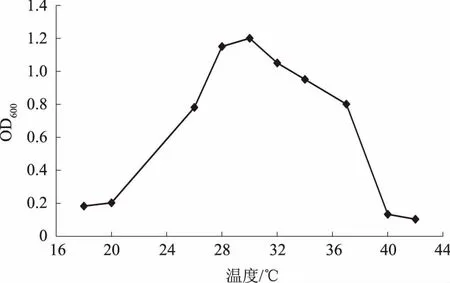
图8 温度对菌株JL-1生长的影响
2.3.3 pH值对解磷菌株JL-1生长的影响 由图9可知,pH值低于4.5或高于9.0时,菌株无法生长,在pH值4.5~9.0时,随着pH值的升高,OD600值呈现先升高后降低的趋势。菌株较适生长的pH值为6.5~8.0,最适生长pH值为7.0。
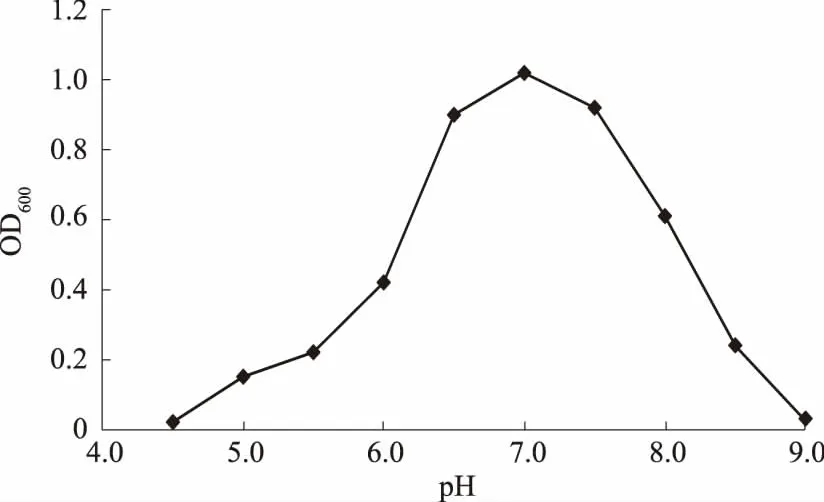
图9 pH值对菌株JL-1生长的影响
2.3.4 NaCl质量浓度对解磷菌株JL-1生长的影响 由图10可以看出,当NaCl质量浓度在0~10 g/L时,菌体量呈升高趋势,可见较低的NaCl质量浓度能够促进菌株的生长;当NaCl质量浓度继续增大时,菌体生长逐渐受到抑制,当质量浓度大于60 g/L时,菌株几乎不生长。可见,菌株可以耐受NaCl质量浓度为60 g/L,最适合其生长的NaCl质量浓度为10 g/L。
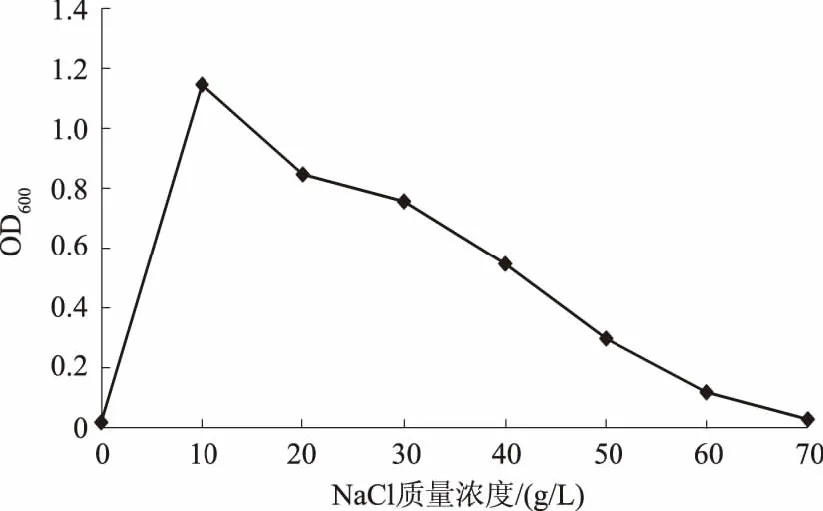
图10 NaCl质量浓度对菌株JL-1生长的影响
3 结论与讨论
本研究从土壤中筛选获得1株具有较好解磷效果的细菌,经形态学观察、生理生化及分子生物学鉴定,确定该菌株为不动杆菌属(Acinetobacter)中的Acinetobacterindicus。不动杆菌属细菌在自然界广泛存在,目前,不动杆菌属中已经被正式命名的共有37 个种[32],其可以在潮湿和干燥的表面生存,是重要的土壤微生物,具有代谢多样性,可以降解己内酰胺、除草剂、农药、石油烃组分等,但尚未见Acinetobacterindicus降解磷的报道。因此,本试验筛选所得AcinetobacterindicusJL-1从一定程度上丰富了野生解磷菌资源。
土壤重要的理化指标有酸碱度、温度、盐度等。土壤环境复杂,具有较大的温度、酸碱度、盐度变化等特征[33]。对AcinetobacterindicusJL-1的生长特性研究表明,该菌株生长较快,在温度26~37 ℃、pH值6.5~8.0条件下,生长较好,最适温度为30℃,最适pH值为7.0;可以耐受NaCl质量浓度为60 g/L,生长最适NaCl质量浓度为10 g/L。综上,该菌株可以在较复杂的环境条件下生长,具有较好的应用前景。

