豚鼠耳蜗螺旋动脉平滑肌细胞的原代培养及鉴定
肖靖杰,张治平,王 洋,司 超,张 亮,张 伟,李 丽,李新芝,马克涛
(石河子大学医学院:1. 新疆地方与民族高发病教育部重点实验室;2. 生理学教研室;3. 第一附属医院耳鼻喉科;4. 第一附属医院老干二科;5. 病理生理学教研室,新疆石河子 832000)
研究表明,内耳循环系统紊乱与突发性耳聋、Meniere综合征、老年性听力丧失及耳毒性药物诱发的听力丧失等密切相关[1-3]。由于听觉在传导过程中的高耗能,螺旋动脉的血流供应对维持听觉器官的功能有着重要的作用。
耳蜗螺旋动脉(spiral modiolar artery, SMA)是供应耳蜗血流的唯一动脉,其上游动脉依次是小脑前下动脉和脑基底动脉,而小脑前下动脉有两个功能性的终末分支,分别是前庭耳蜗支和螺旋动脉支。因此,当SMA发生异常变化如血管痉挛等时,将会导致耳蜗血流供应减少甚至完全中断,引起内耳血液循环紊乱及耳蜗功能失调,出现眩晕和耳鸣等症状[4]。所以,SMA的血流供应对维持正常听力十分重要。血管主要由内层的内皮细胞、中层的平滑肌细胞及外层的成纤维细胞组成,通常认为,血流是由血管直径来控制的,血管的直径又是由血管平滑肌细胞的收缩状态来控制的[5]。由于SMA只有左右各一支,样本量少,不能满足相关实验的研究,所以建立血管平滑肌细胞的体外模型对于内耳循环系统紊乱导致的病理生理变化及相关疾病的病因机制研究很有意义。虽然平滑肌细胞的培养方法已经十分成熟,但是由于不同器官或组织的血管间结构和功能存在着较大差异,且前期研究发现耳蜗螺旋动脉平滑肌细胞静息膜电位呈现独特的双峰分布[6-7]。因此,从其他器官或组织得出的结论并非完全适用于内耳循环系统。本实验经过反复尝试,最终联合应用了酶消化法和直接贴壁法这2种常用的方法培养出了大量耳蜗螺旋动脉平滑肌细胞,经鉴定,其纯度高,生长状况良好。
1 材料与方法
1.1材料
1.1.1 实验动物 出生约2周,体质量145~185 g的豚鼠,雌雄不拘,购于新疆医科大学动物实验中心,动物使用许可证批号:SCXK新(2003-0001),动物质量符合一级标准。饲养和实验研究过程均严格遵守《石河子大学医学伦理委员会条例》。
1.1.2 主要试剂 DMEM/F12培养基,胎牛血清(FBS),胰蛋白酶,青霉素、链霉素(美国Hyclone公司),平滑肌肌动蛋白(α-SM-actin)抗体(美国abcam公司),GAPDH一抗、二抗、即用型SABC试剂盒、DAB显色试剂盒(北京中杉金桥),BSA(美国Blotopped公司),DAPI(北京Solarbio公司),PBS、Triton-x-100(上海生工),其余试剂均为国产分析纯。
1.1.3 主要仪器 CO2恒温培养箱(Thermo公司),激光共聚焦显微镜(德国Carl Zeiss公司),倒置相差显微镜(美国Motic公司),电泳仪、电转膜仪、GEL-DOC2000凝胶成像仪(美国BIO-RAD公司)。
1.2方法
1.2.1 原代培养 豚鼠5只,100 mL/L水合氯醛麻醉后断头处死,无菌条件下取下颞骨,生理盐水中打开听泡,在镜下取出耳蜗,剥离耳蜗外侧壁的血管纹毛细血管网和螺旋韧带,小心分离出SMA及其主要分支。将分离出的SMA及其分支放入预冷的不含Ca2+和Mg2+的Hank’s液中漂洗2~3次,移入无菌台操作。
将SMA移入装有Hank’s液的培养皿中,剪成3~5 mm大小的片段,然后将血管片段放入浓度为1.25 g/L的胰蛋白酶中,置于CO2培养箱中消化20 min,每隔5 min轻轻晃动培养皿,并轻轻吹打3~4次,消化完成后,立即终止消化;1 000 r/min离心5 min。弃上清液,剩余血管片段加入几滴含200 mL/L胎牛血清的培养基,轻轻混匀,均匀铺在培养皿中。血管片段间隙为2~3 mm,培养皿倒扣置于培养箱中2 h。2 h后,翻转培养皿,加入含200 mL/L胎牛血清的培养基,放回培养箱中,静置3 d。在第4天可以进行首次换液,在第6~8天可见细胞由组织边缘长出,大约3周可以长满培养皿,并进行首次传代。
1.2.2 细胞传代 当细胞生长密度达到80%~90%时,可进行传代[8]。弃培养基,PBS洗2~3遍,取质量浓度为2.5 g/L的胰蛋白酶(含0.2 g/L EDTA)进行消化,镜下可见细胞边缘折光增强,成片皱缩变圆且细胞间隙逐渐变大。当见细胞大部分脱落时立即终止消化,并夹弃较大的血管片段,收集细胞悬液,1 000 r/min离心5 min,弃上层液,加入培养基轻轻吹打混匀,分别移入2个新的35 mm的培养皿中,培养箱中继续培养。
1.2.3 细胞纯化 由于SMA直径小,不容易去除内膜和外层的纤维层,所以在细胞传代的过程中,根据成纤维细胞和血管平滑肌细胞不同的贴壁时间采取了自然纯化法和差异贴壁法对细胞进行了纯化。另有文献报道,成纤维细胞的贴壁能力大于平滑肌细胞,而平滑肌细胞大于内皮细胞[9]。同时,由于内皮细胞需要的培养条件较高,在上述的培养条件下无法存活[10]。根据上述规律,在传代时,首先将细胞悬液移入35 mm的培养皿中,静置30 min,使部分细胞贴壁,然后吸取上层细胞悬液移入另一个新的培养皿中,再次静置30 min,最后吸取第2个皿中的细胞悬液移入第3个培养皿中,收集第3个培养皿中的细胞即可获得较纯的平滑肌细胞。
1.2.4 细胞鉴定 形态学观察:应用倒置相差显微镜观察并拍照记录细胞的大小、形态、生长方式及肌丝排列特点等。
细胞免疫荧光染色:取第4代处于对数生长期的细胞均匀种植到放置了玻片的6孔板中,使细胞爬片。3 d后,弃培养基,37 ℃预温的PBS洗3次,5 min/次;40 g/L多聚甲醛固定15 min,PBS洗3次;2 g/L Triton-x-100透化细胞3 min,PBS洗3次;50 g/L BSA 37 ℃恒温箱封闭30 min,PBS洗3次。加入α-SM-actin一抗,湿盒置入4 ℃冰箱中过夜。次日,37 ℃恒温箱复温30 min,PBS洗3次。暗室中,加入二抗,37 ℃恒温孵育1 h,PBS洗3次,DAPI染核,抗荧光淬灭剂封片,应用激光共聚焦显微镜采像,分析结果。
细胞免疫组化染色:细胞爬片,透化,30 mL/L H2O2-甲醇封闭5 min,PBS洗3次。加入α-SM-actin一抗,4 ℃过夜。PBS洗3次,滴加二抗类似物(山羊抗兔IgG/HRP聚合物),37 ℃孵育15~20 min,PBS洗3次,DAB溶液显色,蒸馏水冲洗,苏木素复染,自来水反蓝,中性树胶封片,采像。
Western blot:分别收集第4~6代细胞,裂解并提取总蛋白质,BCA法测蛋白浓度。加入适量上样缓冲液煮沸,冻存备用。聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后转至硝酸纤维素膜,50 g/L BSA封闭2 h,加入α-SM-actin(1∶1 000),4 ℃过夜,TBST洗膜,二抗(1∶20 000)室温孵育2 h,于暗室中滴加发光试剂,压片,显影,定影,采集图像后用软件Quantity One进行分析。
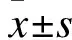
2 结 果
2.1细胞培养SMA血管片段贴于培养皿6 d后,约85%的组织块存活,镜下可观察到大量细胞从组织块边缘游离出来(图1A)。至10 d左右,随着细胞的增殖,培养皿内可见大量平行生长的细胞,18 d左右可见细胞铺满皿底(图1B)。细胞大小形态不一,呈梭形、三角形或带状,有长短不一的胞突,胞质丰富,胞核呈卵圆形,居中,部分可见双核甚至多核(图1C)。细胞密度较低时,常交织成网状,而培养至22 d左右,细胞密度较高,呈螺旋状或栅栏状,表现为典型的“峰-谷”样生长(图1D)。利用细胞的生长特点进行反复的纯化,平滑肌细胞的纯度越来越高,第4代后可达95%以上。
2.2平滑肌细胞的鉴定
2.2.1 细胞免疫荧光染色 取第4代的细胞,爬片后经平滑肌细胞特异的肌动蛋白(α-SM-actin)抗体进行细胞免疫荧光染色,结果显示肌动蛋白阳性表达率达95%(图2A)。经DAPI染核,胞核呈蓝色(图2B)。图2A和图2B Merged后(图2C)。
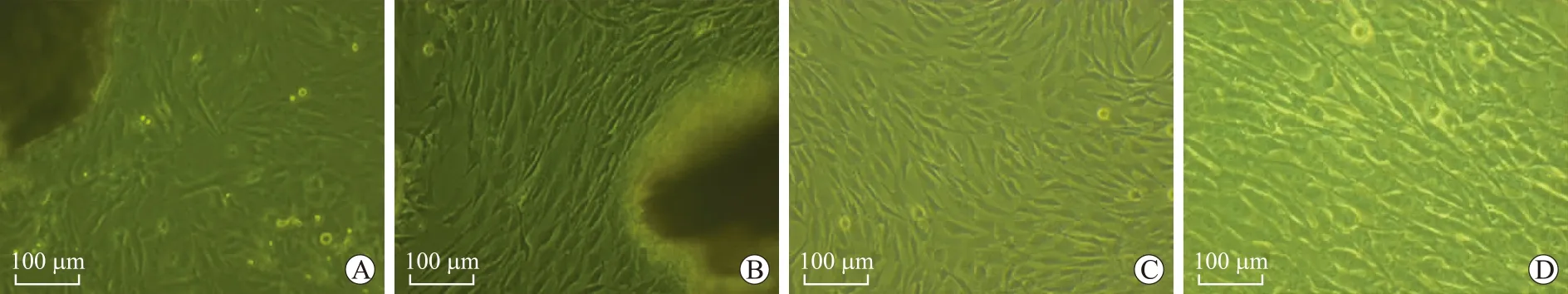
图1SMA平滑肌细胞的生长过程
Fig.1 Growth process of VSMCs (×100)
A:培养第6天,细胞爬出;B:培养第18天,细胞铺满皿底;C:细胞呈梭形、三角形或带状;D:细胞呈典型的“峰-谷”样生长。

图2平滑肌细胞的免疫荧光染色
Fig.2 VSMCs stained by α-SM-actin immunofluorescence (×200)
A:平滑肌细胞α-SM-actin免疫荧光染色;B:DAPI染核;C:A和B合并。
2.2.2 细胞免疫组化染色 取第4代的细胞,爬片后经肌动蛋白抗体进行免疫组化染色(图3),镜下可见胞质内含大量棕黄色的α肌动蛋白丝,呈线性排列且与细胞长轴平行,细胞核呈卵圆形,居中。

图3平滑肌细胞的免疫组化染色
Fig.3 VSMCs stained by α-SM-actin immunocytochemistry
A:平滑肌细胞α-SM-actin免疫组化染色(×100);B:镜下可见胞质内含大量棕黄色的α肌动蛋白丝(×250)。
2.2.3 Western blot检测平滑肌肌动蛋白的表达 收集第4~6代的细胞,裂解并提取总蛋白,Western blot检测平滑肌特异性的α-SM-actin的表达情况,结果显示其均呈阳性表达,且各组之间均无统计学意义(P>0.05,图4)。

图4平滑肌细胞肌动蛋白的表达情况
Fig.4 VSMCs stained by Western blot
3 讨 论
众所周知,SMA是供应耳蜗血流的唯一动脉,其在蜗轴内螺旋上升,在耳蜗外侧壁主要分成血管纹毛细血管网和螺旋韧带毛细血管网,其中血管纹中的毛细血管最密集[11]。由于SMA是供应耳蜗血流的唯一动脉,且其侧枝循环较少,一旦发生堵塞,不易代偿,可造成耳蜗微循环的障碍及病理性的损害。因此,SMA的血流供应对维持正常听力十分重要。大量证据表明,内耳循环系统紊乱与突发性耳聋、Meniere综合症、老年性听力丧失、耳毒性药物诱发的听力丧失及增加噪声的敏感性等密切相关。总之,SMA平滑肌细胞的培养对于研究其相关疾病的病理生理过程具有重要意义。
由于SMA细小,分离困难,就目前而言缺乏简单经济的平滑肌细胞培养方法,因而大大制约了对其相关病理生理变化的研究。本实验详细描述了SMA的分离,原代细胞的培养、纯化及鉴定的方法,从而建立了一种简单经济又高效的SMA平滑肌细胞的培养方法。实验发现,6 d左右组织块边缘有平滑肌细胞游离出来,18 d左右铺满皿底,第3代即可得到较纯的平滑肌细胞。经过鉴定,在形态上,细胞呈典型的“峰-谷”样生长,经免疫荧光及组化染色,第4代细胞的肌动蛋白阳性表达率达95%,而Western blot结果亦同样显示肌动蛋白呈阳性表达。
在培养SMA平滑肌细胞的过程中,最大的问题就是细胞的纯化,即如何去除混杂在其中的内皮细胞和成纤维细胞。有文献报道,酶消化法和组织贴块法是培养平滑肌细胞最常用的2种方法[12-13]。其中,酶消化法培养细胞周期虽然较短, 但消化酶作用的时间和浓度不易掌握(酶消化时间过短或酶浓度过低时消化不完全,酶消化时间过长或酶浓度过高时易造成细胞损伤),且酶本身对细胞就有一定的毒性作用;相比较而言,组织贴块法操作简便,不易发生污染,但培养周期较长。微小动脉的血管是由三层细胞组成的:外层的成纤维细胞、中间层的平滑肌细胞和内层的内皮细胞。培养大血管平滑肌细胞时,可以通过机械刮除的方式去除成纤维细胞和内皮细胞,但SMA较细小,不宜采用上述方式。所以经过尝试,本实验最终选择将2种方法联合使用。
另外,实验中有以下几个关键步骤需要注意:①动物选择时,由于豚鼠具有与人类类似的耳蜗解剖结构,在相同条件下,年幼豚鼠的组织块较年长豚鼠有更好的增殖潜能,在保证组织足够的情况下,本实验选用了2周龄左右新生豚鼠;②豚鼠耳蜗外侧壁主要是血管纹毛细血管网和螺旋韧带毛细血管网,分离SMA时动作一定要轻柔,避免因对血管过度牵拉而造成的损伤;③细胞生长具有密度依赖性,组织块大小以1 mm2为宜,间距为2~3 mm,以保证细胞有足够的生长空间且能保持合适的生长密度;④组织贴块时,培养皿倒扣的时间为2 h,时间过短贴壁不牢,过长则会导致组织块干涸;⑤原代细胞培养时选用含200 mL/L胎牛血清的培养基,血清浓度过低会降低培养的成功率,而传代培养时,开始几代血清浓度可降为150 mL/L,以后传代则为100 mL/L。
内耳血液循环紊乱导致的Meniere综合征、老年性听力丧失及耳毒性药物诱发的听力损伤等已经成为困扰人类的又一难题,而本研究所介绍的SMA平滑肌细胞培养方法较为成熟,可为内耳循环系统紊乱导致的病理生理变化的体外研究及血管平滑肌药物评价提供一个理想的实验材料。

