不同鲜食葡萄品种的高温逆境应答反应研究
查 倩,奚晓军,和雅妮,蒋爱丽
(上海市农业科学院林木果树研究所,上海 201403)
温度是影响葡萄生长发育和产量品质的主要因子,夏季持续的高温环境会影响葡萄植株生长和果实发育,表现为叶片卷曲失水干枯,果实出现较为严重的日灼[1],造成不可逆的经济损失。
高温逆境会破坏植物体内活性氧的平衡状态,属于氧化还原胁迫[2-4]。植物往往通过提高抗氧化酶活性,减少自由基的伤害,来应答逆境[5-6]。超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)等均参与植物抗氧化反应[7],大多数植物SOD、POD(过氧化物酶)、CAT的酶活性在高温下表现出增多现象[8-9],并且高温会导致植物组织中的丙二醛(MDA)等有害物质增多[10]。
此外,高温逆境下植物会产生一系列生理生化过程,其中光合作用最为敏感[11],研究表明高温处理会破坏PS II光化学系统,尤其表现在抑制植物光合电子传递,降低叶片光化学效率,导致植物不能有效利用吸收的光能,最终破坏光合中心机构[12-15]。高温胁迫诱发有机体合成一系列热激蛋白HSPs,其中分子量为15—30 ku的蛋白是sHSPs,会参与保护PS II光化学反应[16-17]。目前,sHSPs蛋白与植物耐热性相关研究较多[18-19]。
孙军利等[20]研究认为葡萄高温逆境与氧化还原平衡关系密切,Luo等[21]发现葡萄叶片的光合作用受温度影响显著。我国南方地区主要种植欧美杂种系葡萄品种,并常出现40 ℃以上极端高温天气,不同葡萄品种在高温逆境下的差异应答反应的比较目前还没有报道。为了探明不同遗传背景葡萄品种的高温应答过程,本研究开展了欧美杂种系葡萄高温逆境应答反应研究,以便为南方地区葡萄产业的健康发展提供理论参考。
1 材料与方法
1.1 试验材料与设计
试验于2014年12月—2015年10月在上海市农业科学院进行。葡萄品种有‘巨峰’‘巨玫瑰’‘醉金香’‘夏黑’‘申丰’‘申华’和‘沪培1号’,均属于欧美杂交品种(V.Vinifera×V.LabruscaL.)。
将一年生盆栽葡萄扦插苗种植于直径30 cm、高度40 cm的塑料盆内,培养介质为椰糠∶腐殖土 = 1∶1。试验在智能人工气候培养箱(PRX-1000C,杭州钱江仪器设备有限公司)中进行,设定白夜持续时间分别为14 h10 h,相对湿度保持在65%—70%,白夜温度保持在(25±1) ℃(20±1) ℃,光合有效辐射为 200 μmol·m-2·s-1。
待植株长至20—25片功能叶完全展开时进行25 ℃、35 ℃、45 ℃温度处理,设置处理时间为每天的10:00—16:00,其他时间段(白夜)温度保持(25±1) ℃(20±1) ℃。每个小区选5株葡萄,设置3个小区。不同温度梯度分别处理3 h、6 h及150 h后,选第7—9片功能叶进行无损伤的叶绿素荧光测定,重复10次,并取叶片冻存在-70 ℃超低温冰箱内,用于SOD活性、MDA含量和HSP21蛋白表达的检测,重复3次。
1.2 测定方法
1.2.1 抗氧化酶(SOD)活性及丙二醛(MDA)含量测定
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑NBT法[22];丙二醛(MDA)含量测定采用硫代巴比妥酸TBA显色法[23]。
1.2.2 叶绿素荧光参数的测定
利用连续激发式荧光仪(Pocket PEA,Hansatech,英国)无损伤测定葡萄叶片叶绿素快相荧光动力学参数,测定前进行20min暗适应处理,OJIP曲线由3 000 μmol·m-2·s-1红光诱导,测定时间为1s。
叶绿素荧光各参数意义:FvFm=ΦPo为PSII光化学反应中最大光化学效率;PIABS为以吸收光能为基础的性能指数;ΨEo为反应中心捕获的激子中用来推动电子传递时到电子传递链中超过QA的其他电子受体的激子占用来推动QA还原激子的比率;ΦEo为用于电子传递的量子产额;Wk为K相可变荧光占J相可变荧光的比例;RCQA为单位反应中心激活PSII反应中心的能量;δRo为电子从系统间电子传递体传递给光系统I(PS I)受体侧电子受体的概率[13]。
1.2.3 HSP21蛋白表达分析
采取有机溶剂法提取蛋白质[24],并用BCA蛋白定量试剂盒测定蛋白浓度。提取的20μg蛋白样品在质量分数为12% SDS-PAGE配置胶中电泳后转膜,封闭后加入一抗Anti-HSP21(Abcam,England,1∶3 000)[25],4 ℃孵育过夜后加入二抗Anti-rabbit IgG(H+L)(CST,USA,1∶1 000),室温放置1 h后,浸于电化学发光试剂中显色。
1.3 统计学分析
利用SPSS 15.0对数据进行统计学分析,P<0.05表示差异显著。
2 结果与分析
2.1 高温逆境下不同葡萄品种的表型变化
在25 ℃和35 ℃处理下,各品种葡萄植株生长状态和表型较为良好。45 ℃处理6 h时‘申华’和‘夏黑’顶梢和幼嫩叶片表现出失水枯萎症状,但仍然有健康的功能叶片,并持续到150 h时;45 ℃处理3 h时,‘巨峰’和‘巨玫瑰’顶梢就出现失水枯萎症状,6 h后植株大面积的失水枯萎,150 h表现为整株干枯;‘申丰’‘醉金香’和‘沪培1号’在45 ℃处理3 h时植株叶片出现大面积失水枯萎,6 h后整株干枯。观察表型变化可知‘申华’和‘夏黑’品种的幼树具有较好的抗高温性能(图1)。

A—G为25 ℃ 处理下的‘申华’‘夏黑’‘巨峰’‘巨玫瑰’‘申丰’‘沪培1号’‘醉金香’;a—g为45 ℃处理下‘申华’‘夏黑’‘巨峰’‘巨玫瑰’‘申丰’‘沪培1号’‘醉金香’图1 25 ℃和45 ℃处理下6 h时不同葡萄品种表型观察Fig.1 The phenotypic observation of different grape cultivars at 6 h under 25 ℃ and 45 ℃ treatments

图2 不同温度处理下不同葡萄品种SOD活性变化Fig.2 The changes of SOD activity in different grapecultivars under different temperature treatments
2.2 高温下不同葡萄品种SOD活性和MDA积累量的变化
如图2所示,‘申华’的SOD活性在35 ℃处理6 h时增强明显,150 h时恢复至原初水平,45 ℃处理 3 h时SOD活性最高,随后恢复至原初水平;‘夏黑’的SOD活性在35 ℃下变化不明显,而45 ℃处理 3—6 h时略有降低;‘巨峰’‘巨玫瑰’和‘沪培1号’在高温下SOD活性变化均不明显;‘申丰’和‘醉金香’在35 ℃处理SOD活性变化不大,而在45 ℃处理3 h时SOD活性较高。以上可知,高温逆境下不同葡萄品种氧化还原平衡调节方式有所不同。
由图3可知,‘申华’在高温处理下(35 ℃、45 ℃)MDA含量没有出现明显的变化;‘夏黑’和‘巨玫瑰’在35 ℃和45 ℃处理下MDA含量均有增加的现象;‘巨峰’‘申丰’‘沪培1号’仅在45 ℃处理MDA含量增加,其中‘沪培1号’表现最为明显;‘醉金香’在高温处理下MDA含量变化不显著。

图3 不同温度处理下不同葡萄品种MDA含量变化Fig.3 The changes of MDA in different grapecultivars under different temperature treatments
2.3 高温对不同葡萄品种叶绿素荧光参数的影响
由图4可知,与25 ℃处理相比,7个品种在35 ℃处理下FvFm值没有显著变化,但在45 ℃处理下不同品种间FvFm值的变化不同。‘申华’在45 ℃处理3 h时FvFm值下降,6 h时有所恢复,150 h时恢复至原初水平;‘夏黑’在45 ℃处理3 h和6 h时FvFm值在降低,150 h时也恢复至原初水平;‘巨峰’在45 ℃处理3 h至6 h时FvFm值持续下降;‘巨玫瑰’45 ℃处理3 h时FvFm值下降,并在6 h时恢复至原初水平;‘申丰’‘沪培1号’和‘醉金香’在高温3 h时FvFm值都明显下降。由上可知,45 ℃处理3 h时葡萄叶片PS II反应中心较为活跃。

图4 不同温度处理下不同葡萄品种FvFm值变化Fig.4 The changes of FvFm in different grape cultivars under different temperature treatments
由表1可知,35 ℃处理下不同葡萄品种的PS II活性未受到显著影响,仅‘巨峰’的部分参数值在35 ℃处理3 h时增多,已知PIABS值由光能的吸收效率(ΦPo)、反应中心对光能的转换效率(ΨEo)及电子传递效率(ΦEo)组成,说明一定程度的高温逆境会增强‘巨峰’PS II反应中心的光能转换效率和电子传递效率,除‘巨蜂’外的其他6个品种35 ℃处理的PIABS值与25 ℃处理无明显差异。但在45 ℃处理下7个葡萄品种的PIABS值均减少,其中‘申华’‘夏黑’‘巨峰’和‘巨玫瑰’的PIABS值降至0.2—0.6,‘申丰’‘沪培1号’和‘醉金香’的PIABS值降至0.0—0.2,同时伴随着ΦPo、ΨEo和ΦEo值的减少,说明极端高温(45 ℃)会降低反应中心的光能吸收效率和后续过程效率。
35 ℃高温下7个葡萄品种的Wk、δRo和RCQA值与25 ℃无明显差异,但在45 ℃高温下7个品种的Wk值和δRo值几乎均显著性增多,而RCQA值均有明显减少,其中‘申丰’‘沪培1号’和‘醉金香’的变化幅度更大。

表1 不同温度处理3 h时不同葡萄品种其他荧光参数比较
注:*表示一个参数在同一葡萄品种中其他温度处理与25 ℃处理间的显著性差异(P<0.05)
2.4 高温逆境下抗逆蛋白HSP21表达量变化
45 ℃处理逆境响应蛋白HSP21表达的检测见图5,结果表明:HSP21的蛋白表达与处理时间和葡萄品种均有关系,处理3—6h,‘申华’ HSP21蛋白持续积累,6 h时最多,150 h时略有减少;‘夏黑’3 h时有较小幅度的积累,6—150 h积累量显著减少;‘巨峰’高温下3—6 h,蛋白积累增多;‘巨玫瑰’在3 h时蛋白积累较明显;‘沪培1号’‘醉金香’和‘申丰’这3个品种在高温处理后HSP21蛋白量减少明显,这可能与不同品种的耐高温能力差异有关。
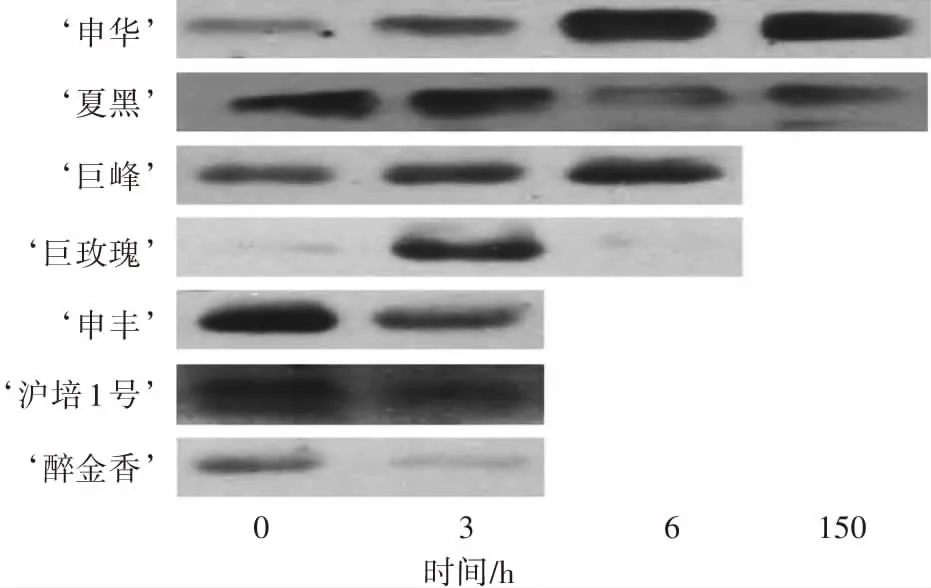
图5 45 ℃处理下不同葡萄品种HSP21蛋白表达Fig.5 The HSP21 levels of different grape cultivars under 45 ℃ treatment
3 讨论与结论
热害是植物对高温逆境最为直观的反应,本研究发现,在25 ℃、35 ℃处理下7个鲜食葡萄品种的植株形态表现均良好。45 ℃处理下不同品种表现不同,‘夏黑’和‘申华’在处理3—6 h时有失水萎蔫出现,在150 h时得到恢复,‘巨峰’和‘巨玫瑰’在处理6 h时叶片大面积失水干枯,处理3 h时‘沪培1号’‘醉金香’和‘申丰’叶片就会大面积失水直至干枯。综上,7个品种中‘夏黑’和‘申华’在极端高温(45 ℃)下植株的形态表现良好,‘巨峰’和‘巨玫瑰’次之,‘沪培1号’‘醉金香’和‘申丰’表现差。
高温逆境下,植物叶片氧化胁迫加剧,MDA等有害物质含量上升,植物通过增强SOD等抗氧化酶活性,可在一定程度上清除过多的有害物质,维持膜系统的稳定性,进而保护叶片光合系统的正常运转[26],本研究中的葡萄SOD活性受高温诱导增多,但不同品种表现不一致。并且,高温逆境下‘申丰’‘沪培1号’‘醉金香’3个品种的MDA含量显著增加,这与酶蛋白失去活性有关[27]。由上可知,高温胁迫下SOD活性和MDA含量的变化与品种的耐热差异性有关[28]。
高温逆境会伤害植物的光合机构,降低植物的PSII光化学效率[29-30]。本研究表明,35 ℃高温处理下‘巨峰’的PIABS、FvFm(ΦPo)、ΨEo和ΦEo有所增加,其他葡萄品种的叶绿素荧光参数均无明显变化。Luo等[21]认为在35 ℃和38 ℃处理下,‘京秀’葡萄的PSII光化学效率均与对照处理没有显著性差异[21]。推断在40 ℃处理下,一些葡萄品种可通过自身的耗散机制来消耗过剩能量[31],不对葡萄叶片的光合原初反应造成影响。但是,45 ℃处理3 h即可明显影响葡萄叶片的光化学反应PSII活性。葡萄、柑橘、甜椒等植物受到高温胁迫后FvFm会显著下降[32-34],与本研究结果一致。本研究还发现,‘申华’‘夏黑’‘巨峰’和‘巨玫瑰’的ΦPo、ΨEo、ΦEo和PIABS值降幅水平显著低于其他品种,说明这4个品种的PS II受逆境影响较小。不同葡萄品种叶片PS II的供体侧指标Wk、受体侧指标δRo及反应中心指标RCQA在45 ℃处理3 h时表现出显著性差异说明PS II的供体侧和受体侧发生能量和电子转移的紊乱,导致反应中心中用于激活PS II化学反应的能量减少。对‘左优红’和‘京秀’葡萄的研究也有相同报道[21,25]。‘申丰’‘沪培1号’和‘醉金香’的Wk、δRo和RCQA值变化幅度较其他品种更为显著,说明这3个品种的PS II光化学反应对高温更为敏感,光合系统受到的破坏更大。
此外,‘夏黑’和‘申华’在45 ℃处理150 h后叶绿素荧光参数值和抗氧化酶活性均恢复到正常水平值,这可能与植株的耐热潜能被激发有关,所以这2个品种表现出较强的高温耐性。
Zha等[35]认为HSP21与高温逆境是存在正比关系的,sHSPs蛋白参与植物叶片的PS II反应,能有效地提高植物的耐热性[36-37],在高温胁迫中上调表达可能有利于保护植物叶片功能。本研究中高温处理下‘申华’和‘巨峰’品种的HSP21蛋白水平增多,时间上表现出缓慢积累性和持续性。‘夏黑’和‘巨玫瑰’的HSP21蛋白水平在45 ℃高温处理后表现为先增加后降低,‘沪培1号’‘醉金香’和‘申丰’的HSP21蛋白在45 ℃高温处理3 h时降低,说明高温处理下叶片失水严重,对蛋白积累也造成影响,所以不同品种应答高温逆境是存在差异的,这些差异可能源于品种间不同的遗传背景。
综上可知,高温胁迫会破坏葡萄叶片的光化学反应和氧化还原平衡,不同鲜食葡萄品种均发生不同程度高温逆境应答反应。从植株的生长状态、抗氧化酶活性、PS II活性等指标变化来看,7个品种对高温逆境应答反应的稳定性较好的为‘申华’和‘夏黑’,其次是‘巨峰’和‘巨玫瑰’,‘沪培1号’‘申丰’和‘醉金香’较差。

