链脲佐菌素诱导2型糖尿病大鼠模型的脾脏代谢特征研究
巴哈古力·阿卜都热合曼, 迪那拉·恰热甫汗, 买吾拉尼江·依孜布拉, 米热阿依·亚力昆, 巴吐尔·买买提明
(新疆医科大学1药学院, 2中心实验室, 乌鲁木齐 830011)
2型糖尿病是常见的慢性病之一,其特征在于胰岛素抵抗伴有胰腺细胞不能通过足够的胰岛素分泌进行补偿[1],发病后患者出现多种免疫功能的异常,包括免疫脏器的萎缩、功能丧失及多种免疫指标的降低[2]。这种免疫功能的紊乱在整个病程的发展过程中起着非常重要的作用。2型糖尿病的发生、发展过程中免疫功能的降低包括特异性和非特异性免疫细胞功能的降低[3]。脾脏作为外周免疫系统中产生抗体的重要淋巴器官,具有造血、贮血和过滤作用, 同时也是细胞接受抗原刺激后产生免疫应答的重要场所,是机体免疫系统的重要组成部分。脾脏作为最大的免疫脏器含有大量的免疫细胞,而免疫细胞的任何病理生理功能的变化机制都表现在其代谢过程和代谢产物的变化过程中。因此,本研究以链脲佐菌素(streptozotocin,STZ)诱导制备2型糖尿病大鼠模型,采用核磁共振为基础的代谢组学技术进行模型大鼠脾脏的脏器代谢物成分轮廓分析,探讨2型糖尿病发生时,体内主要的免疫脏器之一的脾脏代谢功能的变化过程。
1 实验材料与方法
1.1材料
1.1.1 实验动物 健康SD大鼠20只,SPF级,雄性,体质量(200±30) g,购自新疆医科大学动物中心,实验动物生产许可证号:SCXK (新) 2011-0004。动物实验程序由新疆医科大学第一附属医院动物伦理委员会审批确认,符合动物伦理学要求和实验动物保护的相关规定,批准号:IACUC-20140304001。
1.1.2 实验试剂与仪器 链脲佐菌素、戊巴比妥钠(美国Sigma公司),柠檬酸、柠檬酸钠(上海山浦化工有限公司),胆酸钠、胆固醇(上海蓝季生物有限公司),甲醇(天津市富宇化工精细化有限公司),3-(三甲基硅基)-1-丙磺酸钠(DSS)缓冲液(武汉安隆科讯技术有限公司),4%多聚甲醛(Biosharp生物科技公司),3 kDa超滤管(美国Millipore公司),5 mm 核磁管(美国Wilmad Lab Glass公司),超纯水 Milli-Q系统(美国Millipore公司),血糖仪(美国强生公司),600 MHz 核磁共振波谱仪(美国Varian 公司)。
1.2实验方法
1.2.1 动物分组 将所有SD大鼠置于SPF级实验室,自由饮食;室温适应性饲养3 d,随机分为2组,即正常对照组(n=9)和 2型糖尿病组(n=11)。
1.2.2 动物模型建立方法 用高糖高脂饲料(含2.5%胆固醇,0.5%胆酸钠,20%蔗糖,10%猪油,67%基础饲料)稳定饲养6 w诱发胰岛素抵抗,6 w后按照40 mg/kg腹腔注射STZ缓冲溶液,注射后72 h测空腹血糖,以空腹血糖值>11.1 mmol/L纳入模型组。
1.2.3 脾脏样本的收集与检测 模型建立后,检测空腹血糖并在麻醉状态下取下大鼠脾脏,用液氮冷冻,随后转移到-80℃冰箱保存待1H-NMR检测。取同一部位的重约500~700 mg的脾脏组织样本于2 mL离心管中,加甲醇水溶液(甲醇∶水=1∶1)1 mL,用组织破碎机制备匀浆,以12 000 r/min离心15 min,取上清液,重复3次,将上述3次的上清液合并进行冷冻干燥,干燥粉用超纯水1 mL进行复溶,以12 000 r/min离心15 min,取上清液并用3 kDa超滤管过滤,取450 μL滤液与50 μL DSS缓冲液加入5 mm核磁管中,采用Inova600型核磁共振波谱仪,调用 NOESY 脉冲序列进行1H-NMR谱的检测。
1.3统计学处理大鼠血糖值采用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。采用MestReNova软件对所有图谱进行相位调整和基线校正,并用增宽因子为0.3 Hz的指数窗函数进行处理,以DSS分子内(CH3)的信号设为0.000 ppm进行定标。每一个1H-NMR谱在化学位移9.0~0.01 ppm范围内以每段为0.003 ppm进行分段积分并进行归一化处理,同时移除4.70~5.20 ppm范围内的水分信号。1H-NMR谱的积分数据用SIMCA-P软件进行正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)。代谢物在2组中的差异性代谢物采用OPLS-DA分析中获得的变量相关系数(correlation coefficient,r)和VIP值来判断统计学意义。本研究中筛选VIP>1的代谢物为2组中有差异性的代谢物,值越大表示差异性越大、反之越小。
2 实验结果
2.1空腹血糖测定结果正常对照组血糖浓度为(3.46±0.46) mmol/L、2型糖尿病组血糖浓度为(19.21±2.74) mmol/L,2组比较差异有统计学意义(P<0.01)。
2.2基于1H-NMR脾脏组织代谢特点大鼠脾脏典型1H-NMR一维谱如图1所示。本研究共发现27种差异性标志物,包括亮氨酸、异亮氨酸、缬氨酸、β-羟基异丁酸、丙氨酸、赖氨酸、乙酸、谷氨酰胺、蛋氨酸、谷氨酸、肉碱、甲胺、天冬氨酸、肌酸、乙醇胺、牛磺酸、α-葡萄糖、脯氨酸、β-葡萄糖、酪氨酸、组氨酸、胆碱、苏氨酸和苯丙氨酸。
对1H-NMR数据进行OPLS-DA分析结果如图2所示,2组OPLS-DA分析的参数分别是R2X=0.273、Q2=0.788,说明分析结果可靠,模型间有显著差异性。与正常对照组比较,2型糖尿病组大鼠脾脏提取液中β-羟基异丁酸、牛磺酸、α-葡萄糖、脯氨酸、β-葡萄糖、胆碱等代谢物含量明显升高,同时亮氨酸、异亮氨酸、缬氨酸、丙氨酸、赖氨酸、乙酸、谷氨酰胺、蛋氨酸、谷氨酸、肉碱、甲胺、天冬氨酸、肌酸、乙醇胺、酪氨酸、组氨酸,苏氨酸,苯丙氨酸等代谢物含量明显下降,差异有统计学意义(P<0.05),见表1。
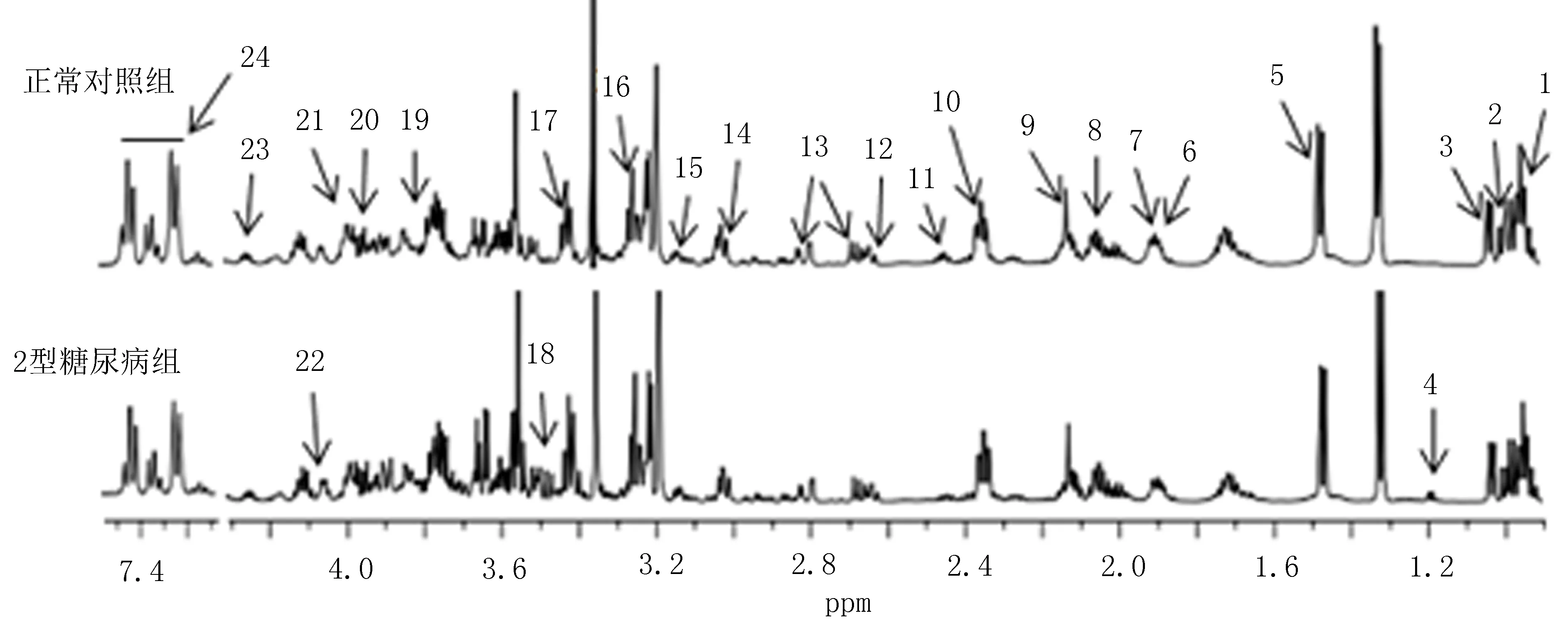
图1 大鼠脾组织典型1H-NMR谱
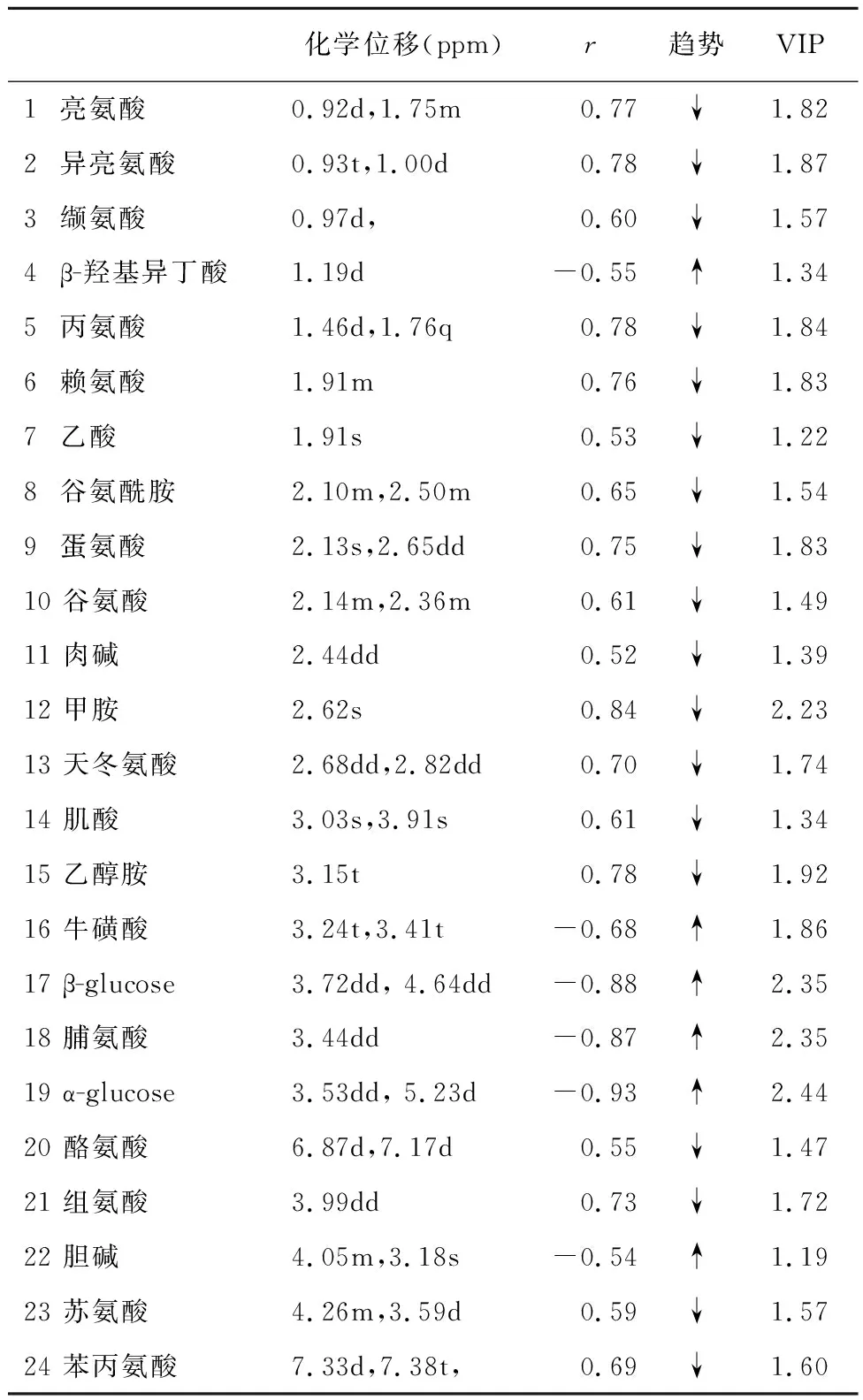
化学位移(ppm)r趋势VIP1 亮氨酸0.92d,1.75m0.77 ↓1.82 2 异亮氨酸0.93t,1.00d0.78↓1.87 3 缬氨酸0.97d,0.60↓1.57 4 β-羟基异丁酸1.19d-0.55 ↑1.34 5 丙氨酸1.46d,1.76q0.78↓1.84 6 赖氨酸1.91m0.76↓1.83 7 乙酸1.91s0.53↓1.22 8 谷氨酰胺2.10m,2.50m0.65↓1.54 9 蛋氨酸2.13s,2.65dd0.75↓1.83 10 谷氨酸2.14m,2.36m0.61↓1.49 11 肉碱2.44dd0.52↓1.39 12 甲胺2.62s0.84↓2.23 13 天冬氨酸2.68dd,2.82dd0.70↓1.74 14 肌酸3.03s,3.91s0.61↓1.34 15 乙醇胺3.15t0.78↓1.92 16 牛磺酸3.24t,3.41t-0.68↑1.86 17 β-glucose3.72dd, 4.64dd-0.88↑2.35 18 脯氨酸3.44dd-0.87↑2.35 19 α-glucose3.53dd, 5.23d-0.93↑2.44 20 酪氨酸6.87d,7.17d0.55↓1.47 21 组氨酸3.99dd0.73↓1.72 22 胆碱4.05m,3.18s-0.54↑1.19 23 苏氨酸4.26m,3.59d0.59↓1.57 24 苯丙氨酸7.33d,7.38t,0.69↓1.60
注: s 为单峰,d 为双重峰,t 为三重峰,q 为四重峰,m 为多重峰,dd 为双重双重峰。

图2 大鼠脾组织OPLS-DA分析的得分图
3 讨论
研究发现,糖尿病的发生、发展过程与免疫系统的功能异常密切相关[4]。2 型糖尿病患者存在细胞免疫功能紊乱,这种免疫功能的低下与血糖和胰岛素升高有很高的相关性[2]。本研究发现,2型糖尿病大鼠模型体内主要免疫器官之一的脾脏小分子代谢物含量发生了明显的变化。这些代谢物含量的变化可能与免疫系统的病变过程密切相关。
本研究发现,与正常组比较,模型组大鼠脾脏组织中呈现高葡萄糖水平,这一结果与血浆葡萄糖水平一致。但是乳酸、丙酮酸等糖酵解产物在2组中没有差异。支链氨基酸(BCAA)转化为α-酮酸,并进一步转化为乙酰辅酶A衍生物,是增加胰岛β细胞胰岛素分泌的重要营养信号,它们通过外周和中枢机制调节饱腹感和葡萄糖代谢[5]。模型组脾脏组织中异亮氨酸、亮氨酸、缬氨酸水平下降,说明支链氨基酸的合成受到抑制。支链氨基酸不仅参与免疫器官的发育、免疫细胞的增殖分化,还影响着细胞因子的分泌以及免疫应答的调节。支链氨基酸缺乏会导致免疫器官的萎缩以及免疫细胞的功能障碍。亮氨酸、亮氨酸、缬氨酸等氨基酸不仅刺激单核细胞增值,而且也促进免疫反应的发展,可见其含量的降低与免疫功能的异常直接相关。
苯丙氨酸的主要代谢途径是通过苯丙氨酸羟化酶的作用而代谢成酪氨酸。本研究结果显示,模型组脾脏组织中苯丙氨酸和酪氨酸水平均明显降低。酪氨酸通过酪氨酸羟化酶作用可能代谢为二羟基苯乙炔,然后进一步代谢为多巴胺、去甲肾上腺素和肾上腺素等儿茶酚胺类神经递质[6]。酪氨酸的减少可导致儿茶酚胺类神经递质的减少[7],这些神经递质的减少会影响神经调节,从而导致内分泌纷乱和中枢调节异常。因此模型组中酪氨酸的减少可导致儿茶酚胺类神经递质的减少。
谷氨酸通过酶的作用可与多种代谢物相互转化。例如,谷氨酸盐可由丙氨酸或天冬氨酸盐与转氨酶催化的2-氧代戊二酸盐组合产生,其产生的副产物(丙酮酸盐和草酰乙酸盐)是糖酵解、糖异生和三羧酸循环(TCA循环)中的关键组分。所以说谷氨酸盐间接参与到能量代谢中。谷氨酸还可以通过谷氨酰胺合成酶的作用转化为谷氨酰胺,再通过鸟嘌呤核苷酸(GMP)合成酶的催化下生成嘌呤代谢的重要中间体GMP;同时谷氨酰胺是最主要的免疫营养素之一,是多种免疫细胞的重要能量来源。谷氨酰胺通过促进淋巴细胞、巨噬细胞的增殖,提高肿瘤坏死因子、白介素水平增强机体的免疫功能[8]。此外,谷氨酸-半胱氨酸连接酶与甘氨酸和半胱氨酸结合,将谷氨酸转化为谷胱甘肽,谷胱甘肽是一种重要的氧化还原调节分子,在基因表达、DNA和蛋白质合成、细胞增殖、信号转导等方面发挥重要作用。
丙氨酸通常由丙酮酸通过丙氨酸转氨酶产生。因此,模型组大鼠丙氨酸的下降可能是由于丙氨酸转氨酶表达紊乱所致。有报道显示,丙氨酸转氨酶水平用于评估组织损伤和临床前和临床研究中的不良事件[9-10],提示丙氨酸水平的降低与脾脏组织损伤相关。丙氨酸降低的另一个可能原因是模型组大鼠脾脏组织中内氨水平降低,从而导致其合成受到抑制。而甘氨酸和丙氨酸是氨循环途径的主要组成部分,作为影响体内氨基反应[11]。
蛋氨酸、苏氨酸和组氨酸也有很重要的免疫调节作用,包括免疫屏障、免疫蛋白的合成、保护淋巴细胞、抵抗自由基的损伤等[12]。以上氨基酸含量的降低也与免疫器官的损伤密切相关。
肉碱和乙酰肉碱的主要功能是通过β-氧化将活化的脂肪酸携带并转移到线粒体中,从而调节脂肪酸代谢的平衡。与正常对照组比较,2型糖尿病组脾脏组织中肉碱水平均降低反映了机体脂肪酸代谢紊乱。脂肪酸β-氧化最终产物之一的β-羟基异丁酸在模型组脾脏组织中含量升高说明脾脏组织脂代谢加强,组织能量消耗加强。模型组脾脏组织中谷氨酸、赖氨酸、丙氨酸水平与β-羟基异丁酸负相关,而这三种氨基酸作为糖酵解前提物,生成的丙酮酸参与到TCA循环,间接参与能量代谢,揭露模型组体内能量代谢受抑制,机体能量不足,组织中β-羟基异丁酸代偿性提供能量。
本研究采用核磁共振为基础的代谢组学技术进行2型糖尿病模型大鼠脾脏组织代谢物成分轮廓分析发现与免疫功能相关的多种代谢物含量的变化。这些代谢物的变化机制及其参与的代谢通路可能与2型糖尿病发生、发展过程的免疫损伤密切相关。

