环氧树脂LX-120固定化脂肪酶
钱明华, 王云鹏, 张云, 孙爱君, 于荣敏, 朱建华, 胡云峰
(1.暨南大学 中药生物技术研究所, 广东 广州 510632; 2.广州中医药大学 中药学院, 广东 广州 510006;3.中国科学院 南海海洋研究所∥中国科学院 热带海洋生物资源与生态重点实验室, 广东 广州 510301;4.中国科学院南海海洋研究所∥广东省海洋药物重点实验室, 广东 广州 510301)
脂肪酶是一类重要的工业用酶,在洗涤剂、食品、调味工业、生物催化分解药物及酯类和氨基酸衍生物、合成精细化学品、农药、生物传感器、生物修复、化妆品和香料等工业均有广泛的应用[1].但是游离的脂肪酶难以回收,不能重复利用而不利于工业生产.通过使用工业酶的固定化技术,可以增加工业酶的使用次数,极大地降低工业酶的使用成本.固定化工业酶的使用还可以进一步促进产品生产线的自动化,从而降低目标产物分离纯化等生产环节的成本[2].此外,固定化过程可以增强酶的储存和酸碱等稳定性[3],从而提高了工业酶的应用性.因此脂肪酶等工业用酶的固定化技术具有极高的工业应用价值.
目前,常用的酶固定化方式有4种:吸附法、共价结合法、包埋法和交联法[4].在吸附法中,酶与载体间的作用力较弱,酶容易流失,因而导致固定化酶不稳定;在包埋法中,由于载体的限制,酶与底物的接触存在障碍,使得反应速率降低;交联法往往作为辅助手段,联合其他方法进行固定化;在共价结合法中,酶分子表面基团可以与载体活性基团间形成共价键,因此两者连接牢固,不易分离,一般具有良好的稳定性.由于环氧基团在常温下即可与酶蛋白表面的氨基酸残基(氨基、羧基和巯基等) 发生温和的开环共价结合,从而将酶分子固定在载体表面[5],因此环氧树脂作为载体在工业酶固定化领域具有很大的应用潜力.已有科研人员将环氧树脂作为载体进行工业酶的固定化研究,并应用于工业生产[6].本研究筛选合适的工业用环氧树脂,尝试对工业脂肪酶进行固定化研究,优化出最佳固定化条件并考察了固定化酶的稳定性,为基于环氧树脂共价结合法固定化脂肪酶等工业用酶奠定良好工作基础.
1 材料与方法
1.1 材料
1.1.1 酶与主要试剂
CAS# 9001-62-1脂肪酶,合肥博美生物科技有限责任公司;环氧树脂LX-120、LX-1000,西安蓝晓科技有限公司生产;环氧树脂ES-1、ES-103B、ES-105、ES-107,天津南开和成科技有限公司生产;异辛烷、AR,天津市富宇精细化工有限公司;磷酸二氢钠、磷酸氢二钠均为GENERAY BIOTECH 提供.
1.1.2 仪器与设备
Infinite M200 Pro多功能酶标仪,瑞士Tecan;MIX-1 振荡器,上海托莫斯科学仪器有限公司;TL5R 立式低速冷冻离心机,湖南赫西仪器装备有限公司;OJS-2012R 温控摇床,上海世平实验设备有限公司.
1.2 方法
1.2.1 脂肪酶的预处理
配制浓度为50 mmol/L、pH为7的PBS缓冲液12 mL,加入酶粉质量72 mg,于4 ℃,3 000 r/min离心10 min,取上清液10 mL待用.
1.2.2 脂肪酶的固定化
(1)固定化过程 参考文献[7-9],结合预试验结果,确定脂肪酶的固定化操作流程如下:准确称取湿载体质量1 g,加入处理完的含酶上清液 10 mL,在温控摇床上40 ℃、200 r/min振荡反应8 h.反应完成,过滤并用磷酸钠缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,置于 4 ℃ 冷藏柜冷藏备用.
(2)固定化载体的筛选 准确称取湿载体ES-1、ES-103B、ES-105、ES-107、LX-120、LX-1000质量各1 g,加入处理完的含酶上清液10 mL,在温控摇床上40 ℃、200 r/min振荡反应8 h.反应完成,过滤并用磷酸钠缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,检测不同固定化酶酶活力.
(3)缓冲液pH对固定化的影响 准确称取湿载体LX-120质量1 g,加入浓度50 mmol/L、pH分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5的磷酸钠缓冲液处理所得的含酶上清液 10 mL,在温控摇床上40 ℃、200 r/min振荡反应8 h.反应完成,过滤并用相应的缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,检测不同固定化酶酶活力.
(4)温度对固定化的影响 准确称取湿载体LX-120质量1 g,加入浓度50 mmol/L、pH为6.5的磷酸钠缓冲液处理所得的含酶上清液 10 mL,分别在温度为20、25、30、35、40、45、50 ℃的温控摇床上200 r/min振荡反应8 h.反应完成,过滤并用相应的缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,检测不同固定化酶酶活力.
(5)时间对固定化的影响 准确称取湿载体LX-120质量1 g,加入浓度50 mmol/L、pH为6.5的磷酸钠缓冲液处理所得的含酶上清液10 mL,在温控摇床上25 ℃、200 r/min分别振荡反应1、2、3、4、5、6 h.反应完成,过滤并用相应的缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,检测不同固定化酶酶活力.
(6)给酶量对固定化的影响 准确称取湿载体LX-120质量1 g,加入浓度50 mmol/L、pH为6.5的磷酸钠缓冲液处理的含酶量分别为300、400、500、600、700、800、900、1 000 U的上清液 10 mL,在温控摇床上25 ℃、200 r/min振荡反应2 h.反应完成,过滤并用相应的缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,检测不同固定化酶酶活力.
1.2.3 正交试验
根据上述实验结果,参考文献[10],决定对酶固定化时的温度、时间、pH、给酶量等4个影响因素进行分析.设计脂肪酶固定化影响因素的水平(表1).
在单因素实验的基础上,采用L9(34)正交试验对脂肪酶固定化条件进一步优化(表2).
表1固定化正交实验因素水平表
Table1Theleveltableofimmobilizedorthogonalexperimentalfactors

水平m/(U·g-1)pHT/℃t/h16006.020128006.5252310007.0303
表2固定化L9(34)正交实验方案
Table2L9(34)orthogonalexperimentalschemeofimmobilization
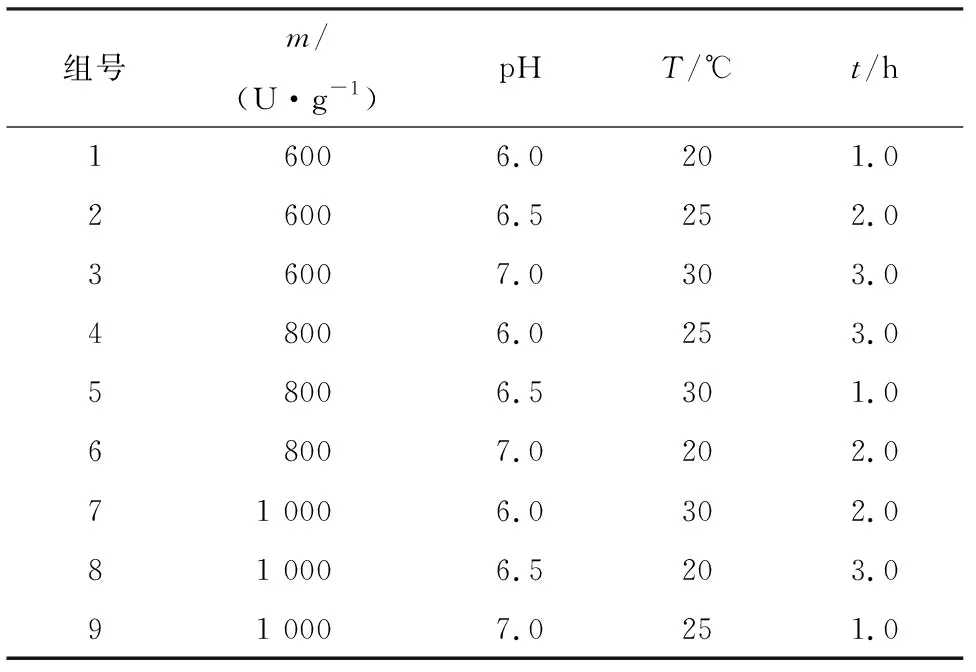
组号m/(U·g-1)pHT/℃t/h16006.0201.026006.5252.036007.0303.048006.0253.058006.5301.068007.0202.071 0006.0302.081 0006.5203.091 0007.0251.0
1.2.4 固定化酶的稳定性
(1)固定化酶的热稳定性 由优化所得的条件制备固定化酶,将游离酶和固定化酶分别在30、40、50、60、70、80 ℃保温2 h,然后测定各酶的酶活力.将游离酶、固定化酶在最佳反应温度60 ℃下分别保温1、2、3、4、5、6、7 h,然后测定各酶的酶活力.
(2)固定化酶的酸碱稳定性 将游离酶和固定化酶在pH分别为 4、5、6、7、8、9、10的环境下孵育2 h,然后测定各酶的酶活力.
(3)固定化酶的操作稳定性 取所制备的固定化酶,60 ℃下反应,反应结束后过滤,滤渣用浓度为0.05 mol/L 的磷酸钠缓冲液冲洗3遍,重复反应10次.测定每1次反应的固定化酶活力.
(4)固定化酶的储存稳定性 将所制备的固定化酶密封、避光存放于4 ℃冷藏柜中.分别在0、5、10、15、20、25、30 d测定酶活力.
1.3 分析方法
1.3.1 游离脂肪酶的酶活测定
脂肪酶酶活定义为:以乳化橄榄油为底物,在测定条件下(40 ℃,pH 7.0),1 min 内催化底物水解产生1 μmol脂肪酸所需的酶量为 1个酶活单位(U).本研究采用改进铜皂-分光光度法的实验条件和反应体系[11],使用Infinite M200 Pro多功能酶标仪测定.
1.3.2 固定化脂肪酶的酶活测定
精确称取固定化酶质量0.1 g,采用改进铜皂-分光光度法的实验条件和反应体系,使用Infinite M200 Pro多功能酶标仪测量其吸光度.
1.3.3 固定化脂肪酶回收率的计算
固定化脂肪酶酶活回收率的计算公式为:
式中:A为固定化脂肪酶回收率,W0为固定化酶酶活,W1为加入的游离酶总活力,W2为离心后上清液酶活.
1.3.4 正交试验
1.3.5 相对酶活
在某一参数的测定过程中,以该实验中所测定的酶活力最大值为100%,该组实验其他条件下测定的酶活力与最大值的比值(%)称为相对酶活.
2 结果与分析
2.1 固定化载体的筛选
从多种不同类的环氧树脂中筛选了6种环氧树脂对脂肪酶进行固定化研究.由于不同的环氧树脂的环氧基团类型、数目以及树脂含水量等参数不同,不同环氧树脂对脂肪酶固定化效果有着显著差异.环氧树脂LX-120 固定化效率明显优于其他5种树脂(图1).因此选择环氧树脂LX-120作为脂肪酶的固定化载体进一步研究.
2.2 影响脂肪酶固定化的单因素条件优化
2.2.1 pH值对酶固定化的影响
其他条件不变,pH值对酶固定化的影响(图2A).缓冲液的酸碱性对酶活性影响较大[12].强酸强碱甚至会导致蛋白质变性和失活.当pH 值为5.5到6.5时,随着pH 值升高,固定化酶酶活升高;当pH超过6.5时,固定化酶酶活随着pH 值升高而逐渐降低,固定化酶在pH 值为6.5时有最好的固定化效果.因此确定pH 值6.5为最佳固定化pH 值.
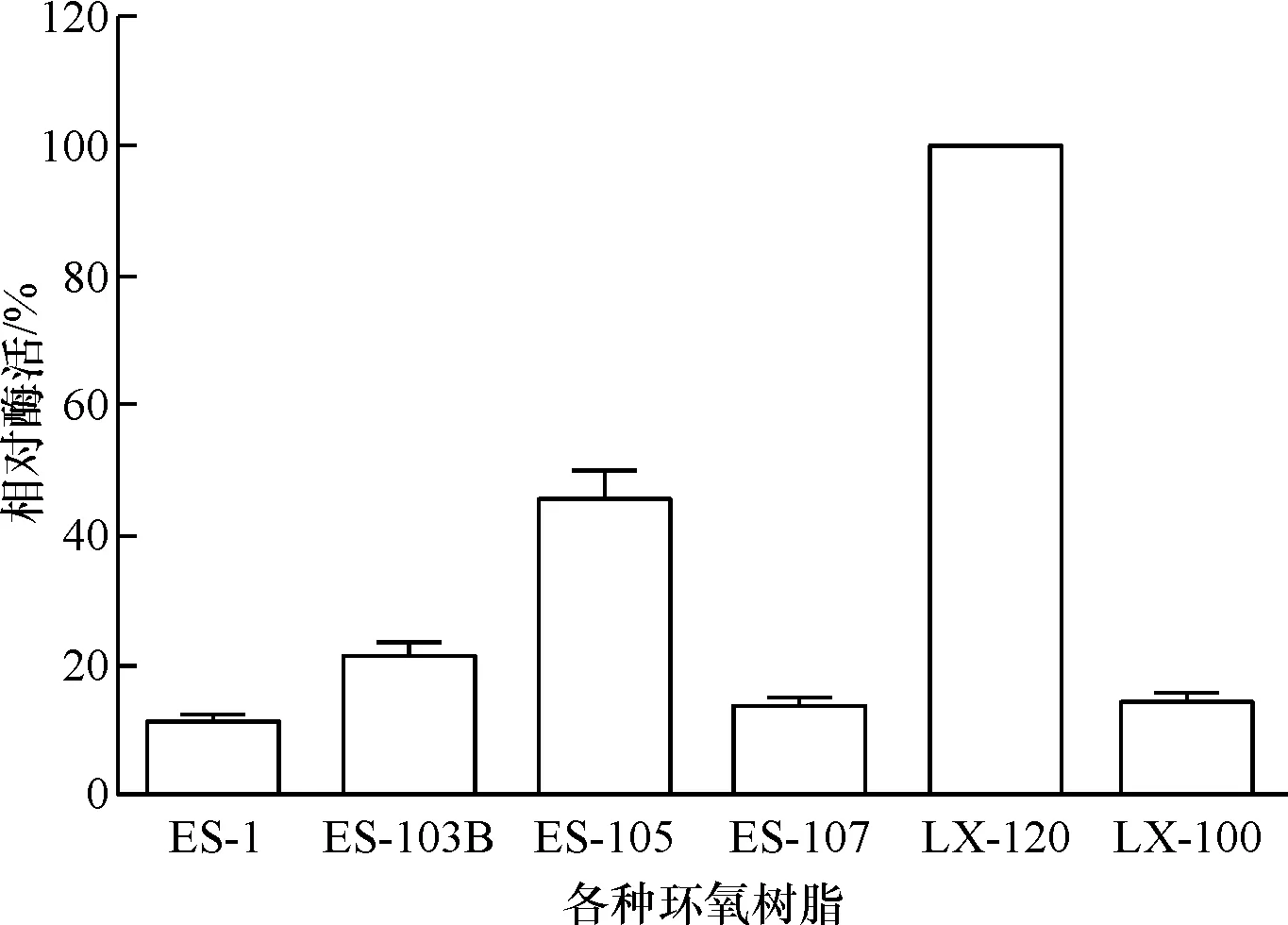
图1 不同环氧树脂固定化脂肪酶的效果
2.2.2 反应温度对酶固定化的影响
其他条件不变,反应温度对酶固定化的影响(图2B).当反应温度为25 ℃时,固定化酶有最好的固定化效果.酶的固定化是一个吸热的过程[13],故而在20~25 ℃,固定化酶酶活随着温度升高而增加.25~50 ℃,固定化酶酶活逐渐降低.环氧树脂固定化酶脂肪酶为共价结合过程,当温度超过25 ℃,温度可能会影响共价键的形成[3,14].因此,确定脂肪酶最佳固定化温度为25 ℃.
2.2.3 反应时间对酶固定化的影响
其他条件不变,反应时间对酶固定化的影响(图2C).最佳反应时间为2 h.在1 ~2 h内,随着固定化时间的延长,酶与载体结合越来越牢固,固定化效果也越来越好.2 h后,脂肪酶与载体的结合到达饱和状态,固定化酶的酶活出现下降的趋势,这与部分文献[13]结果一致,造成该实验现象的原因可能是随着时间的延长,酶分子活性基团与载体的有效基团结合,导致蛋白分子结构改变.
2.2.4 给酶质量对酶固定化的影响
其他条件不变,给酶质量对酶固定化的影响(图2D).在300~800 U,随着给酶质量的增加,酶与载体结合越来越多,固定化酶活力也越来越高,酶活回收率随之降低.随着吸附质量增加,树脂表面基团结合达到饱和,脂肪酶难以再吸附到载体表面.达到800 U后,随着给酶质量增加,固定化酶活力变化不大,但是回收率持续降低.如果继续增加给酶质量,一方面过多的酶蛋白会增加空间位阻,导致固定化酶活力降低;另一方面,从经济角度考虑,会造成游离酶的浪费.综上,确定给酶质量为800 U.

A:反应pH对固定化的影响;B:反应温度对固定化的影响;C:反应时间对固定化的影响;D:给酶质量对脂肪酶固定化的影响.
A: effect of reaction pH on immobilization; B: effect of reaction temperature on immobilization; C: effect of reaction pH on immobilization; D: effect of enzyme loading on immobilization.
图2 各因素对固定化的影响
Fig.2 Effect of Various factors on immobilization
2.3 正交实验结果
实验结果可见4个因素对固定化的影响从大到小依次为给酶质量(A)、固定化温度(C)、pH(B)、固定化时间(D)(表3),而由正交实验结果进行方差分析(表4)可知,4个因素中,给酶质量(A)对固定化有显著影响(F比=3.728>F临界=3.110),与给酶质量对固定化有最大影响的分析结果一致.正交实验优化所得最佳的固定化条件组合为A1B2C3D3,即给酶质量600 U, pH 6.5,固定化3 h,固定化温度30 ℃;由上述条件制备所得的固定化酶酶活回收率最高,为95.42%,此时固定化酶酶活力为(357.03±7.09) U/g.
2.4 固定化脂肪酶的稳定性
2.4.1 固定化酶的热稳定性
固定化酶的最适反应温度为60 ℃,和游离酶的最适反应温度基本一致(图3A).将固定化酶在最佳反应温度60 ℃下分别保温1、2、3、4、5、6、7、8 h,然后测定各酶的酶活力(图3B).随着保温时间的延长,固定化酶的酶活呈下降的趋势.保温7 h,固定化酶活力保留66.21%,而游离酶活力保留约55.47%,固定化酶的热稳定性整体优于游离酶(图3).
表3环氧树脂共价结合固定化脂肪酶L9(34)正交实验结果1)
Table3L9(34)orthogonalexperimentalresultsofepoxyresinwithcovalentlyimmobilizedLipase
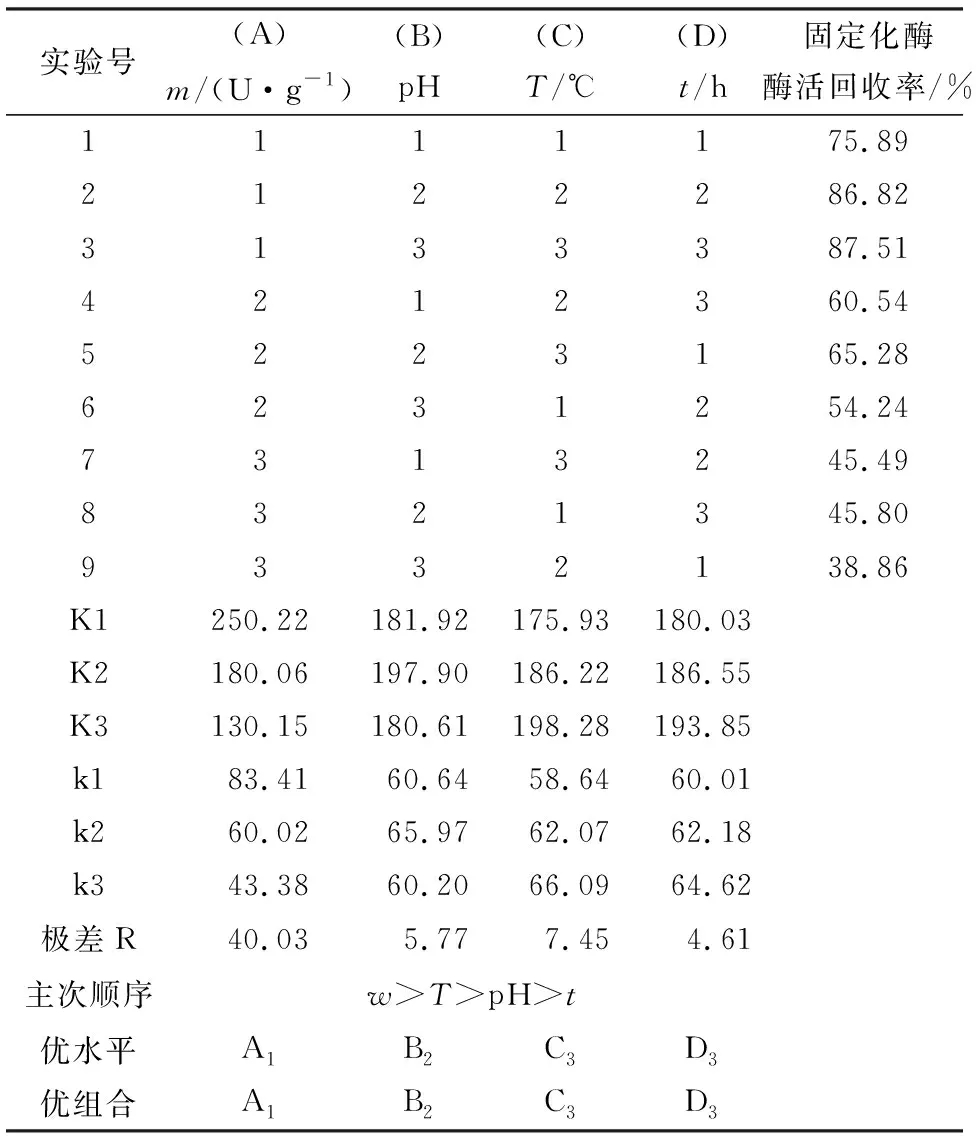
实验号(A)m/(U·g-1)(B) pH(C)T/℃(D)t/h固定化酶酶活回收率/%1111175.892122286.823133387.514212360.545223165.286231254.247313245.498321345.809332138.86K1250.22181.92175.93180.03K2180.06197.90186.22186.55K3130.15180.61198.28193.85k183.4160.6458.6460.01k260.0265.9762.0762.18k343.3860.2066.0964.62极差R40.035.777.454.61主次顺序w>T>pH>t优水平A1B2C3D3优组合A1B2C3D3
1)K为该因素在该水平下酶活力回收率之和;k为该因素在该水平下酶活回收率平均值;R为各因素极差.
表4L9(34)正交实验结果方差分析
Table4AnalysisofvarianceofL9(34)orthogonalexperimentalresults

方差来源m/(U·g-1)1)pHT/℃t/h偏差平方和2 425.5861.7883.4331.87自由度2222F比3.7280.0950.1280.049F临界值(a=0.10)3.1103.1103.1103.110
1)F比>F临界值(a=0.10)表示该因素具有统计学差异.
2.4.2 固定化酶的酸碱稳定性
游离酶的最适反应pH为4,而固定化酶的最适反应pH为7左右(图4A);在pH大于6 的环境中,酶活力均随着pH增加而降低,但是同一pH下,固定化酶的酶活力保留均高于游离酶(图4B).因此,固定化酶的酸碱稳定性整体优于游离酶.
2.4.3 固定化酶的操作稳定性
固定化酶的操作稳定性决定了固定化酶的重复使用性能(图5A).随着使用次数的增加,固定化酶的酶活逐渐降低.连续使用10次后,固定化酶的酶活仍保留初始酶活的64.21%.因此,此脂肪酶经固定化后具有较好的操作稳定性;相比较游离酶以粉状形式在溶液中起作用,1次使用后即很难回收使用,从而增大了工业酶的使用成本.
2.4.4 固定化酶的储存稳定性
环氧树脂储存稳定性是固定化酶稳定性的重要应用指标(图5B).基于环氧树脂制备的固定化脂肪酶在储存30 d后,固定化酶活力保留78.14%,因此,所制备的固定化脂肪酶具有良好的储存稳定性.
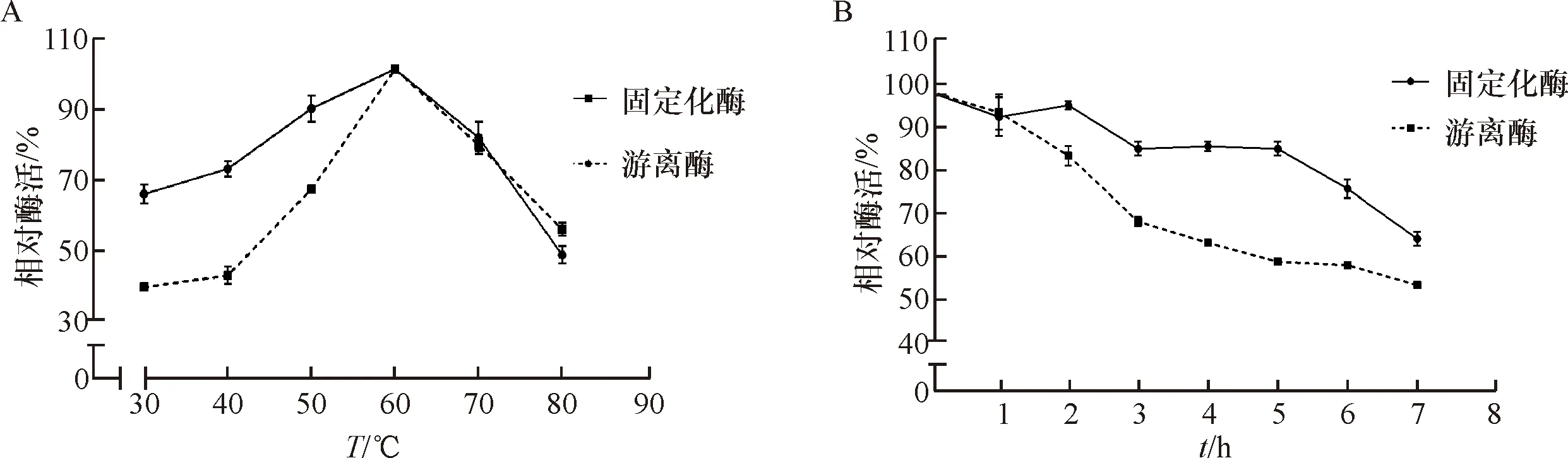
A:固定酶和游离酶的最适反应温度;B:游离酶和固定化酶在60 ℃下的热稳定性比较.

A:固定酶和游离酶的最适反应pH;B:游离酶和固定化酶pH稳定性.
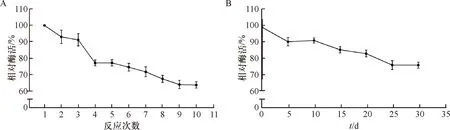
A:固定化酶操作稳定性;B:固定化酶储存稳定性
3 讨论
目前,应用于固定化的环氧树脂多为Eupergit C等昂贵的国外进口环氧树脂[15-16],如Knezevic等[6]在Eupergit C上固定化褶皱假丝酵母脂肪酶(pH 7.0,4 ℃,48 h),当给酶质量分数为6.0 mg/g时,酶活回收率高达92.5%;该固定化酶50 ℃保温7 h,酶活保留约22%,75 ℃保温7 h,酶活保留约18%.Martín等[8]在Eupergit C上固定化环糊精葡糖基转移酶(pH 7.0,25 ℃,48 h),当给酶质量浓度为8.1 mg/mL时,固定化酶酶活回收率约为80%,可溶性和固定化的酶表现出相似的最佳温度和pH值,但固定化酶的最佳pH值更高;该固定化酶在85 ℃下保温1 h,酶活保留90%;重复操作10次,酶活保留40%.本研究与Eupergit C树脂相比,国产环氧树脂LX-120对脂肪酶的固定化性能相似,酶活回收率高达95.42%;与游离酶相比,固定化脂肪酶的热稳定性和酸碱稳定性均有明显提升;固定化脂肪酶在连续反应10次后,酶活仍保留64.21%,操作稳定性较好;固定化脂肪酶在4 ℃下储存30 d,仍保留78.14%的活力;且固定化反应过程条件温和(pH 6.0,30 ℃),固定化时间只需3 h,对脂肪酶的活性影响小,应用于脂肪酶的工业固定化较为便利,所得的固定化酶在某些性能上甚至更优良.
本研究以国产工业用环氧树脂LX-120为载体,通过共价结合法固定化重要的工业用酶—脂肪酶.在对环氧树脂固定化脂肪酶的反应条件进行优化后,所制备的固定化酶酶活可达(357.03±7.09)U/g;由于环氧树脂是依靠环氧基团与脂肪酶反应进行固定化的,酶活回收率高达95.42%.而且本研究中基于环氧树脂制备的固定化脂肪酶具有良好的操作稳定性和酸碱稳定性,固定化酶的温度及酸碱度适用范围更广.
有研究表明,有机相中对某些酶共价固定化有利于维持酶蛋白的天然构象,一定程度克服传统水相中共价固定化导致的酶失活现象[17],因此后续本研究小组将继续探讨有机试剂及金属离子对LX-120固定化脂肪酶的影响.

