miR-34a对脂肪干细胞移植治疗跟腱炎的影响
陈巧杰, 武少坤, 邬耀军, 陈 良, 沈萍萍
(1宁波市第二医院骨科, 浙江 宁波 315010; 2宁波市鄞州区第二医院消化内科, 浙江 宁波 315040)
跟腱炎是指跟腱急、慢性劳损引起的一种无菌性炎症,常见于运动员和中老年患者[1-2],其临床症状以足跟部疼痛、僵硬,运动后疼痛加剧为主,不及时治疗容易引发肌腱撕裂和断裂[3]。目前,其临床治疗方法主要包括物理疗法(如超声波疗法[4]、富血小板血浆疗法[5]、体外冲击波疗法[6]、低水平激光疗法[7]、冷冻疗法[8]等)、通过手术切除跟腱周围的炎症组织、非类固醇抗炎药的内服外敷等[9]。但上述治疗周期相对较长,常常久治不愈,这在很大程度上与病变部位血液供应不足以及细胞代谢失常有关,严重地影响了患者的日常生活[10]。
近年来,骨科专家正致力于寻找一种能促进受损跟腱再生的方法来代替传统疗法以便更好地医治跟腱炎。干细胞作为一种具有多种分化潜能的原始细胞,可在一定程度上改善受损肌腱和韧带的再生功能。脂肪干细胞(adipose-derived stem cells, ADSCs)来源于白色脂肪细胞,具有分化成肌腱细胞、脂肪细胞、神经细胞、内皮细胞、骨骼肌细胞、平滑肌细胞以及心肌细胞的能力[11]。脂肪干细胞在体内能释放出细胞因子和生长因子从而调控受损组织的重建[12]。此外脂肪干细胞还具有抗炎、促进血管再生及有助于纤维母细胞增殖的作用[13]。近年来不少研究发现,微小RNA(microRNA,miRNA,miR)可参与调节脂肪干细胞的增殖和分化,如miR-34a在体内外高表达可促进脂肪干细胞成骨分化[14];而Park等[15]的研究则表明miR-34a能抑制脂肪干细胞的增殖。目前脂肪干细胞越来越多被移植治疗临床疾病,如相关文献报道脂肪间充质干细胞局部移植治疗慢性肾病和慢性阻塞性肺病等[16-17]。脂肪干细胞也具有分化为肌腱细胞的潜能[18],如果将脂肪干细胞注射到跟腱部位,是否能分化为肌腱细胞,起到治疗跟腱炎作用,目前鲜有相关文献报道。
因此,本研究旨在探讨miR-34a在脂肪干细胞移植治疗跟腱炎的过程中是否发挥作用及可能机制。
材 料 和 方 法
1 实验材料及仪器
雌性健康SD大鼠,12周龄,体重230~270 g,购于宁波大学实验动物中心,动物合格证编号为SCXK(苏)2017-0007。TRIzol试剂和转染试剂Lipofectamine 2000购自Invitrogen;RIPA裂解液和BCA 蛋白浓度测定试剂盒购自碧云天生物技术研究所;Ⅰ型细菌胶原酶购自Sigma-Aldrich;材料力学试验机购自日本计测系统公司;兔抗大鼠多克隆Ⅰ型胶原(collagenⅠ)、Scleraxis (Scx)、生腱蛋白C(tenascin C,TNC)和β-actin抗体购自Abcam;SYBR® Premix Ex TaqTM逆转录试剂盒购自TaKaRa;ECL 试剂盒和PVDF 膜购自Millipore。实时荧光定量 PCR仪购自Applied Biosystems。
2 方法
2.1人源脂肪干细胞的分离与培养 在无菌操作台上,取抽脂手术患者皮下脂肪组织约2 g,剥除血管及结缔组织后,眼科剪充分剪碎后,用PBS反复漂洗,除去红细胞。加入含0.075% Ⅰ型胶原酶的PBS溶液,37 ℃消化1 h,再加入等体积的含10%胎牛血清的DMEM培养基终止消化,1 800 r/min离心10 min,弃去上、中两层,加入含10%胎牛血清、1%青霉素-链霉素、2 mmol/L谷氨酸和0.2 mmol/L抗坏血酸的DMEM完全培养基重悬细胞,70 μm细胞筛网过滤后,置于37 ℃、5% CO2培养箱中培养。患者已签署知情同意书,所有实验也获得了宁波市第二医院伦理委员会的批准。
2.2细胞转染实验 将生长良好的hADSCs接种到 6 孔板中,培养18 h左右待细胞融合度达70%~80%,方可用于转染实验。用无RNA 酶枪头吸取适量miR-34a 模拟物(miR-34a mimic)和抑制物(miR-34a inhibitor)(均由GenePharma提供),分别与Lipofectamine 2000 转染试剂混合于培养基中,室温下静置20 min后,将转染复合物加入6孔板中,每孔加入2 mL培养基,前后轻摇细胞板使溶液混合均匀,于37 ℃、5 % CO2培养箱中培养4~6 h后,弃去原培养基培基,更换为 2 mL含10% 胎牛血清的完全培养基继续培养。同时设置转染阴性对照(pre-NC)和阴性对照(negative control,NC)组。
2.3CCK-8法检测细胞活力 取转染后的细胞悬液接种于 96 孔板中,每孔100 μL (每孔1 000个细胞),每组各设置5个重复。每孔沿孔壁加入10 μL CCK-8溶液,37 ℃、5% CO2孵育1 h后,用自动酶联免疫检测仪测定每孔在450 nm波长处的吸光度(A)值,测定转染24 h、48 h、72 h和96 h时细胞的活力。
2.4实验动物分组 健康雌性SD大鼠30只随机分为5组,每组6只,即PBS注射对照组(PBS组)、hADSCs治疗组(hADSCs组)、转染阴性对照的hADSCs治疗组(hADSCs+NC组)、转染miR-34a mimics的hADSCs治疗组(hADSCs+miR-34a组)及转染anti-sense miR-34a的hADSCs治疗组(hADSCs+anti-miR-34a组)。
2.5慢病毒载体的构建 含miR-34a-mimics、 anti-miR-34a及NC的慢病毒质粒载体由GenePharma合成并包装。将hADSCs悬液以每孔5×104接种于96孔板中,计算感染复数(multiplicity of infection,MOI),当MOI达到50时,将10 μL预先配好滴度的慢病毒加入到各孔中,24 h后更换新鲜的培养基。
2.6动物模型的制备 将Ⅰ型细菌胶原酶溶解于生理盐水中配制成15 g/L的溶液,大鼠使用麻醉机面罩给氧及2%异氟烷麻醉成功后,左下肢局部剃毛,于左后腿跟腱中心据跟骨上部10 mm处注射胶原蛋白酶溶液20 μL,构建大鼠跟腱炎模型。模型建好3 d后,在相同注射部位按动物分组分别注入PBS、hADSCs、hADSCs+NC、hADSCs+miR-34a和hADSCs+anti-miR-34a,各组注射细胞量约1×105个。术后4周颈椎脱臼法安乐死各组大鼠。切开皮肤及皮下组织,将跟腱于小腿三头肌起点切断,跟腱远端包括跟骨在内,在跟骨远端切断。
2.7生物力学测定 将待测大鼠跟腱组织的两端固定在材料试验机的夹具中,在恒温恒湿的环境中进行跟腱生物力学性能测定。测试期间不断用生理盐水滴浴润湿组织,预载荷为5 N,加载速率为10 mm/s,直至跟腱在中间处断裂为止。记录最大载荷拉力、最大拉伸长度及压力。跟腱硬度=最大负荷/最大拉伸长度。
2.8RT-qPCR 取待测的各组大鼠跟腱组织,剪碎后研磨成浆,利用TRIzol试剂提取组织总RNA,并逆转录合成cDNA,进行实时荧光定量PCR,检测miR-34a以及hADSCs成肌腱分化标志物collagen I、Scx和TNC的mRNA表达量。以U6作为内参照,采用2-ΔΔCt法计算目的基因相对表达量,所有实验均重复3次。miR-34a的上游引物序列为5’-TGGCAGTGTCTTAGCTGGTTG-3’,下游引物序列为5’-GGCAGTATACTTGCTGATTGCTT-3’; collagen I的上游引物序列为5’-CCCTGGAAAGAATGGAGATG-3’,下游引物序列为5’-CCACTGAAACCTCTGTGTCC-3’; Scx的上游引物序列为5’-GCAAGCTCTCCAAGATTGTA-3’,下游引物序列为5’-CGTCTTTCTGTCACGGTCTT-3’; TNC的上游引物序列为5’-AAAGCAGCCACCCGCTATTA-3’,下游引物序列为5’-TCAGGTTCTTTGGCTGTGGAG-3’;内参照U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。
2.9Western blot实验 利用RIPA裂解液,分别提取各组大鼠跟腱组织总蛋白,BCA法定量总蛋白后,取等量样本进行10% SDS-PAGE;将凝胶上的蛋白转膜至PVDF膜;室温下5%脱脂奶粉封闭 1 h。再用1%脱脂奶粉稀释collagen I、Scx和TNC抗体以及内参照β-actin抗体(1∶1 000),孵育1 h,并于4 ℃过夜。最后在室温下孵育辣根过氧化物酶标记的 II 抗(1∶3 000),得到的蛋白条带通过ECL化学发光液显影并拍照。
3 统计学处理
采用统计分析软件SPSS 18.0进行数据处理,计量资料行正态性检验,所有数据采用均数±标准差(mean±SD)表示。组间比较采用单因素方差分析;多组样本的均数比较先行方差齐性检验,方差齐者两两比较行SNK-q检验,方差不齐者行Dunnett’s检验,以P<0.05为差异有统计学意义。
结 果
1 miR-34a体外抑制hADSCs细胞的活力
体外分别转染miR-34a mimic和miR-34a inhibitor后,hADSCs过表达或抑制miR-34a,CCK-8法检测细胞活力结果显示,转染48 h后,与对照组相比,miR-34a过表达可显著抑制hADSCs的活力(P<0.01),而抑制miR-34a表达则明显地促进了hADSCs的活力(P<0.01),转染后随着时间的延长上述作用呈增强趋势,见图1。这表明miR-34a 在体外具有调控hADSCs活力的能力,且呈时间依赖性。
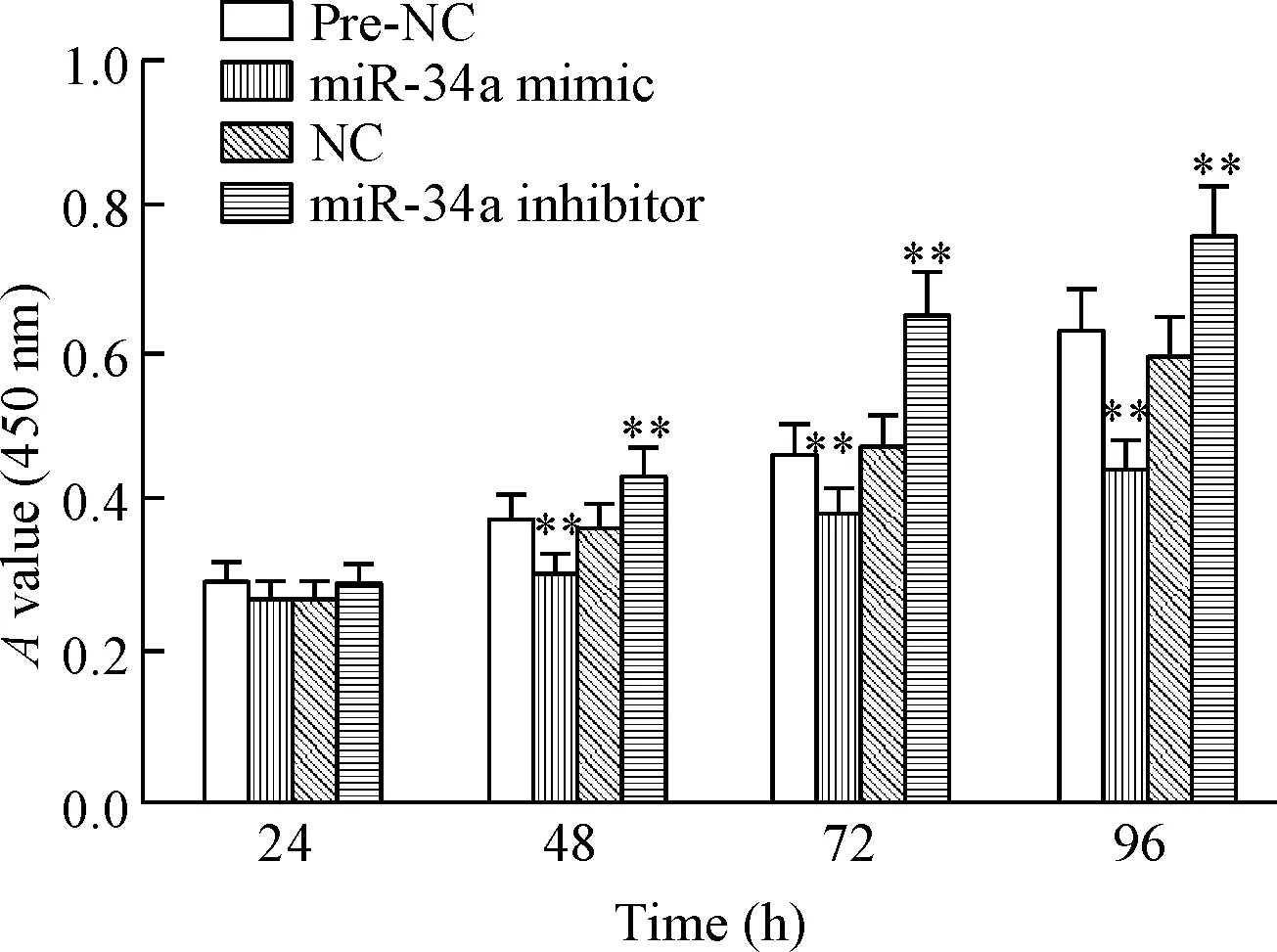
Figure 1.The viability of hADSCs was detected by CCK-8 assay. Mean±SD.n=6.**P<0.01vspre-NC group.
图1CCK-8法检测hADSCs的活力
2 miR-34a影响hADSCs对跟腱炎模型大鼠的治疗作用
5组大鼠跟腱组织的HE染色图如图2A所示。进一步的跟腱组织生物力学检测发现,与注射PBS组大鼠相比,单独注射hADSCs可显著提高大鼠跟腱组织硬度(P<0.01)、压力(P<0.01)和最大负荷拉力(P<0.01)等生物力学指标;而注射转染miR-34a mimics的hADSCs可减弱hADSCs的治疗作用;反之,注射转染miR-34a inhibitor的hADSCs则增强hADSCs的治疗作用,见图2B~D。
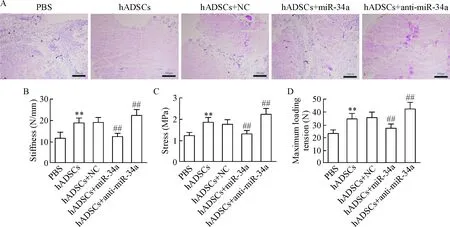
Figure 2.The tendon tissues were detected by HE staining (A) and the changes of biomechanical indexes including tendon stiffness (B), stress (C) and maximum loading tension (D) were determined. The scale bar=100 μm. Mean±SD.n=6.**P<0.01vsPBS group;##P<0.01vshADSCs+NC group.
图2大鼠肌腱组织HE染色结果及硬度、压力和最大负荷拉力等生物力学指标
3 miR-34a影响hADSCs对跟腱炎模型大鼠的促成肌腱分化能力
RT-qPCR检测上述5组大鼠跟腱组织中miR-34a的表达水平,与转染对照组相比,hADSCs+miR-34a组中miR-34a的表达水平显著增加 (P<0.01),而hADSCs+anti-miR-34a组中miR-34a的表达水平显著降低 (P<0.01),见图3。
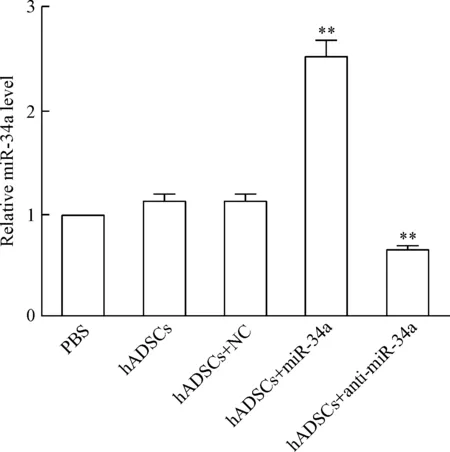
Figure 3.The expression of miR-34a was detected by RT-qPCR. Mean±SD.n=6.**P<0.01vshADSCs+NC group.
图3RT-qPCR检测miR-34a表达水平
与此同时,利用RT-q PCR和Western blot检测大鼠跟腱组织中collagen I、Scx和TNC的mRNA和蛋白表达水平。结果表明,与PBS组相比,hADSCs组collagen I、Scx和TNC的表达水平增加;与hADSCs+NC组相比,hADSCs+miR-34a组collagen I、Scx和TNC的表达降低,而hADSCs+anti-miR-34a组collagen I、Scx和TNC的表达增加(P<0.01),见图4。
讨 论
目前,对于跟腱炎的治疗主要集中在物理疗法,手术介入以及药物治疗等方面,这些手段虽能在一定程度上缓解症状,但在恢复受损跟腱组织机能方面,仍无确切效果。近年来,有报道提出利用间充质干细胞移植来取代受损及坏死组织,其在恢复肌腱功能方面有着较大优势[19]。但目前干细胞移植后在体内的增殖、分化情况大大限制了其在临床上的应用。
MicroRNA是一类在转录后水平调控基因表达的内源性非编码单链RNA。近年来多项研究显示其具有维持细胞干性和促进细胞自我更新等的生物学功能。miR-34a作为miR-34家族的一员,具有调控正常干细胞及肿瘤干细胞增殖、分化和凋亡等作用[20-22]。本研究通过过表达和抑制miRNA-34a表达,检测其对体外hADSCs细胞活力的影响,结果表明miR-34a过表达抑制hADSCs细胞活力,反之,抑制miR-34a表达促进hADSCs细胞活力。Park等[15]研究发现,miR-34a可通过抑制细胞周期相关蛋白抑制人脂肪干细胞增殖。同时还可抑制脂肪干细胞的成骨分化和成脂分化能力。与此研究结果类似,Chen等[23]发现,miR-34a还可通过抑制cyclin D1和CDK6等蛋白表达抑制人间充质干细胞增殖,并通过调控Jag1/Notch通路抑制人间充质干细胞向成骨细胞分化。但也有研究发现,miR-34a通过调节RBP2/Notch1/cyclin D1共调控网络促进人脂肪干细胞的成骨分化[14]。这些研究表明,在不同的细胞类型或培养条件下,以及靶向调节细胞分化中不同基因的转录水平,miR-34a可能发挥完全不同,甚至截然相反的作用。

Figure 4.The mRNA and protein levels of collagen I, Scx and TNC. Mean±SD.n=6.**P<0.01vsPBS group;##P<0.01vshADSCs+NC group.
图4CollagenI、Scx和TNC的mRNA及蛋白表达水平
过去,常采用骨髓间充质干细胞移植治疗跟腱炎,但这样不仅会给捐赠者带来生理上的疼痛,而且干细胞的获得率也相对较低[24]。本研究采用脂肪来源的干细胞,不仅取材容易,分离率也能大大提高。为探究miR-34a对在体脂肪干细胞移植治疗受损跟腱组织的影响,本研究将过表达和低表达miR-34a 的hADSCs移植入跟腱炎模型大鼠体内,并检测其生物力学各项指标,结果表明miR-34a过表达组大鼠各项指标(硬度、压力和最大负荷拉力)均显著降低,相反,miR-34抑制表达组各项指标均显著升高,因此抑制miR-34a表达可以促进跟腱炎大鼠的跟腱机能修复。
本文进一步在分子水平上探讨了miR-34a对脂肪干细胞的成肌腱分化能力的影响。在治疗跟腱炎时,移植脂肪干细胞,诱导分化为成肌腱细胞,后者高表达成肌腱相关标志物,主要包括collagen I、 Scx以及TNC等,其中,collagen I是成熟肌腱的主要成分[25];Scx能特异性地标记肌腱及原肌腱细胞,是肌腱细胞发育早期的特异标志物[26];TNC在体内主要存在于肌腱组织中,使肌腱组织能够承受一定的应力,从而实现相应的生物学功能[27]。我们的研究结果显示,miR-34过表达可下调这些因子的表达;相反,抑制miR-34a表达则上调这些因子的表达。在脂肪干细胞移植治疗跟腱炎时,抑制miR-34a表达可以促进肌腱分化从而有助于修复受损肌腱组织。
综上所述,抑制miR-34a表达在体外能促进hADSCs的活力,在体内移植抑制miR-34a表达的hADSCs可促进成肌腱分化从而利于跟腱炎大鼠受损跟腱的修复。本研究为脂肪干细胞移植治疗跟腱炎提供了新的研究靶点。

