黄芪多糖对颈椎病模型大鼠颈椎间盘纤维环MMP2和MMP9表达的影响*
杨 彬, 黄俊卿, 张继伟
(河南省中医院骨病二科,河南 郑州 450000)
椎间盘退变性疾病是骨科常见疾病,包括颈椎病和腰椎间盘突出症等,其发生和进展是一个多因素的复杂过程,目前对疾病发病机理和特异性治疗药物的研究仍十分缺乏。在椎间盘退变过程伴随几个连续事件,包括细胞凋亡的增加、细胞外基质降解和生物力学的改变[1],其中,椎间盘组织中细胞外基质成分降解是椎间盘退变的主要表现,在椎间盘基质降解中发挥主要作用的基质金属蛋白酶(matrix metalloproteinases,MMPs)在椎间盘退变疾病中起重要作用[2]。已有研究证实,椎间盘中MMPs表达异常是椎间盘退变的重要原因之一[3]。因此,针对MMPs与椎间盘退变性疾病的相关性研究成为颈椎病和腰椎间盘突出预防及干预治疗的热点。黄芪多糖(astragalus polysaccharides,AP)是从中药黄芪根中提取的大分子活性成分,在免疫调节中的作用得到广泛研究。近来研究发现,黄芪多糖能通过调节MMPs水平在关节炎、肺疾病和神经损伤等多种类型的疾病中起作用。为探究黄芪多糖对椎间盘退变性疾病的作用,本研究通过建立颈椎病大鼠模型,研究黄芪多糖对颈椎间盘纤维环组织中MMP2和MMP9的影响,以期为椎间盘退变性疾病的干预治疗提供新的治疗方案。
材 料 和 方 法
1 实验动物
SPF级成年雄性SD大鼠40只,购自北京生命科学研究所,许可证号为SYXK(京)2015-0002,体重280~320 g,8~10周龄。
2 药品和试剂
黄芪多糖标准品(CAS号:76296-72-5,纯度99.9%)购自青岛捷世康生物科技有限公司。总RNA提取试剂盒(批号PA115-03)购自北京天根生化科技有限公司;IP细胞裂解液(货号P0013)购自碧云天生物技术研究所; PCR引物购自上海生工生物工程有限公司;水合氯醛(货号47335)及抗MMP2(货号SAB2108458)、MMP9(货号HPA001238)、金属蛋白酶组织抑制物2(tissue inhibitor of metalloproteinase 2, TIMP2)(货号SAB4502972)和Ⅳ型胶原(collagen Ⅳ,货号C7999)抗体购自Sigma-Aldrich;蛋白预染Marker(批号SM1811)购自Fermentas;胎牛血清(批号1502284)购自Gibco。
3 实验仪器
VD-650型超净工作台购自苏州净化设备厂;HeracellTMVIOS型CO2培养箱购自Thermo;BX51型光学显微镜购自Olympus;Finesse 325型石蜡切片机购自Shando;7500型Real-time PCR检测仪购自ABI;1658001型电泳仪购自Bio-Rad。
4 实验方法
4.1动物造模 随机选取14只SD大鼠作为假手术组,其余26只SD大鼠,参考黄萍萍等[4]的方法建立动静力失衡性颈椎间盘退变大鼠模型。大鼠仰卧固定于手术台上,腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉后,于大鼠颈背部正中纵向切口2 cm,暴露颈部肌肉层后,切断浅肌群、深群颈夹肌、头颈寰最长肌,切除颈髂肋肌、头半棘肌、C2-C7棘上和棘间韧带后,逐层缝合。术后正常饲养3个月。假手术组仅切开皮肤和皮下组织。
4.2模型评价 造模1个月后,随机选取假手术组和模型组大鼠各4只进行放射影像学鉴定造模成功与否。
4.3动物分组及药物干预 造模1个月后,取18只造模成功的大鼠随机分为模型(model, M)组、低剂量黄芪多糖处理(low-dose AP, L-AP)组和高剂量黄芪多糖处理(high-dose AP, H-AP)组,每组6只;另取假手术组大鼠6只作为阴性对照(negative control, NC)组。低剂量和高剂量黄芪多糖处理组分别给予腹腔注射黄芪多糖10 mg/kg和30 mg/kg[5],每天1次,连续给药14 d;M组和NC组腹腔注射生理盐水。
4.4标本采集及处理 在给药结束后,腹腔注射过量水合氯醛处死后,沿颈椎上、下软骨终板与椎体交界面完整取下C4~C5颈椎间盘组织,一部分纤维环组织置于-80 ℃保存,用于Western blot检测;另一部分纤维环组织经PBS洗涤后,于4%多聚甲醛中固定、脱钙、脱水、透明、浸蜡及包埋,行组织学检查和免疫组织化学分析。
4.5组织学观察 椎间盘组织于4%多聚甲醛固定、脱钙、脱水、透明、浸蜡及包埋后,用切片机(Microm International GmbH)连续切片(6 μm),用HE染色和藏红(Safranin) O染色后,于显微镜下观察组织学变化,并进行定性分析。
4.6免疫组织化学检测 将纤维环组织蜡块(4 μm)二甲苯脱蜡、梯度乙醇水合后,于0.01 mol/L柠檬酸钠(pH 6.0)中孵育20 min,3%过氧化氢中孵育10 min,10%正常山羊血清中孵育30 min,将切片与NLRP3的 I 抗于4 ℃孵育过夜,以PBS孵育的切片作为阴性对照。于室温下,将切片与碱性磷酸酶偶联的山羊抗兔IgG孵育1 h。PBS洗涤3后,加入100 μL DAB溶液,于显微镜下观察。自来水冲洗后,苏木精复染,氨水反蓝后用自来水冲洗。切片于乙醇中脱水并于二甲苯中透明。蛋白表达定位于纤维环细胞的细胞质,染色后阳性表达呈深棕色或棕黄色颗粒。
4.7纤维环细胞原代培养及处理 分别在各组随机抽取大鼠2只,脊椎脱臼处死后,于无菌条件下取出椎间盘,于显微镜下剥除凝胶状髓核组织,取得纤维环组织后,置于含PBS的培养皿中剪碎为1 mm×1 mm×1 mm的组织块后,加入5 mL 0.2%胶原酶消化1 h后,1 400 r/min离心5 min后弃上清。加入2 mL 0.2%胰蛋白酶消化5 min后,再次离心弃上清。PBS洗涤后,弃PBS,收集原代细胞,接种至含10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素的DMEM培养液的96孔板中,于37 ℃、5% CO2培养箱中孵育。于倒置显微镜下观察其生长情况。
4.8细胞-胶原黏附实验 培养24 h后,取贴壁细胞,用0.2%胰蛋白酶消化后,以1×104个接种至经胶原蛋白包被的36孔板中,每组6孔,37 ℃孵育1 h。PBS洗涤后,黏附细胞用0.5%甲苯胺蓝染色后,于4%多聚甲醛中固定15 min,加入1%十二烷基磺酸钠中溶解。于590 nm波长下读取吸光度(A)值。
4.9RT-qPCR实验 使用Ultrapure RNA试剂盒从组织及细胞中提取总RNA,并使用HiFi-MMLV cDNA试剂盒将其逆转录成第一链cDNA,用SYBR Green试剂盒和Applied Biosystems 7500快速实时PCR系统进行实时PCR反应。以β-actin作为内参照,用2-ΔΔCt法计算mRNA相对表达水平。反应条件为95 ℃ 30 s、95 ℃ 15 s、72 ℃ 15 s,共进行40个循环。引物序列见表1。

表1 RT-qPCR引物序列
4.10Western blot实验 使用PMSF裂解组织和细胞,根据蛋白质提取试剂盒制造商说明书提取总蛋白。使用BCA蛋白质测定试剂盒测定蛋白浓度。将蛋白质行12%SDS-PAGE分离并转移到聚偏二氟乙烯膜上。将I抗[MMP2、MMP9、TIMP2、collagen Ⅳ(1∶500)和内参照β-actin(1∶200)]与膜一起于4 ℃孵育过夜。将膜用HRP缀合的 II 抗于室温下孵育1 h。使用Quantity One软件评估相对蛋白表达水平。
5 统计学分析
采用SPSS 20.0进行统计分析。计量资料采用均数±标准差(mean±SD)表示,组间比较采用F检验或t检验。以P<0.05表示差异有统计学意义。
结 果
1 椎间盘退变模型大鼠放射影像学的鉴定
假手术组大鼠X线片正常,未见椎间隙狭窄、骨质增生和颈椎曲度变直等颈椎退变等情况,见图1A、B;模型组大鼠X线片可见椎间隙狭窄、曲度变直,椎体边缘观察到骨赘形成,关节突关节出现增生硬化等颈椎退变,见图1C、D。
2 椎间盘退变模型大鼠组织学检查
2.1HE染色结果 NC组大鼠颈椎椎间盘高度正常,纤维环表现为正常纤维软骨层组织,软骨细胞排列整齐,分布较多,细胞呈椭圆形;M组大鼠椎间盘高度明显下降,出现椎间盘退变,髓核塌陷,纤维环纤维软骨层组织减少,纤维环组织发生破裂、胶原纤维呈波浪排列;L-AP和H-AP组大鼠髓核和纤维环组织间界限逐渐清晰,纤维环组织中纤维排列显示出较少破裂和紊乱,椎间盘退行性变化有所减轻,见图2。
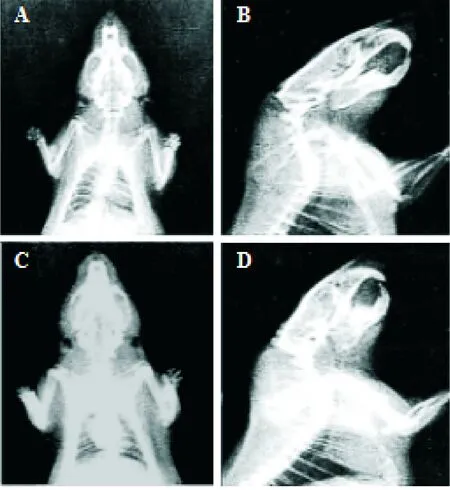
Figure 1.Radiographic changes in rats with disc degeneration. A: spine front view in NC group; B: spine side view in NC group; C: spine front view in M group; D: spine side view in M group.
图1椎间盘退变模型大鼠放射影像学变化

Figure 2.The histological observation of rat cervial intervertebral discs by HE staining.
图2各组大鼠颈椎间盘HE染色结果
2.2Safranin O染色结果 对照组软骨终板(cartilaginous endplate, CEP)经Safranin O染色后呈红色,提示CEP主要由细胞外基质组成;M组椎间盘中红色区域明显减少,提示蛋白多糖含量减少,细胞外基质发生降解; L-AP组和H-AP组红色区域逐渐增加,细胞外基质降解改善,见图3。
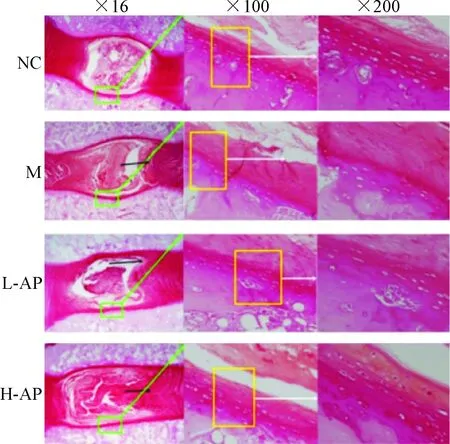
Figure 3.The histological observation of rat cervical intervertebral discs by Safranin O staining.
图3大鼠颈椎间盘藏红O染色结果
3 纤维环组织中MMP2、MMP9、TIMP2和collagen Ⅳ蛋白的免疫组织化学观察
各组大鼠颈椎间盘纤维环细胞中MMP2、MMP9、TIMP2和collagen Ⅳ蛋白的阳性表达主要定位于胞浆内,呈深棕色为强阳性表达,浅棕黄色为弱阳性表达,无着色为阴性表达。NC组中,MMP2和MMP9阳性细胞少,散在分布,为弱阳性或阴性表达;M组中MMP2和MMP9阳性细胞数显著增加,分布密集,着色深,呈强阳性表达;L-AP组和H-AP组MMP2和MMP9阳性表达细胞数逐渐减少。NC组和M组中TIMP2呈强阳性表达,L-AP组和H-AP组TIMP2阳性表达数逐渐增加,分布密集,呈强阳性表达。NC组collagen Ⅳ呈强阳性表达,分布密集,M组collagen Ⅳ阳性表达细胞数显著降低,散在分布,呈弱阳性表达,而L-AP组和H-AP组TIMP2阳性表达数逐渐增加,呈强阳性表达,见图4。
4 Western blot检测纤维环组织中MMP2、MMP9、TIMP2和collagen Ⅳ蛋白的表达
与NC组相比,M组大鼠纤维环组织中MMP2和MMP9蛋白表达水平显著增加,而TIMP2和collagenⅣ蛋白表达水平均显著降低(P<0.05);与M组相比,L-AP组和H-AP组MMP2和MMP9蛋白表达水平显著降低,而TIMP2和collagen Ⅳ蛋白表达水平均显著增加(P<0.05),见图5、表2。
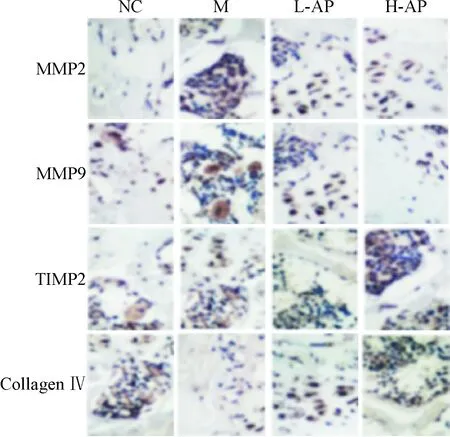
Figure 4.The protein expression of MMP2, MMP9, TIMP2 and collagen Ⅳ in fibrous ring tissues detected by immunohistochemistry (×400).
图4免疫组化染色检测各组大鼠纤维环组织中MMP2、MMP9、TIMP2和collagenⅣ蛋白表达
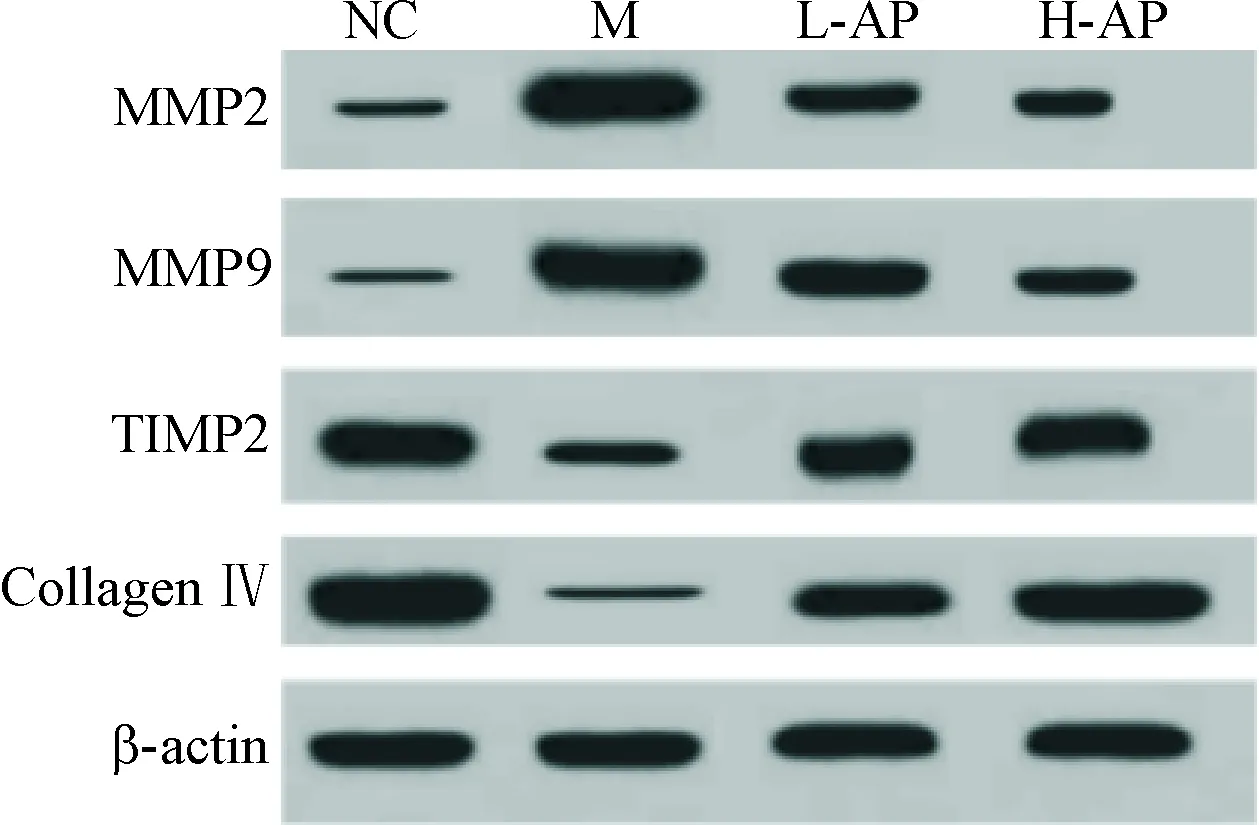
Figure 5.The protein expression of MMP2, MMP9, TIMP2 and collagen Ⅳ in fibrous ring tissues detected by Western blot.
图5Westernblot法检测纤维环组织MMP2、MMP9、TIMP2和collagenⅣ的蛋白表达
表2MMP2、MMP9、TIMP2和collagenⅣ蛋白相对表达水平的变化
Table 2.Changes of relative expression levels of MMP2, MMP9, TIMP2 and collagen IV proteins in fibrous ring tissues of rats (Mean±SD.n=6)

GroupMMP2MMP9TIMP2Collagen ⅣNC 1.001.001.001.00M3.56±0.09*3.63±0.11*0.34±0.03*0.09±0.01*L-AP2.31±0.05*#2.84±0.08*#0.56±0.05*#0.52±0.06*#H-AP1.06±0.04*#△1.57±0.06*#△0.86±0.04*#△0.88±0.04*#△
*P<0.05vsNC group;#P<0.05vsM group;△P<0.05vsL-AP group.
5 纤维环组织中MMP2、MMP9、TIMP2和collagen Ⅳ的mRNA表达水平
与NC组相比,M组大鼠纤维环组织中MMP2和MMP9的mRNA表达水平显著增加,而TIMP2和collagen Ⅳ的mRNA表达水平均显著降低(P<0.05);与M组相比,L-AP组和H-AP组MMP2和MMP9的mRNA表达水平显著降低,而TIMP2和collagen Ⅳ的mRNA表达水平均显著增加(P<0.05),见表3。
表3各组大鼠纤维环组织中MMP2、MMP9、TIMP2、collagenⅣmRNA相对表达水平
Table 3.Changes of relative expression levels of MMP2, MMP9, TIMP2 and collagen IV mRNA in fibrous ring tissues of rats (Mean±SD.n=6)

GroupMMP2/β-actinMMP9/β-actinTIMP2/β-actinCollagen Ⅳ/β-actinNC0.94±0.031.06±0.041.24±0.061.31±0.08M2.06±0.04*2.21±0.05*0.51±0.03*0.62±0.05*L-AP1.26±0.04*#1.34±0.03*#0.82±0.04*#0.92±0.04*#H-AP1.03±0.03*#△1.15±0.03*#△1.13±0.05*#△1.16±0.06*#△
*P<0.05vsNC group;#P<0.05vsM group;△P<0.05vsL-AP group.
6 黄芪多糖对大鼠纤维环细胞生长的影响
倒置显微镜下观察,NC组大鼠原代纤维环细胞培养24 h后,细胞贴壁,呈纺锤体或星形细胞生长; M组大鼠的原代纤维环细胞培养24 h后,细胞出现皱缩,并形成空泡;而L-AP组和H-AP组细胞皱缩、空泡形成等征象均有所改善,见图6。

Figure 6.Effect of astragalus polysaccharides on the growth of rat annulus fibrosus (×100).
图6黄芪多糖对大鼠纤维环细胞生长的影响
7 黄芪多糖对纤维环细胞-胶原黏附的影响
M组A值显著低于NC组(P<0.05);与M组相比,L-AP组和H-AP组A值均显著上升(P<0.05),见图7。
8 纤维环细胞中MMP2、MMP9、TIMP2和collagen Ⅳ的mRNA表达水平
与NC组相比,M组纤维环细胞中MMP2、MMP9的mRNA表达水平显著增加,而TIMP2和collagen Ⅳ的mRNA表达水平均显著降低(P<0.05);与M组相比,L-AP组和H-AP组MMP2和MMP9的mRNA表达水平显著降低,而TIMP2和collagen Ⅳ的mRNA表达水平均显著增加(P<0.05),见表4。
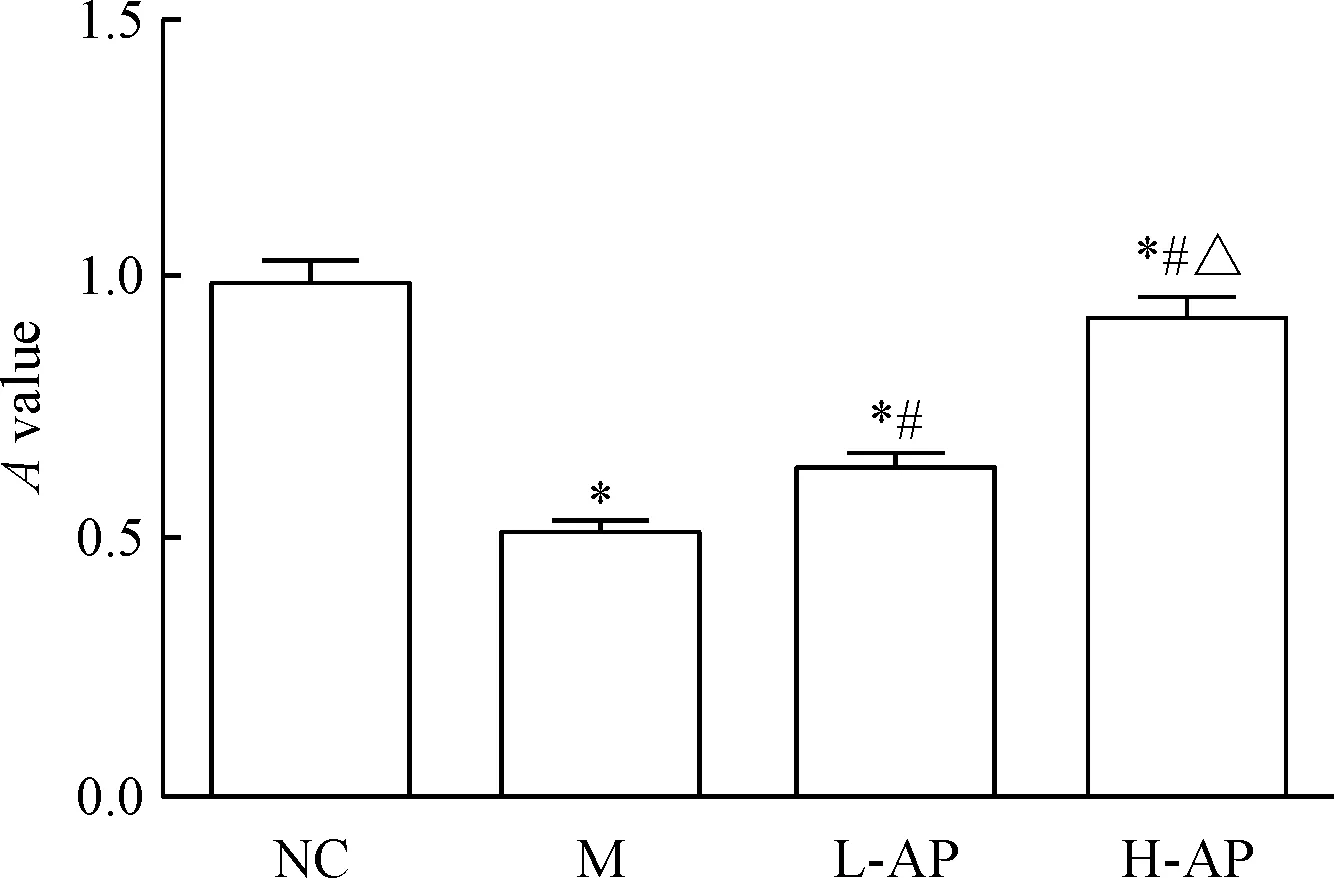
Figure 7.The results of cell-collagen adhesion test. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsM group;△P<0.05vsL-AP group.
图7细胞-胶原黏附实验结果
表4纤维环细胞中MMP2、MMP9、TIMP2和collagenⅣmRNA相对表达水平
Table 4.The relative expression of MMP2, MMP9, TIMP2 and collagen IV mRNA in rat annulus fibrosus cells (Mean±SD.n=3)

GroupMMP2/β-actinMMP9/β-actinTIMP2/β-actinCollagen Ⅳ/β-actinNC1.01±0.021.12±0.061.34±0.081.26±0.05M2.13±0.09*2.34±0.10*0.42±0.04*0.30±0.04* L-AP1.46±0.08*#1.63±0.09*#0.78±0.05*#0.81±0.06*# H-AP1.13±0.05*#△1.30±0.05*#△1.04±0.09*#△1.09±0.07*#△
*P<0.05vsNC group;#P<0.05vsM group;△P<0.05vsL-AP group.
9 纤维环细胞中MMP2、MMP9、TIMP2和collagen Ⅳ的蛋白表达水平
与NC组相比,M组纤维环细胞中MMP2和MMP9蛋白表达水平显著增加,而TIMP2和collagen Ⅳ表达水平均显著降低(P<0.05);与M组相比,L-AP组和H-AP组MMP2和MMP9的蛋白表达水平显著降低,而TIMP2和collagen Ⅳ的蛋白表达水平均显著增加(P<0.05),见图8、表5。
讨 论
椎间盘退变是颈椎病、腰椎间盘突出和腰背部疼痛的重要原因之一。临床上治疗颈椎病的金标准是实行颈椎间盘切除移植骨融合术,然而因其存在严重并发症等问题令颈椎病患者不愿接受手术。药物治疗在一定程度上安全性较高,但在寻找有效治疗药物时,透彻分析疾病发生及药物作用机制非常重要,因此需要建立椎间盘退变的动物模型。本研究采用黄萍萍等[4]的方法,采用颈椎动静力失衡法建立的大鼠模型,是通过长时间诱导所建立,与人类长期低头工作所致颈椎间盘病变相似度很高,另外大鼠价格较低,制备周期短,因此是一种很好的动物模型。本研究发现,模型组纤可见椎间隙狭窄、曲度变直,椎体边缘观察到骨赘形成,关节突关节出现增生硬化等颈椎退变等情况,证实模型制备成功。
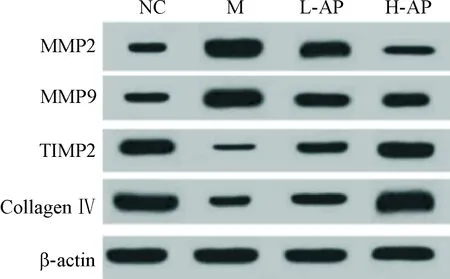
Figure 8.The protein expression of MMP2, MMP9, TIMP2, collagen Ⅳ in the annulus fibrosis cells deteced by Western blot.
图8Westernblot法检测纤维环细胞MMP2、MMP9、TIMP2和collagenⅣ蛋白表达
表5纤维环细胞中MMP2、MMP9、TIMP2和collagenⅣ蛋白表达水平
Table 5.The relative expression of MMP2, MMP9, TIMP2 and collagen IV protein in rat annulus fibrosus cells (Mean±SD.n=3)

GroupMMP2MMP9TIMP2Collagen ⅣNC1.001.001.001.00 M3.82±0.12*3.57±0.09*0.13±0.01*0.20±0.02* L-AP2.19±0.08*#2.07±0.06*#0.61±0.04*#0.59±0.03*# H-AP1.13±0.04*#△1.09±0.06*#△1.03±0.06#△1.02±0.05#△
*P<0.05vsNC group;#P<0.05vsM group;△P<0.05vsL-AP group.
椎间盘退变的特征在于生物化学成分和机械完整性发生变化,椎间盘的主要成分是细胞外基质,其中富含胶原和蛋白多糖,是维持脊柱生理、机械稳定和运动性的基础[6]。细胞外基质中糖胺聚糖含量降低、细胞外基质合成与降解平衡失调、变性胶原蛋白含量的增加均会引起椎间盘退变[7]。基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)是MMPs特异性的内源性抑制因子,二者共同调控细胞外基质动态平衡,在椎间盘退变过程中发挥重要作用。研究表明,椎间盘细胞内MMPs表达的增加是椎间盘退变的诱因之一[8]。在老化和退化的椎间盘中,MMPs表达异常使细胞外基质成分,如纤维胶原蛋白、明胶、蛋白聚糖、纤边蛋白和层黏连蛋白等降解[9]。 过往研究发现,在病变椎间盘的纤维环细胞中MMP2表达水平升高[10-11],与此一致,本研究中模型大鼠颈椎间盘纤维环组织中MMP2和MMP9表达显著增加。另外,本研究中发现,颈椎病大鼠纤维环组织中TIMP2表达水平无明显变化,而collagen Ⅳ表达水平显著降低。薛恩兴等[12]发现,正常椎间盘髓核细胞中MMP1和MMP13表达较低,而在椎间盘退变过程中MMP2表达增加,导致MMPs-TIMPs平衡被破坏。Zhang等[13]发现,在退变椎间盘髓核组织中MMP2高表达,且其表达情况与疾病严重程度相关,提示MMP2参与椎间盘退变过程。另外,collagen Ⅳ是MMP2和MMP9主要水解底物之一[14]。因此推测,颈椎病大鼠颈椎间盘纤维环组织中MMP2和MMP9表达水平增加,TIMP2表达水平降低,导致细胞外基质合成和降解平衡失调及功能改变,引起细胞外基质中胶原和蛋白聚糖降解,从而破坏纤维环结构,最终导致椎间盘退变。
黄芪多糖是中药黄芪的主要有效成分,对机体免疫功能有广泛的调节作用,且具有抗肿瘤、抗氧化、降血糖和降血脂等多种功能[15-17]。近来研究表明,黄芪多糖可通过抑制肺组织中MMPs及其调节因子TIMPs的水平,来调控肺组织中细胞外基质合成代谢和降解代谢的平衡,从而改善呼吸道重构和肺纤维化程度[18-19]。张正军等[19]发现,黄芪多糖能够抑制糖尿病患者足部溃疡成纤细胞内IL-1β引起的MMP2和MMP9活性的显著增加。在大鼠骨关节炎中,黄芪多糖可通过抑制关节软骨中MMP3的表达,调节软骨细胞外基质中蛋白多糖的降解,促进关节软骨中GAG的合成[20]。这些研究表明,黄芪多糖可通过调控细胞外基质中MMPs的活性在多种疾病中起积极作用。然而在椎间盘退变中黄芪多糖的作用及对MMPs影响的研究尚未见报道。本研究组织学分析发现黄芪多糖能够改善椎间盘纤维环组织细胞外基质降解,从而改善椎间盘退变情况。进一步分析发现,经黄芪多糖以剂量依赖性的方式降低颈椎病大鼠纤维环组织内MMP2和MMP9表达水平,且增加TIMP2表达水平。另外,随着黄芪多糖剂量的增加,组织中collagen Ⅳ的含量逐渐增加。结合过往研究推测,在颈椎病大鼠中,黄芪多糖通过增加TIMPs表达来抑制MMPs表达水平的增加,使细胞外基质中MMPs与TIMPs表达维持动态平衡,从而抑制MMPs对椎间盘基质中胶原和蛋白多糖的降解。
本研究进一步从细胞水平上评估黄芪多糖对颈椎病模型大鼠纤维环细胞的影响。倒置显微镜下观察到颈椎病模型大鼠纤维环细胞呈现皱缩、空泡现象,而黄芪多糖处理能够改善这一现象。另外,椎间盘模型大鼠纤维环细胞-胶原黏附能力明显下降,而黄芪多糖能够改善细胞-胶原黏附能力,且随着黄芪多糖浓度的增加,细胞-胶原黏附能力逐渐增加。进一步分析发现,黄芪多糖处理能够使颈椎病模型大鼠纤维环细胞内MMP2和MMP9表达水平上升,同时使TIMP2和collagen Ⅳ表达水平降低。进一步证实,黄芪多糖可以通过调节纤维环细胞内MMPs与TIMPs的表达,参与基质重塑过程,从而避免细胞外基质破坏,改善纤维环细胞与胶原的结合能力。
然而,在椎间盘退变过程中涉及到多种MMPs的共同作用,黄芪多糖在调节细胞外基质合成、降解平衡中具体机制还有待深入探究;其次,本研究选择大鼠原代纤维环细胞,且细胞为单层融合,可能影响结果,且不能完全代表人纤维环细胞。另外,由于经费、技术等限制,本研究仅涉及黄芪多糖对MMP、TIMP2和collagen Ⅳ在大鼠纤维环细胞中表达的影响,未对机制进行经深入研究,因此将在后续研究进一步验证。
综上所述,黄芪多糖能够抑制颈椎病模型大鼠纤维环组织中MMP2和MMP9表达水平,调节细胞外基质中MMPs与TIMPs 动态平衡,从而抑制MMPs对椎间盘基质中相关胶原的降解,在椎间盘退变的治疗中具有潜在研究价值。

