经侧裂-岛叶皮层入路基底节区脑出血清除术
张尚明 聂群 王守森
一、背景介绍
基底节区脑出血是最常见的高血压脑出血,是高血压的严重并发症之一。出血往往为突发,起病急,可在几分钟到数小时内发展到高峰,损害基底节区核团及内囊系统,导致“三偏”症状发生。目前基于其病理生理机制,即血肿对周围脑组织的机械压迫和继发的毒性作用,认为早期手术可以解除占位效应并在后期减轻周围组织的毒性反应,手术清除血肿有利于患者康复。
目前对于手术时机及方式仍存在部分争议。据统计,高血压脑出血一般在发病后20~30 min内形成血肿,约62%的患者2 h后不再出血,大部分病例6 h后将不再出血。有研究表明发病4 h内手术治疗再出血率明显增高,发病后24、48、72 h手术的相关研究显示临床预后均未得到改善,因此多数学者认为发病后6~24 h为最佳手术时间窗。国内外对于基底节区脑出血的治疗呈多样化,尚无统一标准,包括常规颞瓣开颅血肿清除、显微镜下小骨窗锁孔血肿清除、神经内镜辅助血肿清除、影像引导下血肿穿刺引流等。随着显微神经外科和微创理念的发展,常规颞瓣开颅血肿清除似乎越来越没有优势,但对于术前脑疝时间较长、预估术后脑肿胀严重需去骨瓣减压的患者仍适用;显微镜下小骨窗锁孔血肿清除术缩短了开颅时间,以最短路径到达血肿并减少脑组织牵拉和脑血管损伤,血肿清除率高,对于非脑疝型出血有较大优势;神经内镜辅助下血肿清除术仅需小骨窗或骨孔,直视下清除血肿,时间短,对正常脑组织损伤小,近年来愈受追捧,然而其存在内镜手术通道局限、深部止血困难等不足,基层医院无法广泛开展;影像引导下血肿穿刺引流术,如立体定向、神经导航等,创伤小、可局麻、利用纤溶酶清除率高,其应用逐渐增多,但由于在不能直视下有效止血、减压慢、穿刺偏移等缺点在推广上也受到一定限制。
目前对于经皮层进入血肿的路径分为经颞叶皮层入路和经侧裂-岛叶入路。经颞中回皮层造瘘,开颅后无明确解剖标志,容易迷路而无法找到血肿甚至造成新的创伤,且对于位置相对较高的血肿,颞中回皮层造瘘口往往在血肿底部,容易遗漏脑组织塌陷后上方的血肿。经侧裂入路通过脑自然缝隙进入血肿腔,切开岛叶皮层仅0.5~1.0 cm,路径最短,有利于周围小穿支血管的保护,可最大限度地减少脑组织牵拉损伤,避免优势半球语言中枢的破坏。然而,经侧裂入路要求显微操作技术过硬,必须要熟练地解剖侧裂并保护静脉和大脑中动脉及其分支,对于初学者来说无形中增加了风险。
二、手术指征及术式
血肿清除手术指征:中、重度高血压脑出血,意识障碍呈嗜睡、昏迷或进行性加重,头颅CT提示出血量>25 mL;年龄不应作为考虑手术的因素;发病后血压难以控制或≥200/120 mmHg(1 mmHg=0.133 kPa)、眼底出血、曾有心肺肾等严重疾患者为手术禁忌。
侧裂-岛叶入路术式:对于血肿位于基底节区前部(与侧裂池距离较近)或优势侧出血,为保护语言功能区者可选择侧裂-岛叶皮层入路;根据标志标线定位侧裂投影后,结合发迹边缘做直切口或弧形切口,初学者或侧裂难以定位时可考虑标准翼点入路的额颞弧形切口,有利于侧裂的暴露。
二、手术要求
小骨窗锁孔有利于快速开颅、减少失血,但不宜为追求微侵袭而采用锁孔(微侵袭并不等同于微创),应根据是否脑疝及预计术后水肿情况采取大骨瓣或锁孔血肿清除术,必要时还应去除骨瓣,减少临床并发症。术中仔细辨识侧裂池解剖结构、规范微创理念,避免人为损伤侧裂静脉和大脑中动脉及其分支。吸除血肿要缓慢轻柔,减少或避免使用脑压板牵拉,以避免对基底核团、内囊内壁造成进一步损害。
三、手术步骤
1.体位及切口:患者取仰卧位,全麻,头部抬高约15°,以侧裂投影为标志设计切口,从颧弓上1 cm向上沿发迹做长约6 cm直切口或弧形切口。
2.开颅:切开皮肤、帽状腱膜、颞肌筋膜,使用剥离子剥离骨膜,向前方关键孔方向剥离有利于侧裂近端暴露;撑开骨瓣后,在骨瓣上方钻孔一枚(用于通过引流管),铣开一直径3 cm骨窗,必要时磨除部分蝶骨棘增加侧裂内侧暴露;硬膜外悬吊后,“X”型剪开硬脑膜,将硬脑膜翻转后固定。
3.解剖侧裂池,暴露岛叶皮层:在显微镜下首先由侧裂池远端解剖,使用显微解剖镊和剪刀有利于侧裂池解剖。侧裂在前端较宽,颞上回构成岛盖部,为辨认清楚需在显微镜下操作;首先开放侧裂池蛛网膜约0.5 cm切口后,由侧裂池底部至表浅面向两侧剪开蛛网膜的方式使解剖侧裂池更为容易(剥橘皮式分离),相应额颞叶沟通静脉有时会遮挡,可予以电凝后切断,必须保护两侧的侧裂大静脉结构,可使用明胶海绵、棉片;在大脑中动脉的上方或下方分离蛛网膜2~3 cm,侧裂池近端靠颅底处可不予解剖,以牵拉额颞叶可暴露岛叶为适,注意勿损伤侧裂血管;用脑压板将脑组织分开(视频中使用棉片推开可减少牵拉损伤),显露出岛叶,在岛叶表面可看到大脑中动脉的分支,稍稍分离后即见岛叶皮层结构,中动脉分支使用明胶海绵覆盖保护,以免误伤。
4.切开岛叶皮层,清除血肿:将两侧侧裂静脉及大脑中动脉分支保护后,在岛叶皮层切开约1.0~1.5 cm,深约0.5~1.0 cm处即可见血肿涌出,不确定时可先用脑穿针向深部穿刺,证实为陈旧性血液后再将岛叶切开;用较窄的脑压板牵开岛叶皮层以暴露血肿,使用中号吸引器及双级电凝镊逐步向血肿深部吸除血肿,采用间断堵塞吸引器侧孔的方式增加吸引力度,吸出腔内血肿,部分血肿可与内壁黏连,用生理盐水轻柔的脉冲式冲洗内腔,以分离黏连,不可强行拖拽黏连的血块;血肿清除后可见基底节内壁呈灰白色,表示此处血肿已清除,通过调整显微镜方向并按次序清除血肿,以免脑组织塌陷后遗漏;如在血肿内部有包绕来自豆纹动脉的小分支出血,不易直接电凝止血,需在吸引器配合下将此血管断端吸出远离内壁,再使用弱电凝多次电凝以确保止血确切;部分在显微镜效果不理想时,可结合使用神经内镜进行操作。病灶清除结束后,提升血压至正常水平,恢复自主呼吸或提高二氧化碳分压至33~36 mmHg,观察10 min,无活动性出血。
5.放置引流管,逐层关颅:选择8号或10号硅胶引流管置入血肿腔内,以备术后纤溶酶溶栓使用;清点物品完整后,严密缝合硬脑膜,固定骨瓣,逐层缝合颞肌、筋膜、帽状腱膜及皮肤,锁孔入路时硬膜外和皮下可不予放置引流管。
四、手术体会及注意事项
1.对于血肿量大或脑疝形成,预计脑肿胀较重者,侧裂池难以解剖,颞中回皮层造瘘清除血肿可能更适宜。
2.将锁孔骨窗向前靠近蝶骨嵴,更容易暴露侧裂池中段,解剖侧裂池和使用脑压板牵拉时必须注意保护中动脉分支及侧裂静脉,过度牵拉可能造成不必要的损伤。
3.按次序清除血肿,并多次调整显微镜角度进行照明和清除血肿,通过吸引器间断堵塞侧孔的方式增压来吸除血肿,生理盐水脉冲式冲洗以断开血肿与内壁的黏连。
4.包绕在血肿内的出血小血管,利用吸引器将其吸离内壁,弱电凝多次电凝止血,切勿靠在内壁上电凝,造成新的出血和损伤;未出血的豆纹动脉分支,可使用薄层明胶海绵保护,保护的同时推移明胶海绵还利于其他位置血肿的暴露。
5.血肿大部分清除后,脑组织塌陷较为明显,术者注意力往往集中于血肿腔内,偶有出现桥静脉撕裂出血的情况发生,因此术中应多次向硬膜下冲洗生理盐水以使脑组织漂浮避免此类情况。
6.位置较深难以暴露或内壁上残留的小片血块可不勉强清除,腔内放置引流管,根据残余量使用纤溶酶溶栓治疗。
五、术后管理
强化降压措施(140/90 mmHg以下)可减少再出血的风险,保持呼吸道通畅可有效防止脑缺氧发生,对昏迷患者术后应早期行气管切开;同期治疗基础疾病,维持水、电解质平衡,控制脱水剂剂量,适量输注胶体,有效预防消化道出血、心功能不全及肾功能衰竭;术后动态复查头颅CT,尽早行肢体康复训练及高压氧治疗,促进神经功能康复。
六、病例资料
患者,男性,61岁,因“突发右侧肢体乏力,进而意识不清伴呕吐6h”入院。入院体检:BP:187/104mmHg,自主呼吸深慢,R12次/分,神志深昏迷,GCS评分5分(E1V2M2);瞳孔直径:左侧 3 mm,右侧 1.5 mm;对光反射均迟钝,双眼球无活动,无眼震,角膜反射存在,双侧额纹及鼻唇沟对称,口角无歪斜,右侧肢体肌张力稍增高,肌力检查不配合,右侧Babinski征(+),颈部稍抵抗,Kernig征(-)。入院后头颅CT检查提示:左侧基底节区血肿,左侧脑室受压变窄,中线结构向右侧移位。入院诊断:左侧基底节区脑出血;高血压病Ⅲ级,极高危。综合考虑以上因素,为挽救生命,急诊手术清除血肿减压指征明确,遂完善术前准备,进行手术,手术过程顺利,术中脑组织塌陷良好,予以复原骨瓣。详细信息见图1、2。术后患者神志转醒,经降颅压、营养神经及康复训练等治疗,患者右侧肢体肌力恢复至4级,可搀扶下行走,于术后1个月出院。

图1 患者术前术后CT影像资料
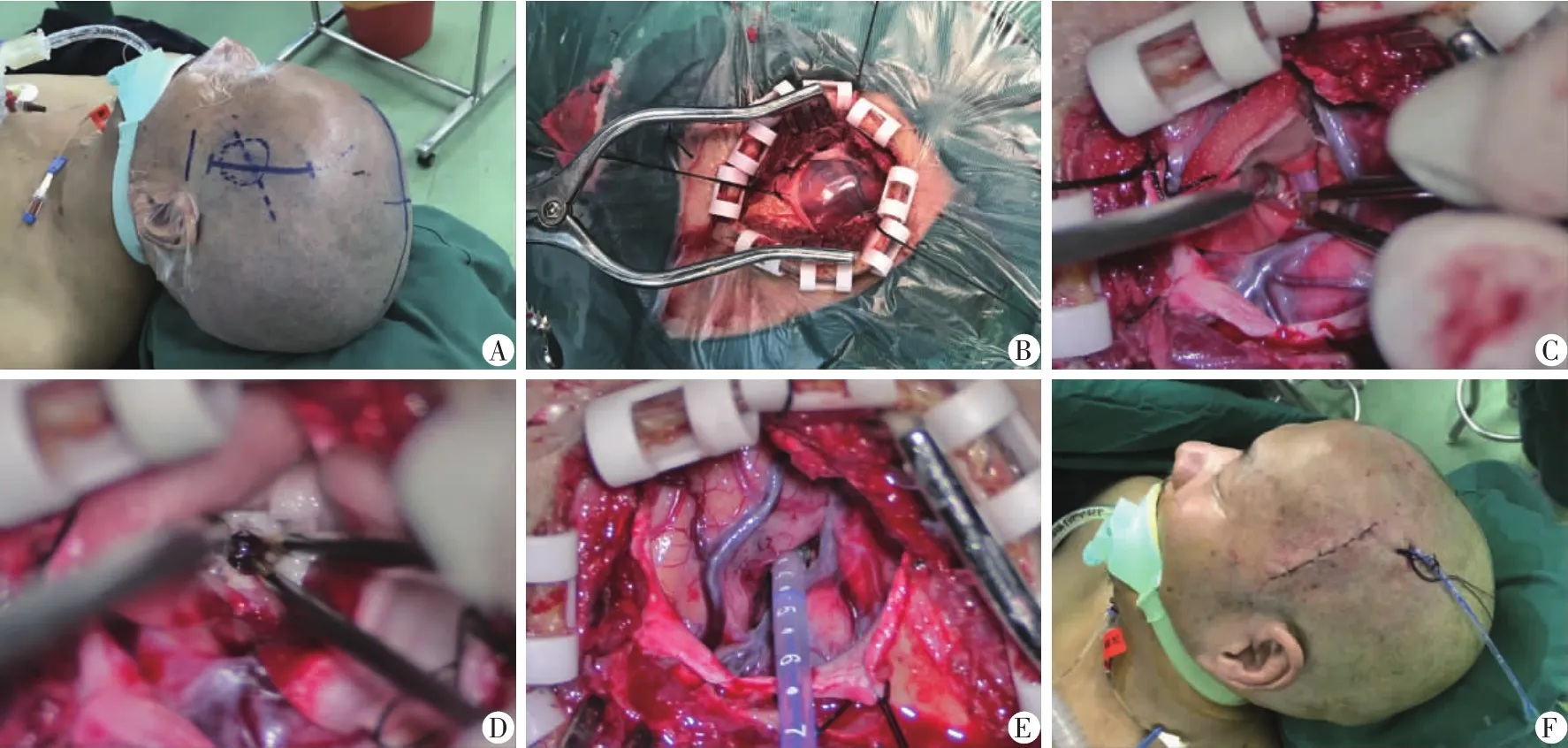
图2 侧裂-岛叶皮层入路基底节区脑出血清除术中影像资料

