3.0 T MRI在直肠神经内分泌肿瘤评估中的应用价值
林维文, 王莉莉, 段 青, 薛蕴菁, 郑宇辉, 官国先
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是一类起源于机体无处不在的神经内分泌细胞的异质性肿瘤,可发生于全身许多组织和器官。近年来,NEN发病率逐渐升高,已成为胃肠道肿瘤中发病率第2位的肿瘤[1-2]。直肠NEN症状无特异性,绝大多数无类癌综合征,临床早期诊断存在困难。纤维内镜及直肠内镜超声(endoscopic ultrasound,EUS)是直肠NEN术前诊断及分期的首要手段,MRI作为临床实用常规检查及直肠肿瘤术前诊断最主要的检查手段,是EUS的有力补充。本研究回顾性分析20例直肠NEN患者的临床病理资料及MRI影像学资料,并结合NEN的2010年WHO新分类分级系统进行讨论[3],旨在提高对MRI在直肠NEN应用价值的认识。
1 对象与方法
1.1对象 收集2011年10月—2015年12月笔者医院经肠镜活检或手术病理及免疫组织化学确诊为直肠NEN的病例20例,其中男性13例,女性7例,年龄(51.10±9.59)岁(37~67岁),体检发现7例,排便次数增多和(或)黏液血便11例,腹痛2例,无伴发类癌综合征患者。本研究符合医院医学伦理学要求。
1.2仪器与方法 采用SIEMENS 3.0 T Magnetom Trio Tim 超导型MR仪及体部阵列线圈,仰卧位。扫描序列包括:T2WI轴位、矢状位、冠状位及T1WI轴位,DWI及增强3D-VIBE。横断位T2WI-TSE序列:TR 3 900 ms/TE 80 ms,4次信号采集, FOV 250×380,层厚5 mm,层间距1 mm。DWI-EPI序列:TR 3 900 ms/TE 40.3 ms(b=50 s/mm2),TE 53.8 ms(b=400 s/mm2),TE 76.7 ms(b=800 s/mm2),层厚6 mm,层间距1 mm,3次信号采集。增强3D-VIBE序列:单个时相扫描时间17 s,TR 3.3 ms/TE 1.3 ms,FOV 250×380,层厚2 mm,层间距0 mm,脂肪抑制。使用Gd-DTPA对比剂,剂量0.1 mmol·L-1·kg-1,经肘静脉注射(速率2 mL/s)。
1.3病理及免疫组织化学方法 病理根据2010年WHO胃肠胰NEN新分级标准,按组织学分化程度(核分裂像计数)和(或)肿瘤增殖活性(Ki-67增殖指数)将肿瘤进行分级,两者不一致时采用分级高的标准,标准如下:(1)G1,低级别:核分裂像计数<2/10 HPF,Ki-67增殖指数≤2%;(2)G2,中级别:核分裂像计数2~20个/10 HPF,Ki-67增殖指数3%~20%;(3)G3,高级别:核分裂像计数>20个/10 HPF,Ki-67增殖指数>20%。免疫组织化学染色用突触素(synaptophysin,Syn)和嗜铬素A(chromogranin,CgA)确定是否含内分泌性质。根据2010年WHO直肠NEN病理TNM分期标准进行T分期:T1,肿瘤位于黏膜或黏膜下层,最大直径 ≤2 cm;T2,肿瘤侵犯固有肌层或直径>2 cm;T3,肿瘤侵犯直肠系膜;T4,肿瘤穿透腹膜或浸润其他器官。
1.4图像观察 在PACS工作站,由两名放射科医师共同对MRI图像进行阅片。当有不同意见时,通过讨论作出共识诊断。观察分析内容包括:(1)测量肿瘤边缘距离肛缘距离:0~5 cm界定为低位直肠肿瘤,5~10 cm为中位,10~15 cm为高位;(2)观察肿瘤大体形态并在增强3D-VIBE序列上测量肿瘤最大径。 参考直肠癌大体分型及过往研究者对直肠NEN大体形态的认识,将直肠NEN的大体形态分为3类:最大径≤2 cm的病变定义为结节型;最大径>2 cm的病变定义为肿块型,其中肿瘤主体由一侧肠壁向肠腔内突出为主者定义为隆起型肿块,肿瘤引起肠壁局部或广泛增厚为主的病变定义为浸润型肿块。(3)以正常臀大肌为参照,观察病变的T1WI、T2WI信号特征,测量肿瘤的T2WI信号强度(signal indensity,SI)与左侧臀大肌信号强度比值,测量时选取肿瘤最大层面实性区及同层左侧臀大肌勾画感兴趣区(region of interest,ROI),根据病变的大小选取1~3个ROI,多点测量并取其平均值,ROI面积约为10 mm2,计算肿瘤与臀大肌的信号强度比(SINEN/SIM);(4)观察病变在DWI图像及ADC图像上的信号特征,测量肿瘤在b=800 s/mm2的高b值图像上的信号强度与同层左侧臀大肌信号强度比值,并测量病灶的表观弥散系数值(apparent diffusion coefficient,ADC);(5)观测病灶增强3D-VIBE图像的强化程度和形态特征,测量肿瘤在3~4 min增强图像上的信号强度与同层左侧臀大肌的信号强度比值。
1.5统计学处理 采用SPSS 17.0数据分析软件包完成数据处理和统计分析。应用非参数Kruskal-WallisH检验来比较3组病例测量值的差异性,并用Wilcoxon检验进行两两比较检验。P<0.05为差别有统计学意义。
2 结 果
2.1肿瘤病理分级及分期 根据2010版WHO消化系统肿瘤新分类,20例直肠NEN中病理分级为:G1(12例),G2(3例),G3(5例)。手术切除或探查病理分期为12例G1中pT1N0M010例, pT2N0M01例,pT3N2M01例;3例G2中1例pT1N0M0,1例pT3N2M0,1例pT4N2M1,该病例累及肛提肌且伴周围淋巴结、骨及肝转移;5例G3中2例侵犯周围器官(1例为肛提肌,1例为右卵巢),远处骨转移、肝转移、肺转移各1例,病理分期为pT3N1M01例,pT3N2M01例,pT3N2M11例,pT4N2M12例(表1)。
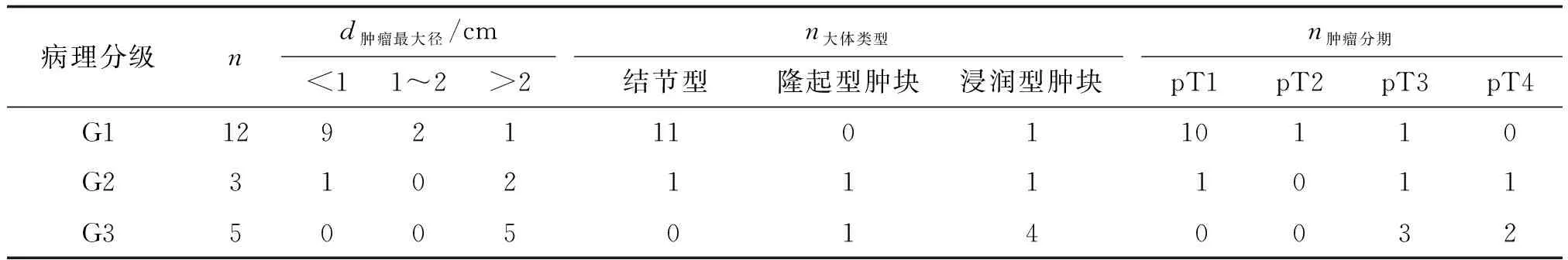
表1 20例直肠神经内分泌瘤的病理特征
2.2MR显示肿瘤部位、大小及大体形态 MRI共检出20例病例中的异质病灶17个,另外3个病灶MR无法检出(结合手术结果均为结节型G1,直径<1.0 cm),MRI对直肠NEN的检出率为85%。17个病灶中位于低位直肠9例,中位7例,高位1例。MRI检出的9例G1 病例中,8例为结节型(6例直径为0.3~1.0 cm,2例直径为1.0~1.5 cm),另1例为肠腔内隆起型肿块(最大径为3.5 cm)。3例G2中,1例为直径约0.8 cm的结节。1例G2及1例G3为直肠腔内偏一侧的隆起型肿块, 最大径为2.0~3.0 cm。1例G2及4例G3为肠壁广泛增厚的浸润型肿块,最大径为3.0~8.0 cm。G1组最大径均值为(1.09±0.94) cm,G2组为(2.47±1.56) cm,G3组为(4.60±2.07) cm,3组间比较,差别有统计学意义(P<0.05)。进一步两两比较,G1与G3组间最大径比较,差别有统计学意义(P<0.05)。
2.3MRI表现特征 G1主要表现为T1WI及T2WI等信号,信号均匀,增强后明显均匀强化。G3病例大多呈T1WI等或稍低信号,T2WI稍高信号,信号欠均匀,增强后不均匀明显强化。3例G2病例MRI表现与G1及G3病例均有重叠。G1级直肠NEN的ADC值和强化程度高于G2和G3。3组间MR最大径比较,差别有统计学意义(P<0.05)。进一步两两比较,G1与G3组间最大径比较,差别有统计学意义(P<0.05,表2)。
2.3.1T1WI、T2WI信号特征及增强模式 12例G1中,9例在MR多序列扫描中得到良好显示,其中8例为息肉样隆起型结节,T1WI及T2WI多呈等信号,信号均匀,无明显坏死囊变,3D-VIBE序列呈均匀强化结节(图1)。1例为肠腔内隆起型肿块,T1WI等或稍低信号,T2WI稍高信号,信号均匀,无坏死囊变,增强后呈均匀明显强化。另外3例在MR各序列上无明显异常信号表现,经手术病理证实均为位于肠黏膜体积微小(直径均<1.0 cm)的G1结节。
3例G2病例中,1例为结节型,T1WI及T2WI呈等信号,信号均匀,无明显坏死囊变,增强后呈明显均匀强化。2例为肿块型,T1WI等或稍低信号,T2WI稍高信号,信号欠均匀,中央可见少许坏死囊变,增强后呈不均匀明显强化。
5例G3表现为隆起型肿块或肠壁广泛增厚的浸润型肿块(图2),T1WI等或稍低信号,T2WI稍高信号,信号欠均匀(3例由于肿块部分坏死,瘤内见更低T1更高T2信号)。增强后肿块呈明显不均匀或均匀强化。
3组间T2WI及3D-VIBE的SINEN/SIM值比较,差别无统计学意义(P>0.05),但随着级别增高,肿瘤的强化程度逐渐下降,G1组的直肠NEN强化最明显。
2.3.2DWI表现 12例G1直肠NEN病例中,7例呈DWI高信号,ADC低信号。5例最大径<1.0 cm的肿瘤DWI未检出。8例G2,G3病例DWI均能显示,呈DWI高信号,ADC低信号。3组间DWI的SINEN/SIM值和ADC值差别无统计学意义,但G1组的ADC值均值高于G2组和G3组。
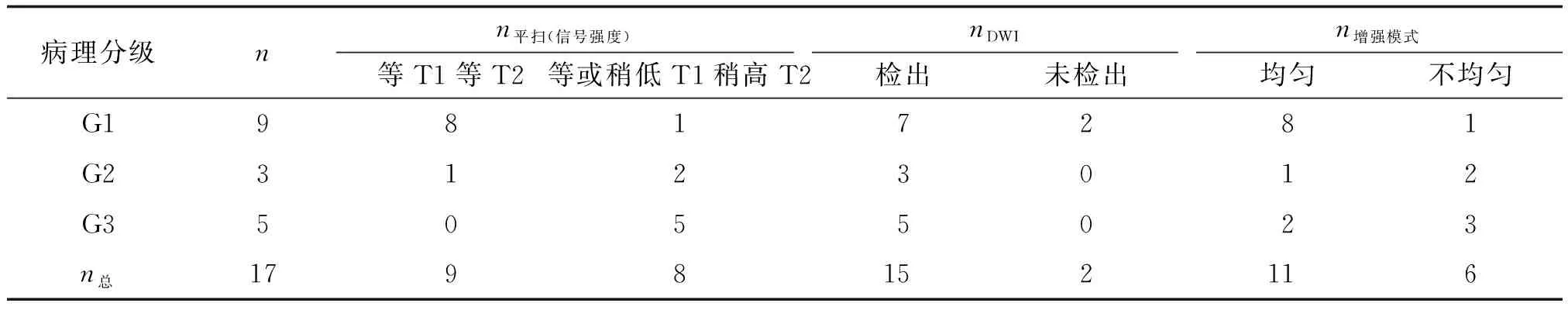
表2 17例直肠神经内分泌瘤MR信号表现及增强模式
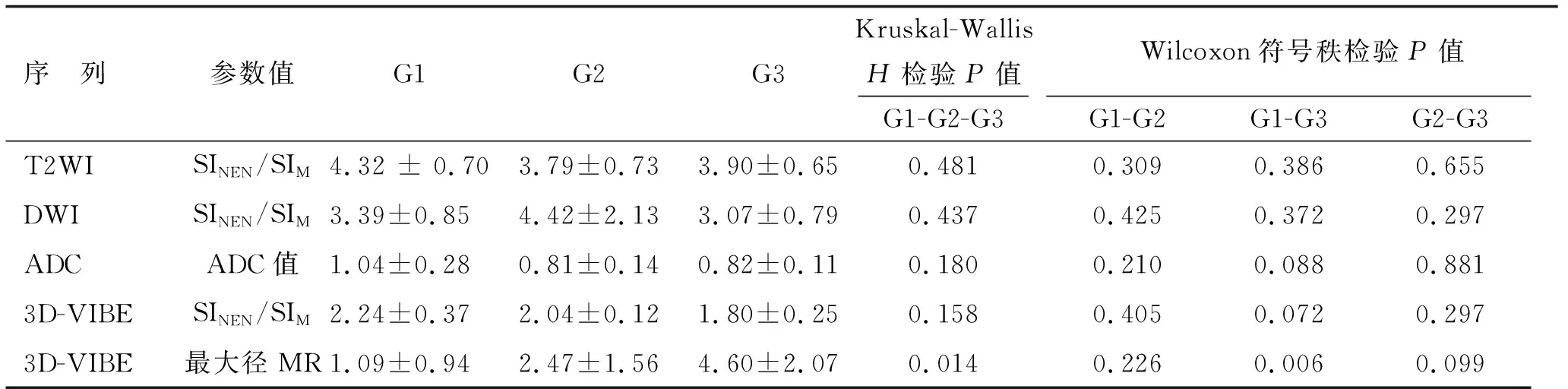
表3 最大径、ADC值和T2WI、DWI及T1-VIBE序列的SINEN/SIM值比较
ADC:表观弥散系数值.
3 讨 论
2000年前,“类癌”这一术语被广泛用于描述神经内分泌肿瘤NEN。但简单的“类癌”诊断,既不能说明NEN这种肿瘤的起源和激素分泌活性,也不能反应NEN的生物学行为,因此“类癌”这一诊断名称逐渐被摈弃[4]。2010年WHO分类采用“NEN”命名所有源自神经内分泌细胞的肿瘤,同时参照欧洲神经内分泌肿瘤学会(European Neuroendocrine Tumor Society,ENETS)指南新增了组织学分级系统以进一步判断NEN的恶性程度[5]。
根据2010 WHO指南,一般将高分化NEN(包括低级别G1和中级别G2)归类为神经内分泌瘤(neuroendocrine tumor,NET),而将低分化NEN即高级别G3归于神经内分泌癌( neuroendocrine cancer,NEC)范畴。该NEN新分类分级系统的重要临床意义在于使生物学行为偏良性的NET可以安全地进行相对保守的外科手术如内镜下切除术的治疗,而生物学行为为恶性的NEC得以接受较激进的外科手术如直肠前切除术、腹会阴联合直肠切除术、化疗等治疗[5-7]。
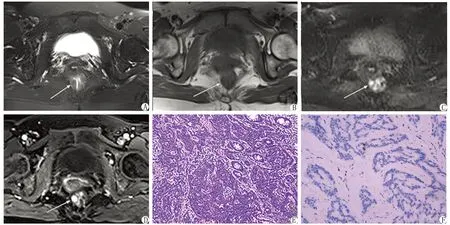
A:T2WI;B:T1WI;C:DWI;D:增强后3D-VIBE;E:H-E染色( ×200);F:免疫组织化学EliVision染色( ×200).图1 直肠神经内分泌瘤G1的MR及病理观察Fig 1 G1 rectal NEN in MRI and pathology
本研究中,不同级别直肠NEN的MRI特征包括病变大小、信号和形态不同。随着级别增高,直肠NEN的最大径逐渐增大,G1级直肠NEN的ADC值及强化程度高于G2和G3,证实MRI有助于直肠NEN的术前分级。G3级直肠NEN病例都为较大肿块(最大径>2 cm),T1WI呈等稍低信号,T2WI稍高信号,病变形态不规则,信号不均匀,肿瘤内见不规则、无强化腔隙存在,高度提示恶性。G3级病例常侵出肌层、侵犯直肠系膜筋膜及盆底肌群,甚至出现淋巴结和脏器转移,具有明显的恶性特征,此时应注意与直肠癌鉴别。因二者影像学表现类似,最终诊断主要依赖病理学检查。G2病例可呈息肉样隆起型结节也可呈肿块影,其MRI表现与G1及G3病例均有一定重叠。
直肠NEN以G1多见,在本研究中,G1病例占直肠NEN总病例的60%(12/20)。绝大多数G1病例(88.9%,8/9)在MRI表现为息肉样隆起型结节(最大径多<2 cm),T1WI及T2WI呈等信号,信号均匀,DWI呈高信号,ADC呈低信号;增强后,结节型G1级NET均明显均匀强化,且强化程度接近直肠黏膜层,高于G2级及G3级的直肠NEN,可与大部分MRI表现为无明显强化、轻中度强化或多环状强化的息肉及腺瘤鉴别[8]。但值得特别注意的是,本研究中1例内镜活检病理证实为直肠神经内分泌瘤G1的病例,其MR检查提示肿瘤最大径>2 cm并侵出肌层,直肠系膜内见多发肿大淋巴结,警示即使是偏良性的NET也会侵犯周围组织及发生淋巴结转移。2010年WHO新分类强调,除了最大径<5 mm的微腺瘤以外,所有直肠NEN都具有恶性潜能。既往亦有最大径5 mm的直肠NET发生转移的个案报道[9]。因此,单从病理级别上判断NEN的良恶性存在一定限度,这与Modlin等的研究结果一致[10],直肠NEN的恶性程度主要与肿瘤的浸润深度即肿瘤TNM分期有关。
既往研究表明,MRI对直肠肿瘤的T分期准确性为66%~100%[11-12],MRI可认识的恶性生物学行为包括:肿瘤大小(判断是否≥5 mm)、肿瘤局部浸润深度、淋巴结转移和远处转移,因此MRI可对直肠NEN进行准确分期,辅助NEN的治疗方案和手术方式的制定及判断预后。而EUS对直肠肿瘤的T分期总准确率为62%~92%[13],EUS对局限于黏膜层及黏膜下层即T1期NEN的分期诊断准确率可达100%,但可能对T2~T4期直肠肿瘤过度分期进而导致过度治疗[14-15]。因此,ENETS指南推荐对直肠NEN先行纤维肠镜和(或)EUS诊断,而对>10 mm或怀疑有残留和转移性病变的直肠NEN进行进一步的MR检查。北美神经内分泌肿瘤协会共识则提出对≥2 cm或<2 cm但侵出黏膜及黏膜下层(即T2~T4)的直肠NEN可进一步行MRI检查[16]。
本研究中,MRI对直肠NEN的总检出率为85%,有3例最大径<1 cm的肿瘤MRI无法检出。结合T2WI序列、DWI序列及薄层增强3D-VIBE序列,MRI能准确显示大部分肿瘤的部位、大小及大体形态。3D-VIBE技术凭借其高分辨率薄层增强扫描成像可提高小结节病灶的检出率和诊断自信。直肠NEN及淋巴结在DWI上大多为高信号,DWI技术与T2WI联合应用可以弥补FSE-T2WI序列图像对比度不足、肿瘤检出困难的缺陷,有助于肿瘤及淋巴结的检出及定位。但要注意的是,DWI和ADC图像由于几何变形且序列层厚 6 mm,空间分辨率低,小病灶尤其是<6 mm的结节有时不能很好地显示,本研究中有5例<1 cm肿瘤DWI不能检出。同时,肠管气体伪影干扰可致正常直肠管壁在DWI上表现为高信号,影响肿瘤的检出。由于ADC值在良、恶性病变中有重叠,尽管DWI序列有助于淋巴结的检出,但无法鉴别转移性淋巴结与炎性增生淋巴结[17]。因此,DWI序列应与MRI其他序列联合应用,提高直肠NEN及淋巴结的检出率,单独依赖DWI诊断病变需谨慎。值得注意的是,直肠EUS可以检测最大径为3 mm的小病变,是直肠小NEN最好的诊断方法[18]。MRI的主要临床价值在于较大(≥2 cm)或浸润性(T2~T4)直肠NEN的分级分期诊断和监测复发、转移。

