IL-33敲除对小鼠腹腔巨噬细胞极化的影响
何小丽, 吴林青, 许伟群, 郑晨华, 傅冷西, 章 涛
白细胞介素-33(interleukin-33, IL-33)是一个于2005年新发现的IL-1家族成员,作为磺基转移酶同源体(homolog of sulfotransferase, ST2)的配体,具有前炎症细胞因子和核因子的双重作用[1-2]。其受体ST2选择性地表达在Th2上,而Th1上不表达。IL-33与受体ST2结合后,激活下游信号分子,从而调节基因转录,促进Th2细胞因子IL-4,IL-5和IL-13的产生[1],促进Th2的免疫反应,趋化嗜酸性粒细胞,改变巨噬细胞(macrophage, Mφ)的极化趋势,在多种炎症性疾病中发挥作用[3-6]。
Mφ在不同的微环境及不同因子的作用下可被激活成不同的表型,是一种具有复杂的异质性和多样性功能的细胞。根据极化后细胞的表面标志性分子及功能的不同,Mφ大体可分为经典激活的Mφ(M1型)和替代激活的Mφ(M2型)2个亚群。M1型细胞表达诱导型一氧化氮合成酶(inducible nitric oxide synthase, iNOS),分解L-精氨酸,产生NO及活性氧中间物,具有抗病原微生物和肿瘤细胞的作用,高效提呈抗原,是激活Th1细胞反应的效应细胞,以CD68+,CD86+及MHCⅡ+为表型特征[7-9]。而M2型则高表达1型精氨酸酶(arginase-1,Arg-1)、甘露糖受体(CD206)、YM-1(几丁质酶家族成员)及IL-10等,低表达IL-12;通过高表达的Arg-1分解L-精氨酸产生L-鸟氨酸,促进胶原合成、修复损伤组织。iNOS和Arg-1二者竞争结合L-精氨酸,最终通过代谢产物发挥促炎或抗炎的相反作用[10-12]。
研究显示,IL-33在Mφ的极化中起重要作用,主要通过IL-13/IL-4Rα-STAT6途径激活Mφ,促使Mφ向M2型极化,抑制Th1免疫反应,促进损伤组织修复、重构和血管生长功能[13-16]。因此,本研究以IL-33-/-小鼠腹腔巨噬细胞(peritoneal macrophage,pMφ)为靶点,研究IL-33-/-对小鼠pMφ 极化的影响,为后期进一步探讨IL-33-/-对弓形虫感染诱导小鼠pMφ 极化的影响奠定基础。
1 材料与方法
1.1动物 SPF级雌性C57BL/6野生型(WT)和IL-33-/-小鼠各 48只,鼠龄12~14周,体质量22~25 g;ICR小鼠30只,鼠龄5~7周,体质量18~20 g。C57BL/6 WT小鼠购自上海斯莱克实验动物有限责任公司[许可证号:SCXK(沪)2012-0002,合格证号:2015000509916, 2015000518671];C57BL/6 IL-33-/-小鼠为日本东京大学医学科学部Susumu Nakae教授惠赠,并由福建中医药大学林炜教授提供,与ICR小鼠一起饲养于福建医科大学实验动物中心[许可证号:SYXK(闽)2012-0001,适用范围:SPF级鼠类]动物房SPF层流柜中,鼠笼、鼠料、垫料、饮水均经过高压消毒灭菌,每周垫料更换2次,动物使用协议由福建医科大学动物审查委员会批准。
1.2试剂及仪器 引物[生工生物工程(上海)股份有限公司];PerCP-Cy5.5 anti-mouse CD80,Rat IgG2b,PE anti-Mouse TLR4,PE-anti-Mouse MHCⅡ,FITC-anti-mouse CD14,FITC-anti-mouse TLR2,κIsotype Ctrl PE/ Rat IgG2a,κIsotype Ctrl APC(美国eBiosciences公司);APC anti-mouse CD206及APC anti-mouse CD86(美国Biolegend公司);RPMI 1640培养液(美国Hyclone公司);胎牛血清(美国Gibco公司);Mouse IL-10,IL-12,TNF-α ELISA kit(杭州联科生物技术股份有限公司);Griess Reagent System (美国Promega公司);RevertAidTMFirst Strand cDNA Synthesis Kit(美国Fermentas公司);SYBR Green Master(美国Roche公司)。温度梯度PCR仪(德国Eppendorf 公司);台式高速冷冻离心机(Neofuge 15R,香港Heal Force Development有限公司);酶标仪(Multiscan FC)、CO2培养箱(Thermo Forma 3111型)(美国Thermo Fisher公司);Mx3005p实时荧光定量PCR仪(ND2000C,美国StrataGene公司);流式细胞仪(美国BD公司);超净台(苏州苏净安泰空气技术有限公司);超低温冰箱(英国NBS公司)。
1.3方法
1.3.1小鼠基因型的鉴定 采用Oboki设计的引物[17],由生工生物工程(上海)股份有限公司合成(表1),提取小鼠鼠尾DNA,PCR鉴定小鼠基因型。

表1 C57BL/6 WT及IL-33-/-小鼠基因型鉴定引物
WT:野生型;IL-33-/-:白细胞介素33敲除.
1.3.2实验分组及细胞培养 实验分2组,分别为 IL-33-/-组和WT组,每组6只,参照文献[18]的方法收集WT和 IL-33-/-小鼠的 pMφ,按每孔5×105个细胞,复孔接种于24孔细胞培养板,置 37 ℃、体积分数为0.05的CO2培养箱中培养2 h;洗去未贴壁的细胞,加入 1 mL新鲜的培养液,继续培养 48 h;吸取培养上清液,离心、分装、冻存于-70 ℃,用于 NO,TNF-α,IL-10及IL-12的检测;收集细胞进行Real-time PCR和流式检测。
1.3.3pMφ iNOS,Arg-1,IL-1,IL-10及IL-12 mRNA表达水平检测 2组均取培养48 h后的细胞,经Trizol裂解、提取RNA、D(260 nm)/D(280 nm)下测定其浓度和纯度;采用20 μL反应体系,按逆转录试剂盒逆转录为cDNA;按FastStart Universal SYBR Green Master(ROX)说明书进行Real-time PCR扩增,以β-actin为内参,检测iNOS,Arg-1,IL-1,IL-10及IL-12 mRNA的相对表达量,引物序列见表2。PCR扩增条件为50 ℃ 2 min→95 ℃预变性10 min→(95 ℃变性15 s→60 ℃退火1 min,40个循环体系)→95 ℃ 15 s→60 ℃ 1 min→95 ℃ 15 s。反应结束后,用ΔCt法进行计算,2-ΔΔCt的意义是实验组目的基因相对于对照组目的基因表达量变化的倍数,WT组为对照组。
ΔCt=Ct目的基因-Ct参照基因
ΔΔCt=(Ct目的基因-Ct参照基因)实验组-(Ct目的基因-Ct参照基因)对照组
1.3.4pMφ TNF-α,IL-10及IL-12分泌水平检测 采用双抗体夹心酶联免疫吸附(enzyme-linked immunosorbent assay, ELISA)检测技术,按试剂盒说明书进行操作。
1.3.5pMφ NO分泌水平检测 采用Griess方法检测,按试剂盒说明书进行操作。

表2 Real-time PCR引物表
IL-1β:白细胞介素1β; iNOS:诱导型一氧化氮合成酶; IL-12:白细胞介素12; IL-10:白细胞介素10; Arg-1:1型精氨酸酶; β-actin:β-肌动蛋白.
1.3.6pMφ表面分子(CD80,CD86,CD206,TLR4,TLR2及MHCⅡ)表达水平检测 胰酶消化收集2组细胞,洗涤后,加入含封闭抗体(CD16/32)的细胞洗液80 μL,混匀,冰浴10 min;加入各管相应的Ab(CD80/CD206/TLR4;CD86/MHCⅡ/TLR2)20 μL,漩涡混匀,4 ℃避光35 min;加入1%多聚甲醛的PBS固定液固定,上流式细胞仪检测。
1.4统计学处理 采用SPSS 19.0软件进行统计学处理,采用GraphPad Prism 5制图。采用独立样本成组t检验进行分析验证。P<0.05为差别具有统计学意义。
2 结 果
2.1小鼠基因型鉴定 经PCR鉴定,本实验用小鼠为C57BL/6 WT和IL-33-/-小鼠。
2.2小鼠pMφ 纯度鉴定 FITC-CD14染色检测纯度约为95%(图1)。
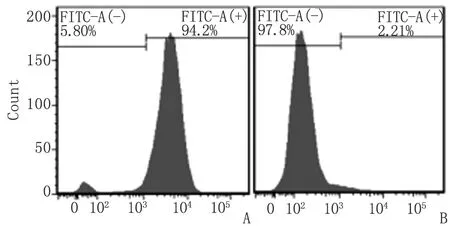
A:CD14 FITC标记; B:同型对照.图1 小鼠pMφ鉴定Fig 1 Identification of pMφ
2.3IL-33-/-对小鼠pMφ M1型标志物表达的影响 IL-33-/-小鼠pMφ上清液中NO的浓度及细胞表面分子MHCⅡ,TLR4及CD86的阳性百分率高于WT组 (NO,CD86 和MHCⅡ ,P<0.01;TLR4 ,P<0.05),提示IL-33-/-促进小鼠pMφ分泌NO,高表达MHCⅡ,CD86和TLR4分子(图2,3)。IL-33-/-对小鼠pMφ iNOS,IL-1,IL-12 mRNA及TNF-α,CD80,TLR2的表达未见影响(P>0.05)。
2.4IL-33-/-对小鼠pMφ M2型标志物表达的影响 IL-33-/-小鼠pMφ IL-10的分泌高于WT组(P<0.05,图3),提示IL-33-/-促进小鼠pMφ IL-10的表达。IL-33-/-对小鼠pMφ Arg-1,IL-10 mRNA及CD206的表达未见影响(P>0.05)。

n=6. CD80:分化抗原80;CD86:分化抗原86;TLR4:Toll样受体4;TLR2:Toll样受体2;MHCⅡ:主要组织相容性Ⅱ类分子;CD206:甘露糖受体. 2组间比较,☆:P<0.05,☆☆:P<0.01.图2 M1/M2型pMφ表面分子表达比较Fig 2 Expression of M1/M2 surface marks in pMφ
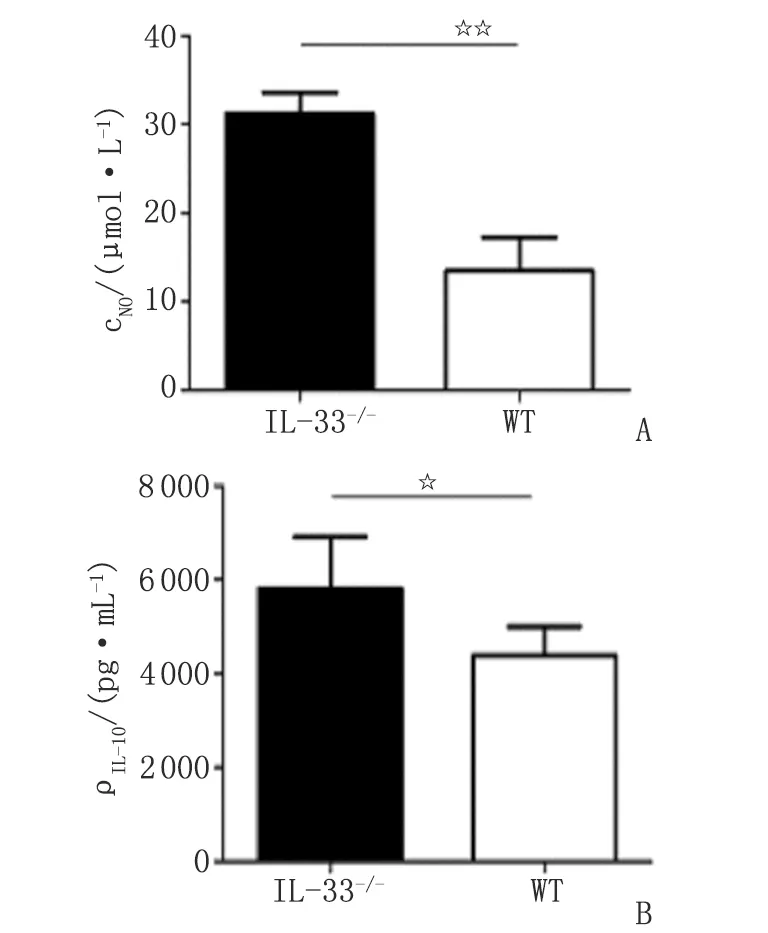
A:NO浓度;B:IL-10浓度. n=10. NO:一氧化氮;IL-10:白细胞介素10. 2组间比较,☆:P<0.05;☆☆:P<0.01.图3 小鼠pMφ NO及IL-10浓度比较Fig 3 Secretion of NO and IL-10 in pMφ
3 讨 论
研究显示,IL-33/ST2在先天性及抗原诱导性的气道反应性炎症中,可驱动肺泡巨噬细胞(alveolar macrophags, AM)向M2a亚群极化,IL-13/IL-4Rα信号通路在这一极化过程中起关键作用。IL-33放大了这一极化过程,增加了M2a标志物Arg-1,CD206,YM-1及趋化因子CCL24和CCL17的表达,去除AM,可减轻气道炎症反应[12]。Jackson-Jones等在研究真菌抗原诱导的过敏性炎症和线虫感染中也证实,IL-33诱导的Mφ的替代激活依赖于浆膜腔中的IL-4Rα,而Mφ的增殖不依赖于IL-4Rα[15]。在小鼠实验性脑型疟疾(experimental cerebral malaria, ECM)的研究中发现,IL-33通过促进Th2型的先天性淋巴细胞产生IL-4,IL-5及IL-13等2型细胞因子,驱动Mφ向M2型极化,后者再影响Tregs,最终抑制Th1免疫反应,减少IFN-γ及TNF-α等细胞因子的分泌,抑制ECM病程的进展[16]。最新研究也证实,在柯萨奇病毒引起的心肌炎和三硝基苯磺酸诱导的肠炎中,IL-33通过诱导Mφ向M2亚群极化,从而减轻炎症发展[4-5]。因此,本研究以IL-33-/-小鼠pMφ为靶点,研究IL-33-/-对小鼠pMφ极化的影响,为后期进一步探讨IL-33-/-对弓形虫感染诱导小鼠pMφ极化的影响奠定基础。
本研究分别收集未经诱导的IL-33-/-小鼠和WT小鼠pMφ,于体外培养48 h后,同时检测2组pMφ各细胞因子的mRNA表达水平、细胞培养上清液中细胞因子及炎性介质的分泌浓度、细胞表面标志性分子的阳性百分率,以便客观分析IL-33-/-对小鼠的pMφ极化的影响。pMφ培养上清液中,IL-33-/-组小鼠的NO浓度明显高于WT组,由于NO具有杀伤病原微生物的作用,提示IL-33-/-可能增强了小鼠pMφ的抗炎活性。本研究结果显示,IL-33-/-组小鼠pMφ iNOS,IL-1,IL-10,IL-12及Arg-1 mRNA表达水平与WT组比较无明显变化(P>0.05),而IL-33-/-小鼠pMφ培养上清液中NO和IL-10浓度明显升高,可能与检测的时间点延后有关。有文献报道,在诱导Mφ 4 h后,Real-time PCR检测RNA表达有明显变化[19]。
T细胞的活化依赖于双信号的识别和细胞因子的参与。MHCⅡ类分子为CD4+T细胞激活第一信号中的关键分子,而CD86作为CD28的配体,为T细胞激活提供了第二激活信号(即共刺激信号)。IL-33-/-组小鼠pMφ表面MHCⅡ类分子和CD86分子的阳性百分率明显高于WT组(P<0.01),提示IL-33-/-可能增强了CD4+T细胞激活的双信号,促进T细胞的生长和分化。
Toll样受体是一类可识别并结合相应的病原体相关分子模式的跨膜受体,主要通过启动TLR/MyD88信号传导途径[20],诱导某些免疫效应分子(包括炎性细胞因子)的表达,在诱导免疫应答和介导炎性反应中发挥重要作用[21-22]。TLR2和TLR4均可在髓系单核细胞上表达。IL-33-/-组小鼠pMφ TLR4表达高于WT组,而对TLR2的表达无影响。本研究在探讨IL-33-/-对弓形虫感染诱导小鼠pMφ极化的影响时发现,IL-33-/-和弓形虫感染协同抑制了TLR2分子的表达,而对TLR4则无影响[23],具体原因还有待进一步探讨。
综上所述,IL-33-/-促进了小鼠pMφ高表达CD86,TLR4及MHCⅡ类分子,上调NO的分泌,总体符合M1型细胞特征,提示IL-33-/-可驱动小鼠pMφ向M1型极化。IL-33在Mφ分化调控和免疫调节中的作用尚不清楚[24],有待后续进一步探索。

