慢性肾病并发慢性心血管损伤大鼠模型的建立
姚波,马晓燕,张鲁囡,王禹
1.解放军总医院,北京 100853;2.长春中医药大学 附属医院,吉林 长春 130021;3.北京卫戍区 海淀第三退休干部休养所,北京 100853
慢性肾脏疾病(chronic kidney disease,CKD)是威胁人类健康的重要疾病,全世界有超过200万人患有终末期肾脏病[1-2],需要依赖肾脏替代治疗维持生命。大鼠CKD模型可促进人们对CKD发生机制的理解,并用于测试新药。在大鼠饲料中添加腺嘌呤可诱导形成大鼠CKD模型。饲料中添加质量分数0.75% 的腺嘌呤便可导致肾脏损伤,具体表现为肾脏体积增大、结节样外观、凋亡性病损、70% ~80% 的肾脏组织纤维化、血浆尿素氮和血清肌酐升高、电解质代谢紊乱[3]和氧化应激。与人类CKD以年计的进展进度不同,大鼠CKD模型的这些改变均可在4周内出现。
作为一种嘌呤碱基,腺嘌呤是黄嘌呤氧化酶的产物,是体内尿酸的潜在来源之一[4]。尿酸是诱导氧化应激、CKD、高血压、心肌肥大和炎症的重要因素[5],能够导致心脏和肾脏损伤,在某些情况下还能导致终末期肾脏病[6]。本次研究的主要目的是明确腺嘌呤诱导CKD模型的肾脏和心脏结构及功能改变的特征,其次要明确应用别嘌呤醇降低尿酸浓度能否减轻大鼠对腺嘌呤的反应。经过剂量实验、肾脏和心脏结构分析及功能学实验,我们认为,应用质量分数为0.25% 的腺嘌呤诱导16周,能够引发高尿酸诱导性的慢性肾脏损伤,这可能作为一种用于模拟人类CKD且伴有心血管并发症的动物模型。
1 材料和方法
1.1 动物实验
动物实验流程和方法均通过解放军总医院动物福利委员会的审核。9~10周龄雄性Wistar大鼠(n=76,体重333±1 g)购自维通利华公司,分为7个实验组,处理16周。第1组(对照组,n=12)饮食为大鼠粉末食料(维通利华公司);第2~5组,向粉末食料中添加腺嘌呤(Carbosynth公司),使腺嘌呤质量分数分别为0.075% (n=10)、0.25% (n=12)、0.5% (n=10)或 0.75% (n=8);第 6组给予0.25% 腺嘌呤16周,同时给予25 mg/(kg·d)别嘌呤醇(Sigma公司)(n=12);第7组从第8~16周单独给予25 mg/(kg·d)别嘌呤醇(n=12)。
1.2 收缩压的测量
每4周测量1次大鼠的收缩压,测量前静脉注射给予Zoletil(替来他明15 mg/kg,唑拉西泮15 mg/kg)使动物轻度镇静。用MLT1010 Piezo-Electric Pulse Tranducer(ADInstrucments公司)及不可充气的尾钳(tail-cuff)与 MLT884 Physiologi⁃cal Pressure Transducer及Power Lab数据获取单元(ADInstruments公司)测量并获取数据[7]。
1.3 肾功能评估
16周饲喂结束后,将大鼠于代谢笼中饲养24 h,收集尿液用于蛋白、肌酐和尿素氮浓度的测量。收集尿液后,麻醉大鼠并收集血浆标本。测量血浆尿素氮、肌酐、尿酸、钠、钾、钙、乳酸脱氢酶、总胆固醇、总甘油三酯及非酯化脂肪酸。计算肌酐清除率。
1.4 获取离体的心脏
获取血液标本后剪下大鼠的心脏,于0℃结晶灌注液中保存。在残主动脉冠状动脉口上方向主动脉内置入套管,进行心脏灌注,通过在左心室内置入乳胶球囊导管评估等容心室功能;导管与Capto SP844MLT844 Physiological Pressure Transducer and Chart软件相连,用MacLab System和PowerLab数据获取单元(ADInstruments公司)测量获得数据。实验结束后,解剖去除心房和右心室,留下左心室和室间隔,用纱布吸干,称重。心肌舒张的顺应性通过舒张顺应性常数κ计算。
1.5 血管反应的器官浸浴实验
胸主动脉弓(长度4 mm)置于器官浸浴小室,静息张力为10 mN。测量去甲肾上腺素的累积浓度反应(收缩)曲线;在对去甲肾上腺素次峰值(~70% )收缩存在的同时,测量乙酰胆碱和硝普纳的浓度-反应(舒张)曲线。
1.6 组织病理学
获得活体组织肾脏和心脏(左心室)以后,立即在10% 福尔马林中固定,每天更换福尔马林溶液。用酒精梯度对样本进行脱水,在石蜡中固定。肾脏、左心室和肝脏做薄层切片(4 μm),苏木素-伊红(H & amp;E)染色或Masson三色染色。进行过碘酸希夫染色(PAS),以观察近端肾小管管腔刷状缘的缓解。用ImagePro Plus图像分析软件进行图像形态学分析。
1.7 免疫印迹
本研究中使用的一抗包括多克隆山羊TNF-α(1∶1000)、多克隆兔抗NF-κB p50(1∶1000)、多克隆兔抗 NF-κB p52(1∶1000)、单克隆兔抗TGF-β1(1∶1000)(SantaCruzBiotechnology 公司),以及多克隆兔抗PLA2(1∶1000)、单克隆小鼠抗HO-1(1∶1000)(Abcam公司)。
将肾脏皮质和髓质在含有蛋白酶抑制剂的RIPA裂解液中匀浆。根据蛋白浓度确定电泳上样量,各组上样量保持一致,以GADPH(1∶5000,Sigma-Aldrich公司)作为对照,用ImageJ图像分析软件分析条带浓度。
1.8 免疫组织化学染色
免疫组织化学染色使用的一抗包括单克隆小鼠抗ED-1(1∶150,Serotec公司)、单克隆小鼠抗α-SMA(1∶400,Sigma公司)。免疫组织化学染色在4 μm切片上采用常规操作进行。
1.9 统计学分析
数据以x±s表示,使用One way方差分析和Tukey检验,或Two way方差分析和Bonferroni检验,P<0.05认为有统计学显著差异。用Graph Pad Prism 5.0进行统计学分析。
2 结果
2.1 不同剂量腺嘌呤饲喂对大鼠体重的影响
0.75 % 腺嘌呤组大鼠摄食量保持恒定;0.075% 腺嘌呤组大鼠体重无明显改变;16周时,与衰老相关的体重增加在0.25% 腺嘌呤组中更明显;0.5% 腺嘌呤组大鼠体重无增长,0.75% 腺嘌呤组大鼠体重下降(图1)。
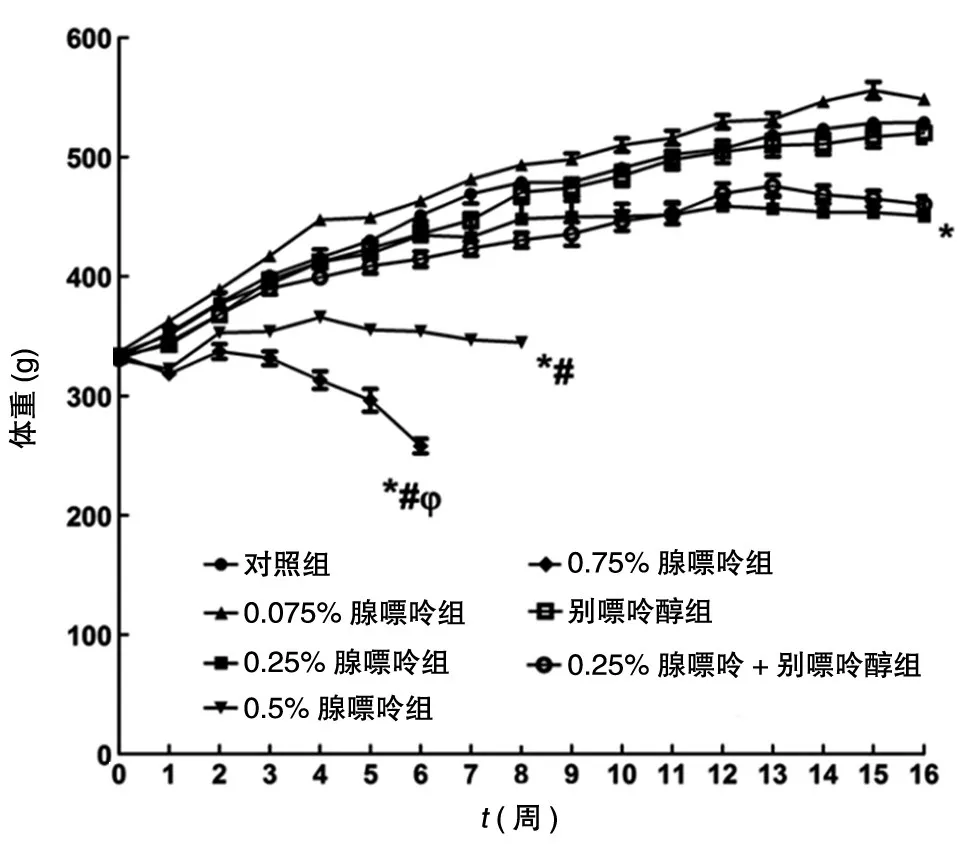
图1 不同质量分数腺嘌呤饲喂对大鼠体重的影响
2.2 不同剂量腺嘌呤饲喂对大鼠收缩压和心脏结构的影响
0.25 % 、0.5% 和0.75% 腺嘌呤组大鼠的收缩压显著增加,但0.075% 腺嘌呤组增加的程度较轻(图2A)。0.075% 腺嘌呤组大鼠的左心室结构无改变,但在高浓度腺嘌呤组中可观察到明显的纤维化和炎症细胞浸润(图2B)。
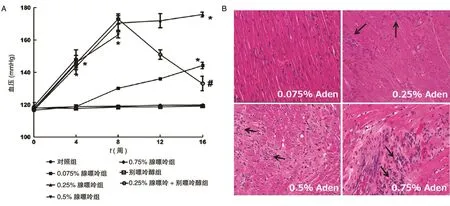
图2 不同质量分数腺嘌呤饲喂大鼠的血压和心肌结构变化
2.3 0.25% 腺嘌呤对大鼠心血管功能的影响
0.25 % 腺嘌呤饲喂组大鼠的收缩压从第4周开始升高,到第8周开始稳定。左心室刚性常数(stiffness constant)升高(32.9±1.4 vs.23.1±0.8),伴有心脏炎症细胞浸润及间质和血管周纤维化。在离体胸主动脉环中,去甲肾上腺素介导的收缩,内皮依赖乙酰胆碱介导的和平滑肌依赖硝普钠介导的舒张受损(图3)。血清甘油三酯、总胆固醇和非酯化脂肪酸升高(表1)。
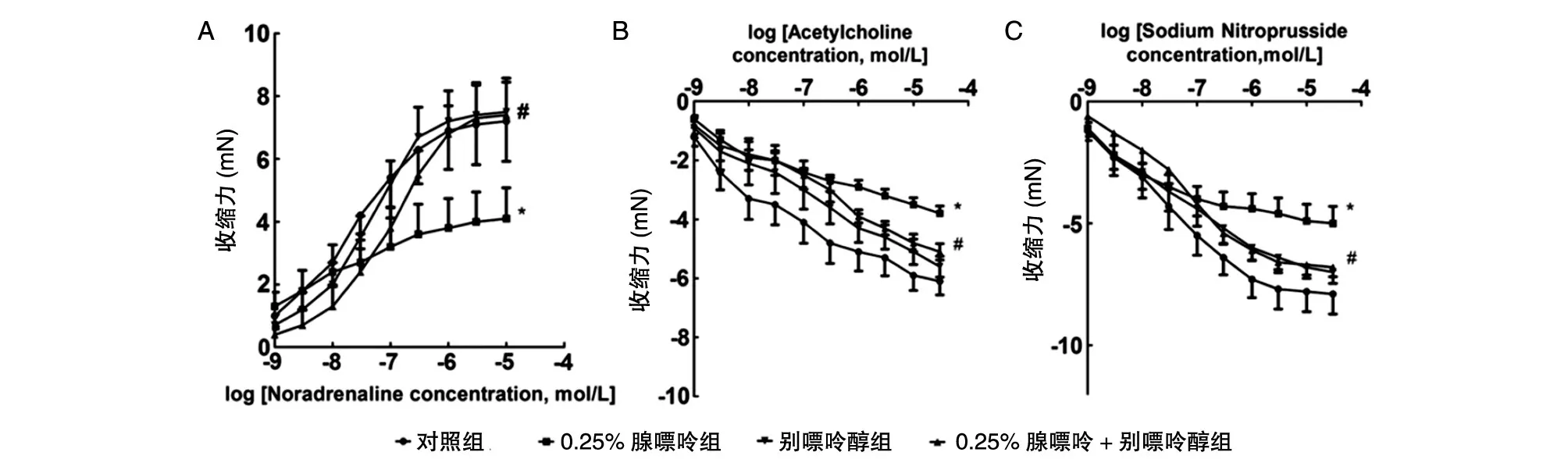
图3 腺嘌呤饲喂和别嘌呤醇治疗后,去甲肾上腺素(A)介导的收缩,内皮乙酰胆碱(B)、平滑肌硝普钠(C)介导的舒张功能变化
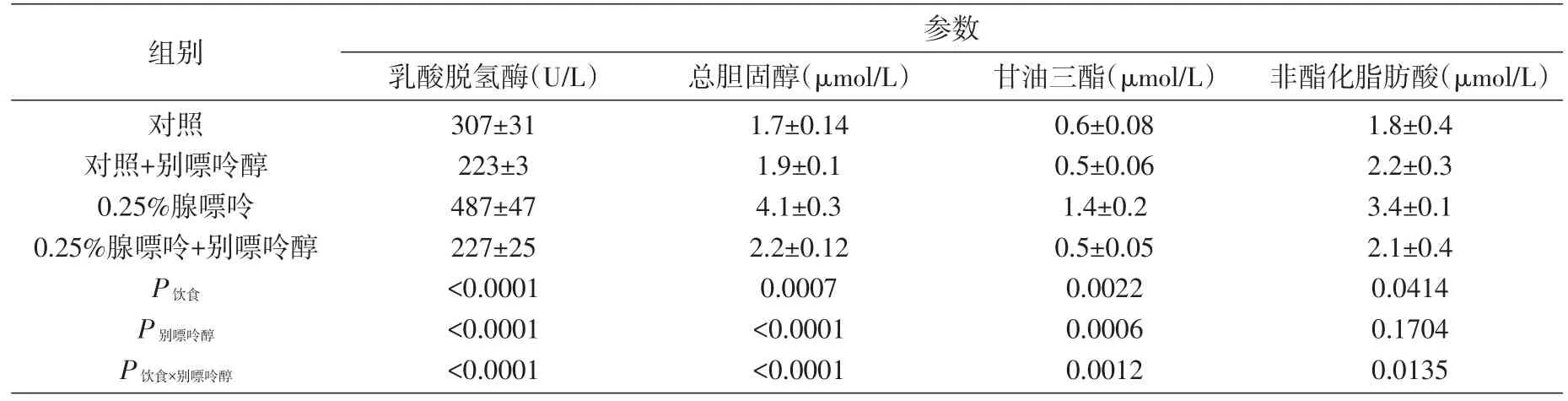
表1 不同剂量腺嘌呤饲喂对大鼠血浆指标的影响
2.4 不同剂量腺嘌呤饲喂对大鼠生化指标的影响
不同剂量的腺嘌呤饲喂大鼠后,血浆参数和蛋白尿程度在0.75% 腺嘌呤组大鼠中较其他组更高(表2)。肾脏病理切片中,单位面积内扩张的肾小管数、含有碎片的小管数、异常肾小球数、纤维化面积比例在0.75% 腺嘌呤组大鼠体内也有明显升高(数据未示)。
2.5 应用别嘌呤醇治疗0.25% 腺嘌呤诱导的大鼠抑制肾组织内多种蛋白表达
用25 mg/(kg·d)的别嘌呤醇治疗0.25% 腺嘌呤饲喂大鼠至少8周,能够降低血浆尿酸浓度,改善肾功能,表现为蛋白尿、肌酐、血浆尿素氮及清除率降低。结构上,小球损伤、炎症和胶原沉积在别嘌呤醇治疗后降低(数据未示)。别嘌呤醇治疗后,肾脏 HO-1、TNF-α、PLA2、NF-κB p50、NF-κB p52和TGF-β的表达降低(图4)。
3 讨论
目前,科学家们广泛接受的CKD动物模型是大鼠5/6肾切除模型[8],这种模型能够模拟人类肾脏疾病中肾小球滤过率下降、血清肌酐和尿素氮升高、体重降低[9]的病理改变,但存在死亡率高、肾脏结构和功能结局多变,以及剩余可用肾组织体积有限等缺点。其他CKD模型包括单侧肾单次夹闭[10]、双侧肾单次夹闭、通过链霉素化学诱导糖尿病[11]和基因模型如糖尿病性肥胖db/db小鼠和ob/ob小鼠[12]。这些模型仅可复制一部分人类CKD的表现,无法完整地复制相应的表现。
饮食中添加腺嘌呤能够诱导肾脏损伤,其主要表现为血清肌酐和血浆尿素氮浓度升高,以及肌酐和血浆尿素氮清除率下降[5]。早期的研究表明,0.75% 腺嘌呤饲喂能够引起显著且迅速的病理改变[13]。我们在剂量范围研究中已确认了这一结果,反映在人类中,即为不常见的急性进展性肾脏损伤。本研究中,我们发现0.25% 腺嘌呤能够在16周时诱导与人类CKD类似的慢性肾脏损伤。同时,我们也观察到慢性炎症细胞浸润、纤维化程度升高、肾小管萎缩和扩张、肾小球损伤等病理改变,模型大鼠的血清脂质浓度也有所升高,这可能是由于肾脏损伤引起的代谢障碍所导致。0.25% 腺嘌呤饲喂的大鼠出现了高血压和心室胶原沉积等症状,但无法确认肾脏损伤和心血管系统损伤是同时发生还是次序发生。第4周时收缩压升高,尿试纸检验提示出现蛋白尿;第8周时收缩压进一步升高,尿液中开始出现血液或白细胞,提示肾脏和心血管疾病同时进展。
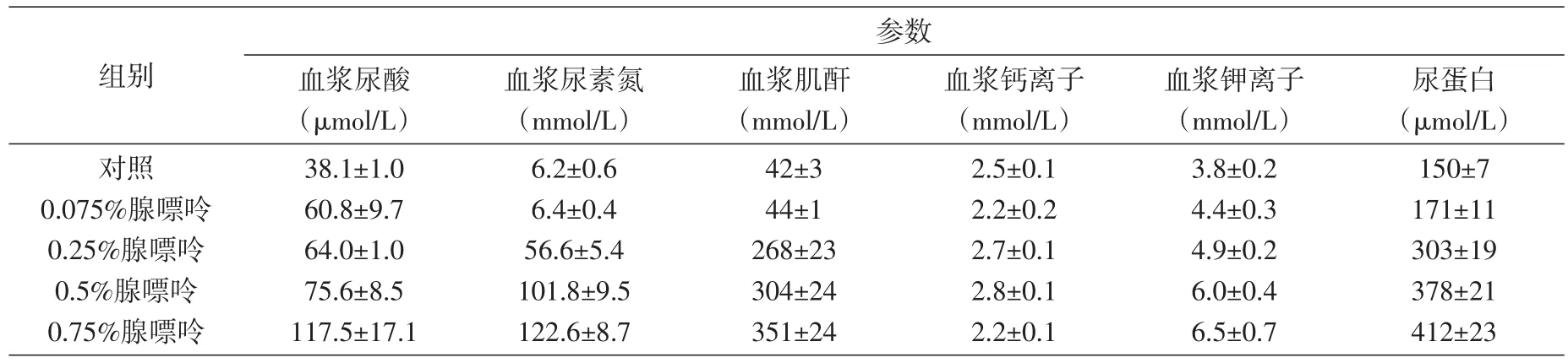
表2 不同剂量腺嘌呤饲喂对大鼠生化指标的影响
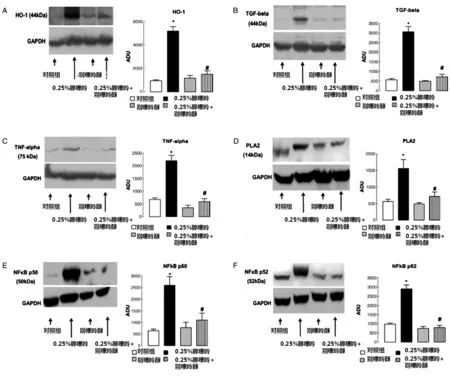
图4 腺嘌呤饲喂、别嘌呤醇治疗后大鼠肾脏HO-1(A)、TGF-β(B)、TNF-α(C)、PLA2(D)、NF-κB p50(E)、NF-κB p52(F)的表达
肾脏和心血管反应的同时存在提示饮食中添加0.25% 腺嘌呤能够克服许多其他CKD动物模型的缺点。相比于大鼠,小鼠可能对腺嘌呤更敏感,这还有待进一步的探讨。
腺嘌呤诱导的肾脏损伤可能由血浆尿酸浓度升高所致。作为一种嘌呤碱基,腺嘌呤可能通过黄嘌呤氧化酶而成为尿酸的来源之一。血浆尿酸浓度在0.25% 腺嘌呤饲喂大鼠中升高,而在别嘌呤醇治疗的大鼠体内下降。别嘌呤醇治疗能够改变0.25% 腺嘌呤饲喂大鼠的心脏和肾脏功能和结构,提示尿酸可能在心脏和肾脏病理改变中扮演主要角色。别嘌呤醇在db/db小鼠中也可改善肾脏功能并缓解小管间质纤维化损伤[14]。
另一个可能的参与机制是氧化应激本身。支持这种假设的证据之一是HO-1表达水平的升高。氧化物可以诱导肾小球选择性下降,细胞表型丧失、凋亡[15],内皮细胞损伤,脂质过氧化和炎症细胞反应,氧化物浓度与下降的肾脏功能负相关。HO-1是人类肾脏疾病和实验模型中针对氧化应激的关键防御机制,HO-1的表达与蛋白尿和小管间质改变的严重程度相关。HO-1在自由基介导的损伤肾脏中过表达。氧化物能够引起足细胞损伤,而足细胞损伤是导致肾小球损伤和进一步硬化的关键因素。
慢性肾病并发慢性心血管损伤大鼠模型的建立,为今后肾病、心血管系统疾病的研究提供了一种新的动物模型,其科研潜力有待进一步发掘。同样,由于该模型的各方面相关研究资料尚不多,其稳定性及代表性也有待考证。

