一株吡咯喹啉醌产生菌的筛选和初步鉴定
杨亚欣,刘天,李彤,孙晓宇,汪建华,熊向华,张惟材,葛欣
1.河北大学 生命科学学院,河北 保定 071000;2.军事科学院 军事医学研究院 生物工程研究所,北京 100071
吡咯喹啉醌(pyrroloquinoline quinone,PQQ),化学名称为4,5-二氢-4,5-二氧化-1-氢吡咯(2,3f)醌-2,7,9-三羧酸,是继吡啶核苷酸和核黄素核苷酸之后第3种氧化还原型辅酶,能够刺激线粒体再生,促进神经生长因子生成,具有抗氧化、促进认知、增强体能等功能[1-4],有人提出应列为B族维生素中的新成员[5],具有良好的开发前景。
PQQ合成包括化学合成和生物合成,化学合成需要11步反应和5步纯化,步骤多、产率低且污染环境;而生物合成步骤少、周期短、成本低,是工业化生产的惟一可行路线。PQQ产生菌均为革兰阴性菌,其中以甲醇为惟一碳源的甲基营养菌的PQQ产量最高。我们采集了不同地区的土壤样品,利用甲醇选择培养基富集培养,通过NBT染色和Native-PAGE法筛选得到1株产量为13.3 mg/L的PQQ产生菌,经鉴定为生丝微菌(Hy⁃phomicrobium),命名为生丝微菌T28。
1 材料与方法
1.1 材料
甲基营养菌 MP688(Methylovorussp.MP688)由本实验室保存;琼脂糖凝胶DNA回收纯化试剂盒购自北京天根生化科技有限公司;DNA聚合酶、DNA marker购自北京全式金生物技术有限公司;山梨糖脱氢酶(SDH)由本实验室表达纯化获得;测序及PCR引物合成由北京华大基因科技股份有限公司完成;其他生化试剂(分析纯)均购自国药集团。培养基成分见表1~5。
10×非变性缓冲液:Tris amino 30.3 g,甘氨酸144.0 g,pH8.8,定容至1 L。
5×非变性上样缓冲液:1 mol/L Tris-HCl(pH6.8)12.5 mL,溴酚蓝250 mg,甘油25 mL,加水定容至50 mL。
1.2 NBT染色法筛选PQQ产生菌[6]
取5 g土样于10 mL无菌水中充分振荡摇匀,静置后取1 mL悬液加入盛有25 mL富集培养基的三角瓶中,30℃、200 r/min富集培养48 h;移取1 mL培养液至另一盛有新鲜富集培养基的三角瓶中继续培养,重复富集培养3次;将培养物离心,取 20 μL 上清加 4 μL SDH 和 180 μL NBT检测液于96孔板,观察反应液颜色的变化;选择反应体系变蓝紫色阳性孔的菌液,用无菌水稀释至 1/104~1/108,分别取 10 μL 涂布于平板筛选培养基上30℃培养48~72 h;挑取单菌落于 5 mL HC液体培养基中30℃培养4 d,取1 mL菌液12 000 r/min 离 心 1 min,菌 体用 500 μL 20 mmol/L的Tris-HCl重悬后超声波裂解;裂解液离心后取20 μL上清于96孔板中,加入4 μL脱辅基的 SDH,30℃温育20 min后加入180 μL NBT活性染色液,混匀后观察反应液颜色的变化。
1.3 PQQ产生菌的Native-PAGE法鉴定
PQQ产生菌用HC培养基于30℃培养3 d,取1 mL菌液12 000 r/min离心1 min后弃上清,菌体用500 μL 20 mmol/L Tris-HCl重悬,超声波裂解,裂解菌液16 μL加4 μL 5×非变性上样缓冲液制备样品,进行Native-PAGE。剥离电泳凝胶,放入已加入10 mL蒸馏水、3 mL NBT(2 mg/mL)、3 mL TMB、3 mL PMS(2 mg/mL)、山梨糖少许的90 cm平皿中,37℃避光染色5 min。
1.4 16S rDNA序列扩增与分析[8]
以PQQ产生菌为模板,用16S rDNA通用引物进行PCR,胶回收扩增产物,送北京华大基因科技股份有限公司测序,在NCBI网站进行Blast序列比对分析。
1.5 PQQ产生菌最适培养条件及PQQ产量测定
参考生丝微菌的培养条件[9-10]设计了几种培养基配方(表1~5),考察了甲醇浓度、pH值等对PQQ产生菌生长和PQQ产量的影响。PQQ产生菌按1% 的接菌量接种于1~6号100 mL液体培养基中,30℃、200 r/min摇床培养,每12 h检测菌液D660nm值,绘制菌株在各培养基中的生长曲线,确定生丝微菌T28的最适生长培养基。培养1~3 d,用NBT-Gly法[7]测定PQQ产量;第5~6 d测定菌体离心上清液的D400nm和D326nm值,根据公式PQQ=(D326nm-D400nm)×43.376+0.5126计算PQQ产量。
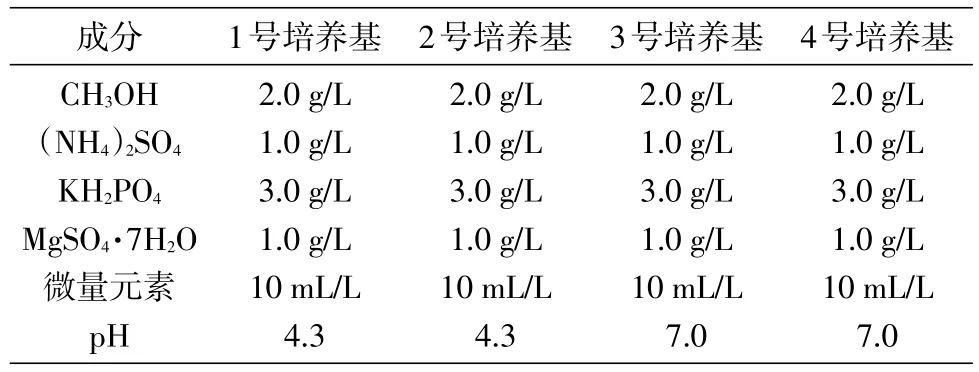
表1 1~4号培养基
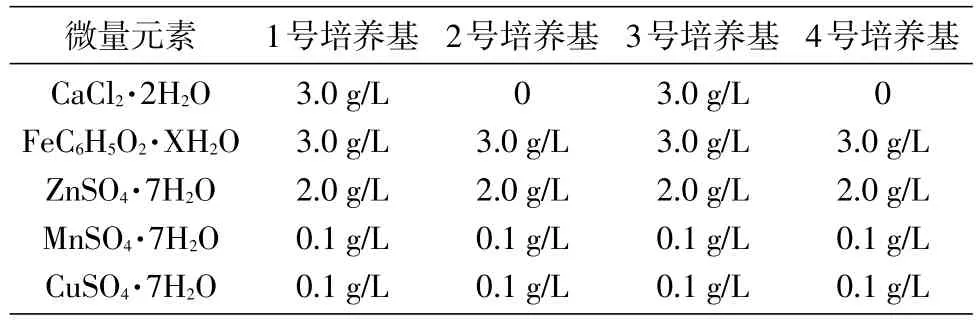
表2 1~4号培养基微量元素

表3 5号培养基

表4 5号培养基微量元素
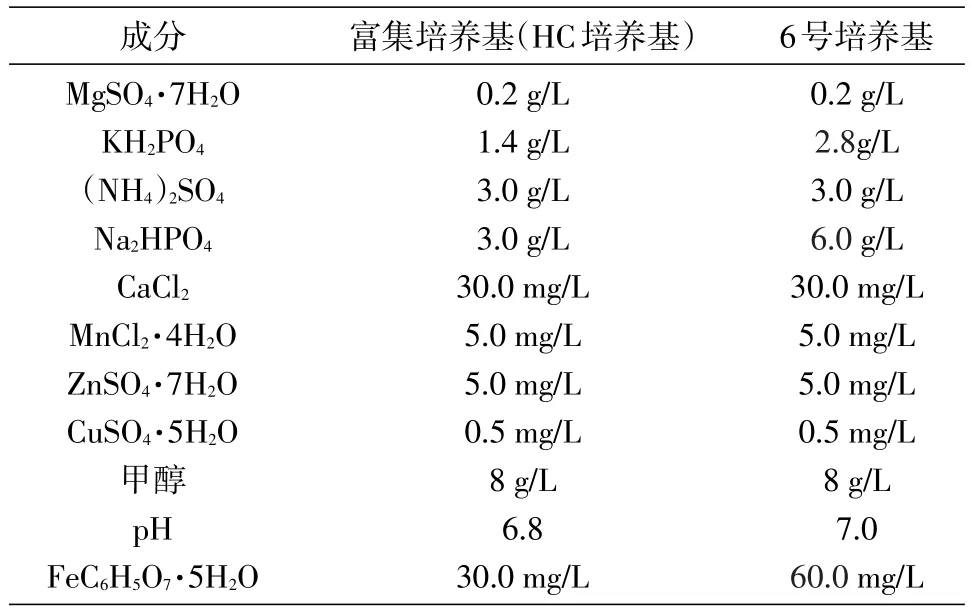
表5 富集培养基(HC培养基)和6号培养基
2 结果
2.1 PQQ产生菌筛选
从不同地区不同环境采集500余个土壤样品,NBT染色法初筛结果发现15个样品反应体系变成蓝紫色(图1)。从15个样品中选择12个颜色较深的样品进行复筛,结果如图2,发现10个样品的菌体裂解液中含PQQ。
2.2 Native-PAGE鉴定菌株产PQQ
以PQQ标准品为阳性对照,取反应较强的10株菌的菌体裂解液进行Native-PAGE后活性染色,结果如图3,编号6、7菌株上清中存在大量PQQ,对应的菌株名为T28、T4。
2.3 16S rDNA序列比对鉴定菌属
以相对PQQ产量较高的T28菌液为模板,采用16S rDNA通用引物进行PCR,扩增产物核酸电泳条带约1500 bp,与预期相符(图4)。PCR产物直接测序,序列经NCBI Blast比对分析,表明T28 16S rDNA序列与生丝微菌同源性最高为96% ,因而将该PQQ产生菌命名为生丝微菌T28,绘制系统发育树如图5。

图1 PQQ产生菌初筛结果
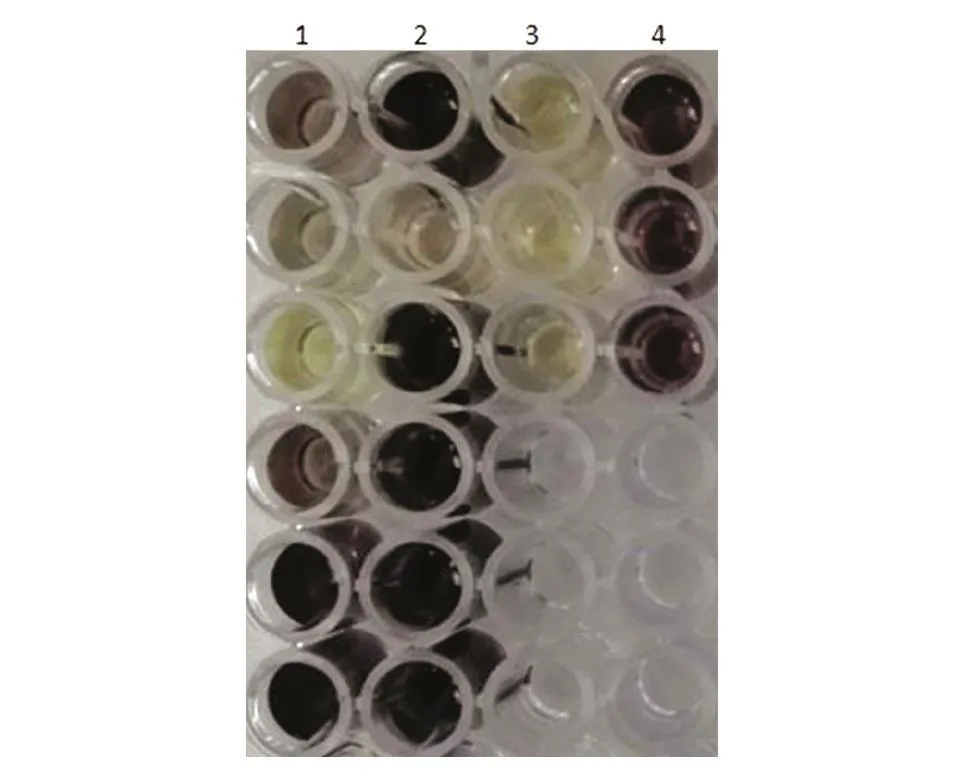
图2 PQQ产生菌复筛结果
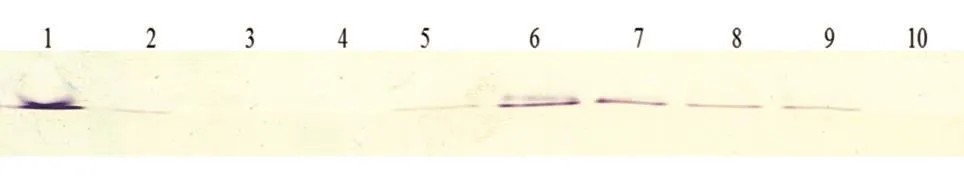
图3 Native-PAGE法定性检测PQQ
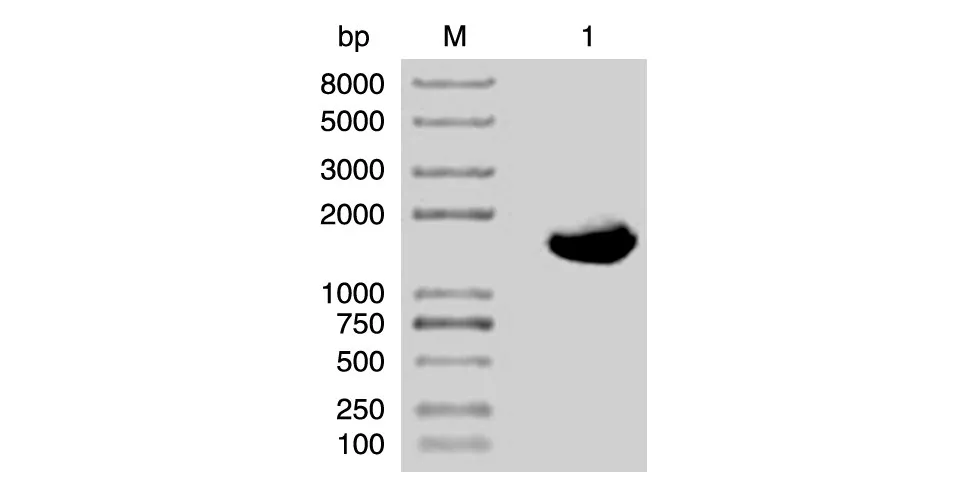
图4 PQQ产生菌16S rDNA电泳图
2.4 生丝微菌T28生长最适培养基
考察1~6号培养基对PQQ产生菌生长和PQQ产量的影响,结果如图6、7。1~4号培养基中菌密度(D660nm值)最终未达到1.3,不是T28最适生长培养基;6号培养基培养144 h时D660nm值达3.57,PQQ产量为2.8 mg/L;5号培养基培养144 h时PQQ产量为13.3 mg/L,且D660nm值最高,为3.93。

图5 PQQ产生菌经Blast比对结果绘制的系统发育树
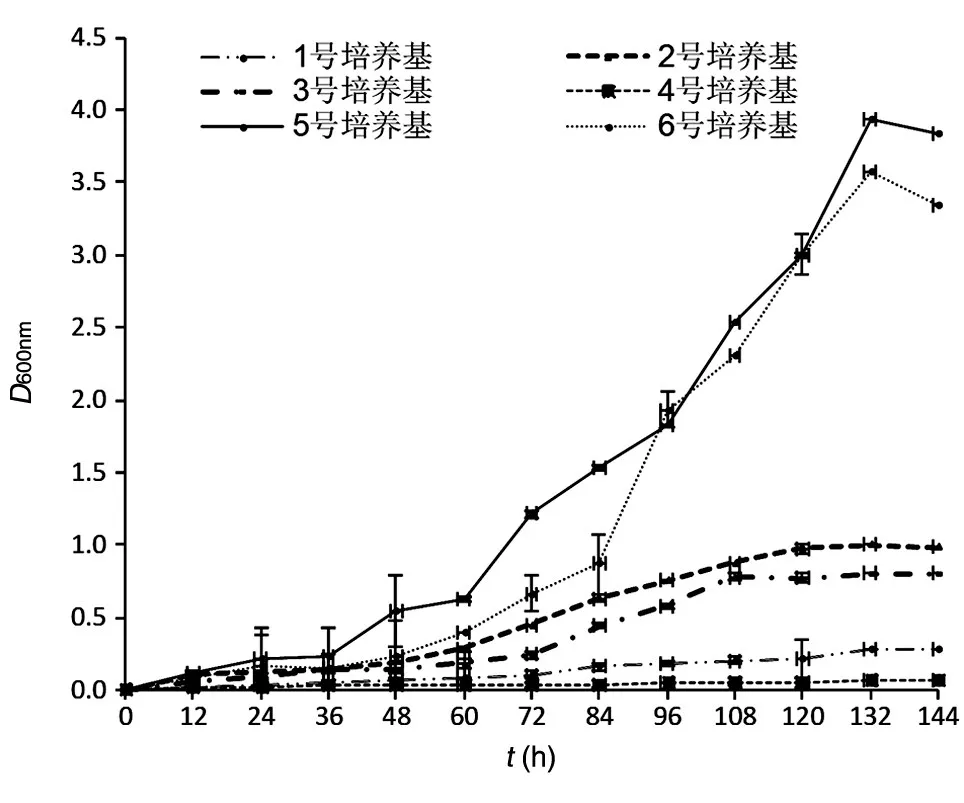
图6 生丝微菌T28生长曲线
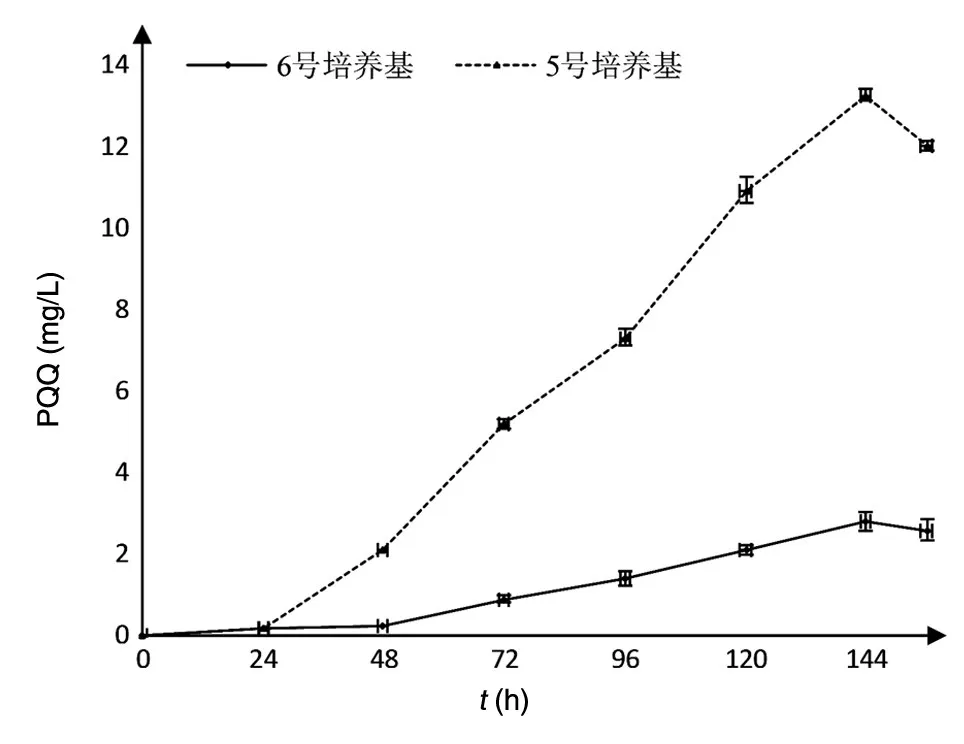
图7 生丝微菌T28的PQQ产量
3 讨论
甲基营养菌在PQQ生产中具有很好的前景,本实验室曾筛选得到1株PQQ产生菌食甲基杆菌MP688,经工艺优化和遗传育种PQQ产量超过2000 mg/L。我们还发现该菌的PQQ合成存在多种调控机制,不同甲基营养菌调控机制存在一定差异。为了研究甲基营养菌PQQ合成调控的一般规律,我们进行了新PQQ产生菌株的筛选。
通过甲醇营养培养基富集、NBT染色和Na⁃tive-PAGE筛选,我们获得了1株新的PQQ产生菌,经16S rDNA序列鉴定,初步确定该菌为生丝微菌。与文献报道的生丝微菌相比,该菌生长较缓慢,经过实验筛选,找到了一种较适宜该菌生长的培养基。我们初步发现该菌PQQ产生条件与本实验室现有的食甲基杆菌MP688存在明显差异,这为我们研究PQQ合成调控的共性和特性提供了新的生物材料。

