miR-19a-3p通过靶向PIK3CB参与调控雌激素受体阳性乳腺癌化疗耐药的相关研究
高洁,李晨曦,赵辉,康欢荣,杜楠
解放军总医院第一附属医院 肿瘤二科,北京 100048
化学药物治疗(化疗)是目前治疗恶性肿瘤的主要手段之一[1-2],而化疗耐受是制约临床肿瘤治疗效果的关键因素[3]。耐药机制包括药物吸收降低或排除增多、药物靶点改变、细胞修复功能增强等,关键基因的突变也可能导致耐药的发生。microRNA(miRNA)作为高度保守的非编码RNA,参与一系列重要的生命过程[4]。已有研究表明miRNA参与调控肿瘤细胞对化疗药物的敏感性[1,5]。
多种化疗药物对乳腺癌有效,但很快会出现耐药。已有研究证实miRNA的异常可能与乳腺癌耐药有关[9-10]。miRNA可通过参与药物转运和代谢来调控肿瘤耐药。Chen等发现miRNA-200c过表达可降低靶标基因MDR1的表达和P-糖蛋白的表达,从而增强阿霉素治疗的敏感性[11]。miRNA可通过参与调控细胞活动相关的蛋白表达促进肿瘤细胞发生耐药。Liang等发现上调miR-19可参与乳腺癌细胞对紫杉醇、VP-16等药物的耐药,是通过抑制PTEN表达阻止细胞凋亡实现的[12]。miRNA可通过参与上皮间质转换(epi⁃thelial-mesenchymal transition,EMT)的发生调控肿瘤耐药。Cochrane等发现miRNA-200c通过抑制靶基因ZEB1的表达进而抑制E钙粘蛋白的表达,促进乳腺癌细胞EMT发生,促进肿瘤对顺铂和紫杉醇发生耐药[13]。以上研究结果表明miRNA与乳腺癌的化疗耐药密切相关,然而其作用机制仍然不清晰,对其进行深入探究或可改善化疗耐药,提高肿瘤治疗的药物敏感度,也一直是乳腺癌化疗耐药的研究热点。
我们发现雌激素受体(estrogen receptor,ER)阳性乳腺癌顺铂耐药的细胞株中miR-19a-3p显著低表达,推测miR-19a-3p在该过程中可能发挥重要作用。本研究探讨了miR-19a-3p在ER阳性乳腺癌化疗耐药中的作用及可能的调控机制。
1 材料与方法
1.1 材料
ER阳性乳腺癌顺铂敏感细胞株MCF7-CTRL和耐药细胞株MCF7-RE为军事医学研究院国家生物医学分析中心免疫学研究室惠赠,正常传代培养;PIK3CB表达质粒pCMV6-PIK3CB购自北京傲锐东源生物科技有限公司;RPMI1640培养基、胎牛血清(FBS)、胰酶购自Gibco公司;miScriptⅡRT Kit、miScript SYBR Green PCR Kit购自 QIA⁃GEN公司;RNA寡核苷酸miRNA类似物和抑制物购自上海吉凯基因化学技术有限公司;转染试剂LipofectAMINE 2000、总RNA抽提试剂TRIzol购自Invitrogen公司。
1.2 MTT实验检测细胞活性
收集处于对数生长期的细胞于96孔板中,每孔接种约5×103细胞,每组设置3个复孔,37℃、5% CO2培养箱中培养24 h,用10 μmol/L顺铂分别处理ER阳性乳腺癌细胞敏感株和耐药株48 h,之后每孔加入15 μL MTT试剂(5 mg/mL),在培养箱中培养3 h,弃去培养基,加入150 μL二甲基亚砜(DMSO),轻轻振荡混匀约10 min至结晶充分溶解,用酶标仪测定每孔的D490nm值,进行数据处理。
1.3 细胞总RNA提取
收取转染48 h后的细胞,用1×PBS缓冲液漂洗3次,加入1 mL TRIzol试剂室温裂解至细胞裂解液变得透亮;加入200 μL氯仿,剧烈振荡10 s,室温静置 5 min;4℃、12 000 r/min离心 15 min;小心吸取上层水相移至新管,加500 μL异丙醇,颠倒混匀后室温静置30 min;4℃、12 000 r/min离心15 min,管底白色沉淀即为总RNA;弃掉上清,加入1 mL 80% 乙醇,上下颠倒混匀;4℃、10 000 r/min离心15 min;弃上清后室温晾干,用DEPC水溶解沉淀;取适量RNA样品稀释后,用紫外分光光度计测定浓度,读取D260nm/D280nm值测定纯度,电泳鉴定RNA的完整性。
1.4 小RNA文库(sRNA)构建及测序
用15% 的PAGE胶分离不同大小片段的RNA,回收18~30 nt的片段,在T4RNA连接酶作用下加5′和3′测序接头将产物反转录为双链并扩增,用PAGE胶对PCR扩增产物切胶回收及纯化,回收产物溶于EB溶液中,完成文库建立。用Agi⁃lent2100 Bioanalyzer和Step One PlusReal-Time PCR System对构建的sRNA文库进行质量及产量评估,用IllumimaHiSeq 2500测序仪完成sRNA文库测序。
1.5 测序数据分析IlluminaHiSeq
IlluminaHiSeq 2500测序得到长度为49 nt的序列,通过数据处理去除3′端缺失、5′端污染、插入片段缺失、含polyA等序列后获得高质量的clean reads。对clean reads的长度、质量和分布等进行统计、分类和注释;通过bowtie将sRNA定位到基因组,分析reads在基因组上的分布及表达情况;用bowtie将reads与miRBase数据库进行比对,注释已知miRNAs;通过bowtie将sRNA和Gen⁃Bank、Rfam数据库比对,注释除miRNA以外的sRNA。
1.6 差异表达miRNA分析
筛选乳腺癌耐药细胞株和敏感株的文库差异表达miRNA,将2个文库中的miRNA归一化处理后进行倍数变化值(fold change)和P值统计计算。筛选显著性差异表达miRNA的具体标准为:①reads数大于 10;②∣log2(fold change)∣>1;③P<0.05。
1.7 实时荧光定量PCR
用miScript SYBR Green PCR Kit检测试剂盒分析miRNA的相对含量。按说明书步骤,采用2 μg总RNA进行反转录,qPCR检测。U6作为内参,通过CT(2-ΔΔCt)方法分析miRNA的相对含量。
1.8 miRNA类似物/抑制物及质粒转染
每孔取20 pmol miRNA类似物/抑制物,稀释于250 μL无血清1640培养基中;按照样品与转染试剂为1∶3的比例将LipofectAMINE 2000转染试剂稀释于250 μL无血清1640培养基中,轻弹混匀,室温静置5 min后加入载体稀释物中,轻弹混匀,室温静置20 min;将样品-转染试剂混合物逐滴加入细胞培养板中,同时设置对照组,转染后48 h提取总RNA。质粒转染操作类似,用量为1 μg/孔(24孔板)。
1.9 Starbase数据调取
选择Starbase v2.0数据库(http://starbase.sysu.edu.cn/)中 miRNA-target interaction 板块 miRNA-mRNA模块,分析miR-19a-3p的靶基因。
1.10 统计学处理
采用SPSS 19.0统计学软件进行数据处理,计量资料用x±s表示,组间数据比较采用t检验分析和方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 顺铂处理对ER阳性乳腺癌细胞活性的影响
10 μmol/L顺铂处理ER阳性乳腺癌耐药细胞株和敏感株MCF7,MTT检测细胞活性,结果如图1所示,耐药株的细胞数量随着处理时间的增加与敏感株相比逐渐增多(P<0.001)。结果说明乳腺癌耐药细胞株对顺铂处理不敏感。

图1 顺铂处理对ER阳性乳腺癌细胞活性的影响
2.2 筛选差异表达miRNA
RNA测序筛选ER阳性乳腺癌耐药细胞株和敏感株差异表达的miRNA(图2),发现miR-19a-3p在耐药株MCF7-CTRL和敏感株MCF7-RE中的表达差异最大,在耐药株MCF7-RE中呈低表达。
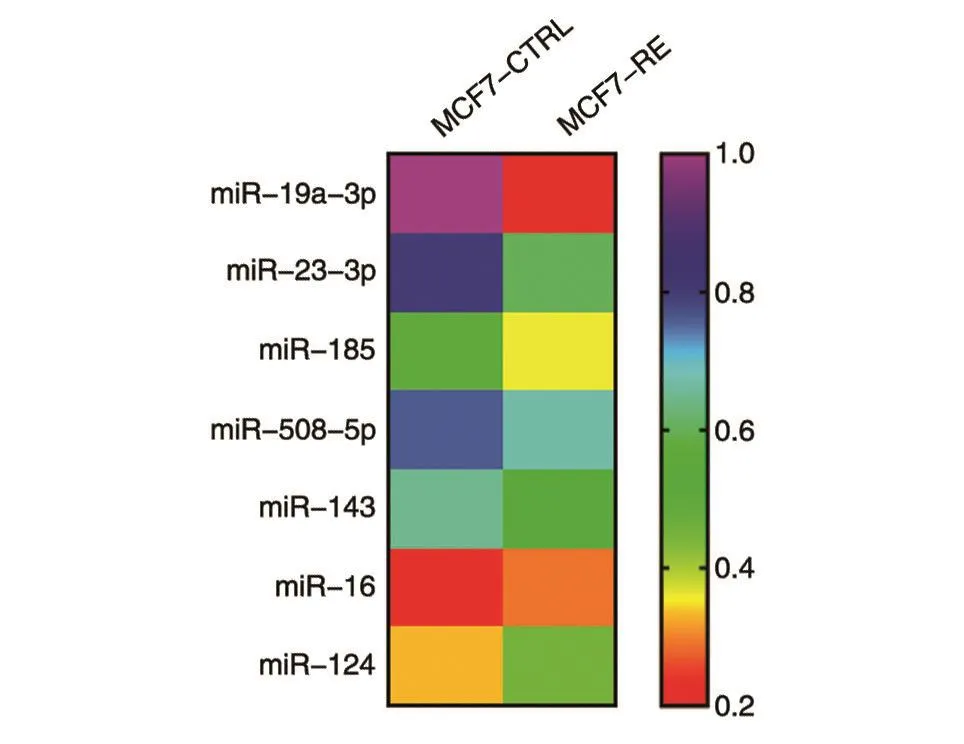
图2 RNA测序筛选差异表达基因
2.3 ER阳性乳腺癌耐药细胞株和敏感株miR-19a-3p的表达
实时荧光定量PCR检测ER阳性乳腺癌耐药株MCF7-RE和敏感株MCF7-CTRL中miR-19a-3p的含量,结果见图3,miR-19a-3p在耐药细胞株中的含量远低于敏感株(**P<0.01)。该结果进一步验证了RNA测序的筛选结果。
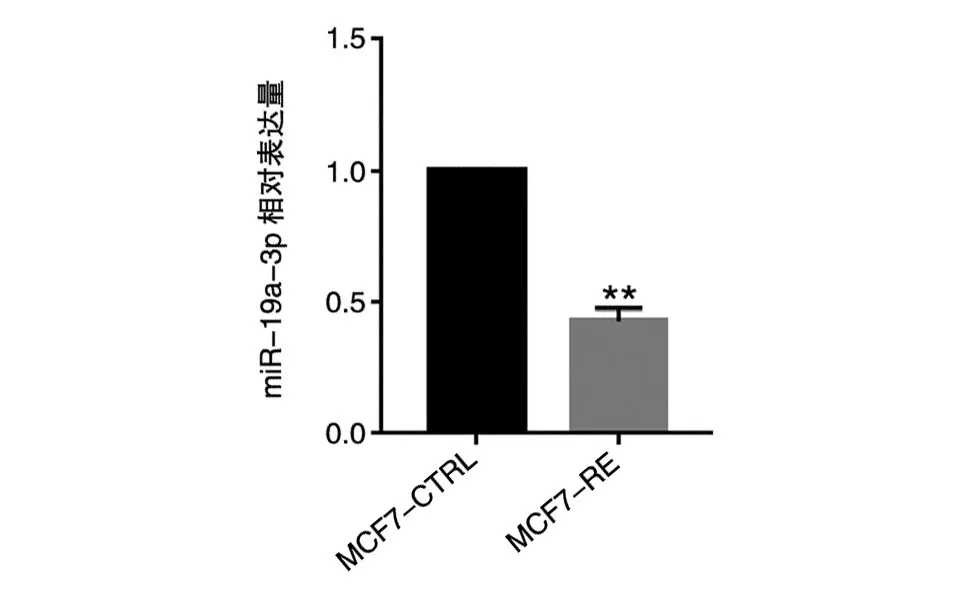
图3 miR-19a-3p在ER阳性乳腺癌耐药细胞株和敏感株中的表达量
2.4 miR-19a-3p过表达降低ER阳性乳腺癌耐药株化疗耐药
合成miR-19a-3p类似物和抑制物,分别转染MCF7-RE和MCF7-CTRL(图4A)。miR-19a-3p过表达可比较明显地降低乳腺癌耐药细胞株的耐药浓度,增加对顺铂药物的敏感度;同时,在敏感株中抑制miR-19a-3p的表达也反过来增加了敏感细胞株的药物作用浓度(图4B,P<0.01)。该结果提示,miR-19a-3p负调控ER阳性乳腺癌细胞顺铂耐药。

图4 miR-19a-3p影响ER阳性乳腺癌细胞的耐药药物浓度
2.5 miR-19a-3p负调控PIK3CB参与乳腺癌化疗耐药
我们对miR-19a-3p参与调控乳腺癌细胞顺铂敏感的作用机制进行了初步研究。通过Star⁃basev 2.0分析发现,在229例乳腺癌样本中,癌基因PIK3CB(PI3K)是miR-19a-3p调控的靶标基因,并且呈负相关(图5A,r=-0.125 75)。PIK3CB是PI3K/Akt信号通路的重要组成成分之一,在肿瘤形成和发展过程中发挥重要作用,如抑制细胞凋亡、促进细胞增殖等。分别转染miR-19a-3p类似物和抑制物,通过实时荧光定量PCR和Western印迹分别在RNA和蛋白表达水平进行了验证,结果显示miR-19a-3p能够负调控PIK3CB(图5B)。在乳腺癌耐药细胞株中,转染miR-19a-3p能够明显降低细胞的耐药性,抑制其增殖;如果同时转染PIK3CB表达质粒进行回复实验,会部分减弱miR-19a-3p耐药抑制的效应(图6)。

图5 miR-19a-3p在乳腺癌细胞中靶向调控癌基因PIK3CB
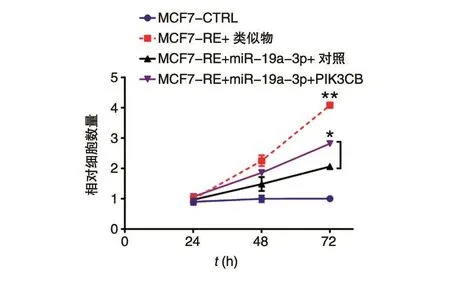
图6 miR-19a-3p负调控癌基因PIK3CB参与乳腺癌细胞化疗耐药
3 讨论
目前乳腺癌的治疗方式是以手术、内分泌治疗[6]、化疗和靶向治疗等多种手段结合的综合治疗[1]。研究表明,约70% 的乳腺癌患者会出现化疗耐药或在接受治疗后很快出现化疗耐药[7-8]。无论是初始耐药还是获得性耐药,都会影响乳腺癌患者的生活状态和生存时间。
然而截至目前化疗耐药的机制并不十分清楚。大量研究表明,miRNA在肿瘤发生发展中可通过多种途径发挥促癌或抑癌作用,这其中一些病理、生理过程与肿瘤化疗耐药密切相关,可见miRNA也参与肿瘤化疗耐药的发生[2]。
我们通过RNA测序发现,在化疗耐药的ER阳性乳腺癌细胞耐药株和敏感株中,miR-19a-3p的含量差异显著。通过qPCR对ER阳性乳腺癌耐药株和敏感株进行检测,证实miR-19a-3p在耐药株中低表达。进而初步分析miR-19a-3p负调控乳腺癌化疗耐药的机制,通过Starbase v2.0调取TCGA数据库中miR-19a-3p的相关数据,预测癌基因PIK3CB是miR-19a-3p的靶标基因并呈负相关,后续我们证明miR-19a-3p的确能够靶向PIK3CB并与乳腺癌细胞的顺铂耐药相关。在回复实验过程中,过表达PIK3CB能够部分抵消miR-19a-3p的耐药抑制性,一方面说明miR-19a-3b/PIK3CB调控耐药性的通路的确存在,另一方面说明存在miR-19a-3p靶向其他潜在靶标参与耐药调控的可能性。由于miRNA作用靶标众多,具有多能性,我们后续的工作须扩大筛选范围,尽可能探索与描绘miR-19a-3p在乳腺癌中的功能性调控网络,而不是局限于对PIK3CB的调控研究,这将有助于深入解析miR-19a-3p调控ER阳性乳腺癌化疗耐药的机制,为临床预防或治疗ER阳性乳腺癌提供新的靶点。

