芯片法和飞行时间质谱法在非综合征性耳聋基因筛查中的应用比较*
付华钰,李 娇,李 萌,许涓涓,黄萍丽,陈碧艳,杜 娟
(广西壮族自治区妇幼保健院,南宁 530003)
我国每年约出生2 000万个新生儿,据资料显示,约有1‰新生儿患先天性耳聋[1],每年将新增约2万名听力障碍新生儿,其中60%与遗传因素有关[2-4]。韩明昱等[5]研究显示,我国常见耳聋基因携带率为5.3%。周怡等[1]对北京地区新生儿筛查,耳聋基因的携带率为3.6%。耳聋对患儿的认知、学习、交流能力有严重影响,在成长过程中的教育、治疗等费用支出巨大,给社会和家庭造成了严重的负担。因此,开展孕前和孕期夫妇耳聋基因筛查,并对高风险孕妇进行产前诊断、遗传咨询和医学干预,才是早期预防、减少耳聋患儿出生的有效措施之一。
非综合征性耳聋是指以耳聋为唯一症状的疾病,多为中重度、极重度感音神经性聋[6]。目前国内常见导致遗传性非综合征性耳聋的致病基因为GJB2、GJB3、SLC26A4和线粒体12S rRNA等[7]。目前用于耳聋基因筛查的方法有很多种,如测序法、变性高效液相色谱分析、限制性片段长度多态性分析、限制性酶切指纹-单链构象多态性分析、芯片法以及飞行时间质谱法[8]。前3种方法成本高、操作复杂,不适于临床应用和大规模筛查。芯片法可检测中国人常见的4个耳聋致病基因的9个位点。飞行时间质谱法的全称为基质辅助激光解吸电离飞行时间质谱,该技术可检测常见的4个耳聋基因的20个位点。本研究旨在探讨芯片法和飞行时间质谱法在耳聋基因筛查中的作用。现报道如下。
1 资料与方法
1.1一般资料 选择2014年5月至2015年4月在本院耳鼻喉科、儿科、遗传门诊就诊并自愿接受耳聋基因筛查的儿童、成人及胎儿,共710例。其中男371例,女335例,胎儿4例;年龄1~44岁,中位年龄21.6岁。
1.2方法
1.2.1标本采集 采集受检者外周静脉血4 mL、抽取胎儿羊水10 mL。
1.2.2提取DNA 将外周血和羊水离心后的沉淀细胞按照Qiangen公司DNA提取试剂盒说明书,经裂解、吸附、洗脱、溶解的步骤,提取标本DNA。并用紫外光分光光度计测定DNA溶液的浓度和纯度。
1.3基因检测
1.3.1芯片法 采用博奥生物工程有限公司的晶芯九项遗传性耳聋基因检测试剂盒(微阵列芯片法)进行检测。主要仪器、设备:聚合酶链反应(PCR)仪、晶芯BioMixerⅡ杂交仪、晶芯Slide Washer芯片洗干仪、晶芯LuxScan 10K-B芯片扫描仪和数据判别系统(博奥生物工程有限公司)。该微阵列芯片包含9个检测位点,具体位点见表1。根据试剂盒说明进行核酸扩增、杂交、洗片、扫描及信号读取。根据说明书进行结果判读。

表1 芯片法的检测位点
1.3.2飞行时间质谱法 与华大基因公司合作,借助其飞行时间质谱的技术和设备进行基因检测。仪器设备:Mass ARRAY DNA质谱阵列基因分析系统、ABI 3130XL测序仪、PCR仪、Mass ARRAY微量点样系统以及试剂盒。样本DNA进行提取、扩增、消化、延伸和纯化,产物质谱检测(详细步骤参照Sequenom Spectro CHIP Arrays操作说明书),最后测序和数据分析。检测20个耳聋基因位点,具体位点见表2。
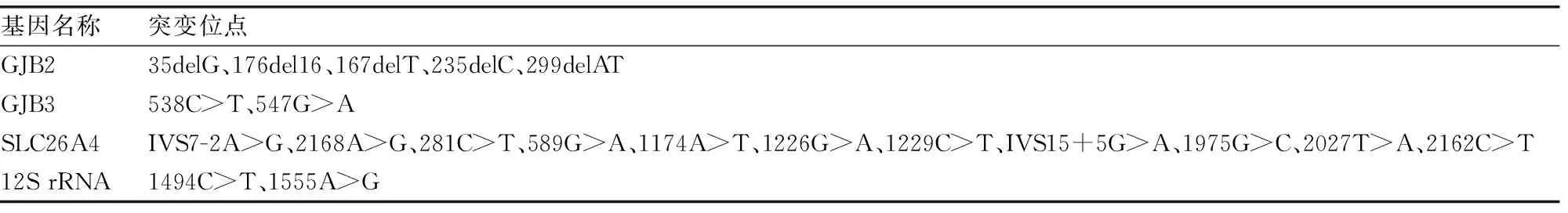
表2 飞行时间质谱法的检测位点
1.4统计学处理 采用SPSS19.0统计软件进行统计分析,计数资料以率或例数表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
710例研究对象中,芯片法检出异常37例,其中杂合突变25例,纯合/同质突变11例,235delC杂合突变复合1555A>G同质突变1例;飞行时间质谱法检出异常45例,其中杂合突变32例,纯合/同质突变11例,235delC杂合突变复合1555A>G同质突变1例和1229C>T与 1975G>C双重杂合突变1例。两种方法的检出率比较,差异无统计学意义(P>0.05)。见表3、4。
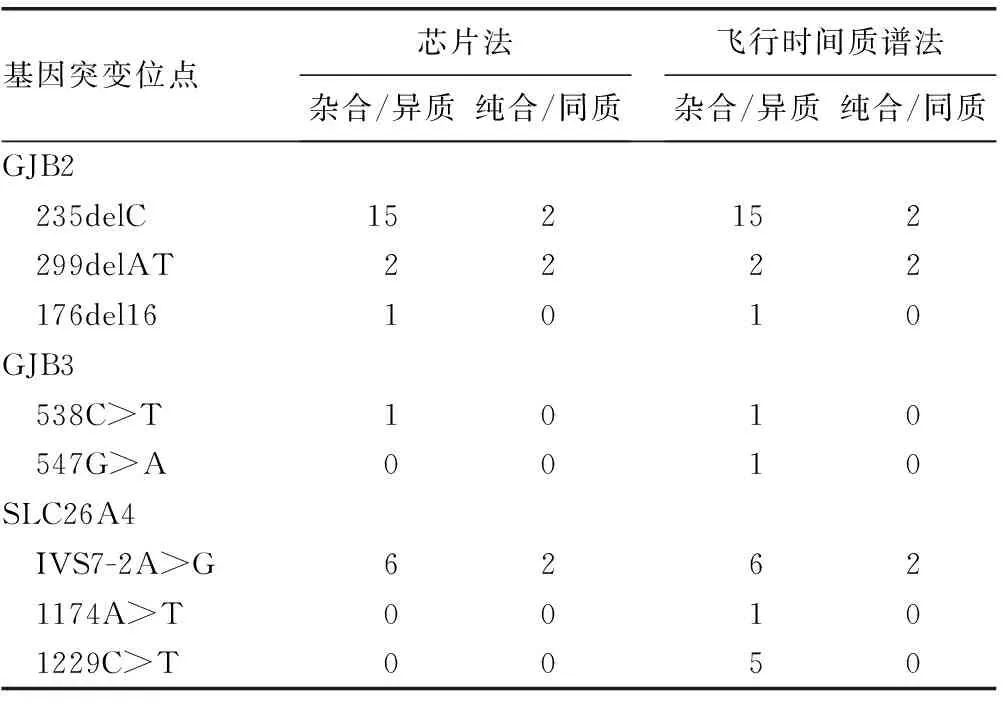
表3 两种方法的检测结果(n)
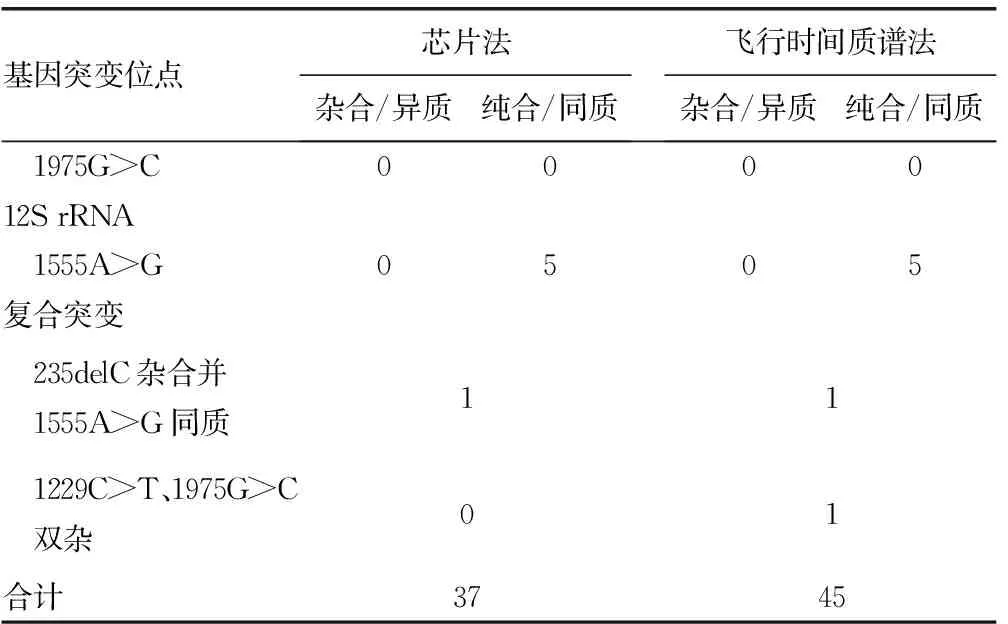
续表3 两种方法的检测结果(n)
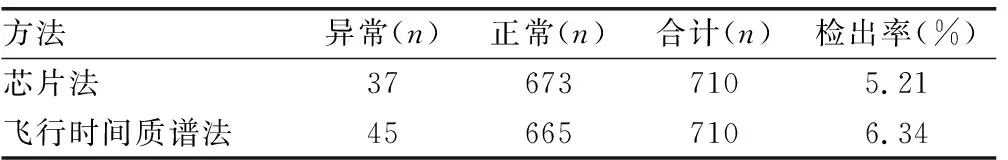
表4 两种方法的检出率比较
3 讨 论
中国人群中常见的非综合征性耳聋致病基因GJB2、GJB3、SLC26A4和线粒体12S rRNA中,GJB2基因突变发生率最高,占26%~33%,其中主要为235delC、299delAT、176del16;SLC26A4基因常见突变为IVS7-2A>G,本研究的结果与文献[9-10]报道结果是一致的。本研究中应用芯片法和飞行时间质谱法进行耳聋基因筛查,芯片法的检测结果中,GJB2的检出率为3.24%,其次为SLC26A4,检出率为1.13%。飞行时间质谱法的GJB2的检出率与芯片法相同,SLC26A4基因突变的检出率略高,为2.11%。飞行时间质谱法包含的检测位点多,检出的基因携带者例数较芯片法高,但以上2种方法的检测结果,差异无统计学意义(P>0.05)。这两种方法均包含了以上常见基因及其位点,虽然飞行时间质谱法所含的基因位点更多,但芯片法的9个突变位点已经可以满足临床普通筛查的需要,这与统计学的结果:两种方法差异无统计学意义(P>0.05)是相符的。
耳聋基因筛查的目的是发现高危人群、预防疾病发生、降低出生缺陷。若儿童筛查的结果为基因纯合突变、双重杂合突变或线粒体同质突变,可进行相应的治疗改善其听力,或采取预防措施,避免患儿听力受损。对于双方均为基因携带者的夫妇,可进行相应的遗传风险咨询和婚育指导,必要时进行产前诊断,可避免耳聋患儿出生,以降低耳聋发生率。不同的基因发生突变,其导致耳聋的机制是不同的,预防和治疗的措施也是不同的。
GJB2位于染色体13q11-12,为常染色体隐性遗传,编码连接蛋白CX26,负责细胞间的信号传导,维持耳蜗内淋巴液高钾形成的正电位,保证细胞的正常功能。当GJB2基因发生突变后,编码连接蛋白CX26产量下降,直接影响K+进入淋巴系统循环,从而导致神经性耳聋[11]。GJB3位于1号染色体1p33-35,为常染色体隐性或显性遗传,编码缝隙连接蛋白CX31,该基因发生致病性突变可导致高频听力损失[6]。SLC26A4位于7号染色体7q22-31.1,常染色体隐性遗传,编码蛋白质Pendrin,SLC26A4基因致病性突变可导致Pendred综合征或大前庭导水管综合征。大前庭导水管综合征主要表现为迟发性语后聋。12S rRNA为中国人群中常见的线粒体耳聋致病基因[11],为母系遗传,携带该基因的个体对氨基糖苷类抗菌药物具有高度的敏感性。致病突变在12S rRNA的A区形成一个新的结合碱基对,使12S rRNA的二级结构与细菌的16S rRNA更为相似,新结合碱基对促进了氨基糖苷类药物与线粒体12S rRNA相结合,抑制线粒体蛋白合成、使ATP产量下降,细胞内外离子浓度失衡,导致细胞损伤或凋亡[7],使得携带该类突变的个体在使用氨基糖苷类药物后会发生听力缺失[11]。本研究主要通过对比线粒体12S rRNA、SLC26A4、GJB2、GJB3 4个基因致病位点的检出率,探讨芯片法和飞行时间质谱法在非综合征性耳聋基因筛查的优劣,为临床疾病筛查工作提供相关依据。
我国人口众多,耳聋基因的携带率和耳聋发病率均较高,因此开展耳聋基因筛查、降低耳聋发病率是一项长期而艰巨的任务。本研究中应用的两种筛查方法各有其优、缺点。芯片法包含了常见耳聋基因的9个突变位点,该方法所需的仪器设备少,成本低,操作和数据读取简单,适用于在临床工作中进行常规筛查。飞行时间质谱法涵盖了4个常见基因的20个位点,可检测范围广,检出率高,可以在一定程度上降低漏诊率,可应用于大规模人群的筛查和研究[12]。但该方法所需的仪器设备成本较高,且操作流程复杂,需要专业技术人员进行操作和读取数据,推广至一般的医疗机构有一定的困难。
随着人们优生优育意识的提高和医学的不断进步,耳聋基因筛查将会广泛地进行开展,各医疗或研究机构可根据自身的条件选择筛查的方法。总之,医务工作者的目标是通过耳聋基因筛查,做到早发现、早预防,早诊断、早治疗,尽可能地保护患儿听力,降低耳聋发病率及出生率。

