RNA结合基序蛋白25在肺腺癌组织中的表达及与预后的关系
韩学艳,李 畅
(南京医科大学附属淮安第一医院检验科,江苏淮安 223001)
肺腺癌是非小细胞肺癌主要的组织学亚型,由于其早期临床症状不明显,并缺乏有效的治疗手段,因此仍然是导致患者死亡的重要原因[1]。手术切除被认为是治疗肺腺癌较为激进的手段,但由于大多数患者在住院期间即被诊断为进展期肺腺癌,往往失去了根治性手术的机会[2]。此外,化学治疗和放射治疗是标准的一线和二线治疗肺腺癌手段,但疗效尚不理想。在美国,只有约15%的患者在被诊断为肺腺癌后5年后仍可存活[3]。因此,寻求肺腺癌新的治疗手段迫在眉睫,而功能基因和生物学标志物作为近年来肿瘤研究的热点,给肺腺癌患者的诊断和治疗提供了新的方向。
剪接因子RNA结合基序蛋白25(RBM25)在真核生物中的表达较为保守[4]。据报道,其可通过调节基因BCL2L1的促凋亡和抗凋亡转录物的平衡来促进HeLa细胞凋亡[5],并可在心力衰竭期间导致SCN5A编码的心电压门控钠离子通道截断[6]。但关于RBM25在肺腺癌中的表达和作用目前鲜见研究报道。本研究观察了RBM25在肺腺癌组织中的表达情况,并分析其表达与患者临床病理参数以及预后之间的相关性,现报道如下。
1 资料与方法
1.1一般资料 包含75对肺腺癌组织(肺腺癌组)及对应癌旁组织(癌旁组)的芯片购自上海芯超科技有限公司,包括完整的临床病理资料,如年龄、性别、淋巴结转移情况、肿瘤大小、TNM分期和随访资料等,患者术前均未经化学治疗和放射治疗。
1.2仪器与试剂 兔抗人RBM25抗体(稀释倍数1∶100)、Ki-67抗体(稀释倍数1∶100)、B细胞淋巴瘤2(Bcl-2,稀释倍数1∶100)和鼠抗兔二抗均购于Sigma公司,免疫组织化学试剂盒购自上海威奥生物科技有限公司。
1.3方法 免疫组织化学检测:芯片经65 ℃烤片15 min后,使用二甲苯脱蜡,并用梯度乙醇脱水,5%的过氧化氢溶液浸润,放置于37 ℃湿盒中孵育15 min;经磷酸盐缓冲液(PBS)冲洗后放置于0.01 mol/L枸橼酸缓冲液(pH=6.0)中煮沸,自然冷却30 min用于抗原修复,使用羊血清工作液封闭,滴加一抗4 ℃冰箱孵育过夜(每次试验均用已知阳性片作阳性对照,用PBS代替一抗作为阴性对照),滴加生物素标记二抗,37 ℃孵育30 min;再滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育30 min,使用二氨基联苯胺(DAB)显色。
免疫组织化学结果判定:将各组的染色切片在光镜下观察、评分,同时进行病理图像采集。RBM主要定位在细胞核,综合低倍镜下染色强度和高倍镜下阳性细胞百分数进行半定量测定。染色强度评分标准:基本不着色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。阳性细胞数百分比评分标准:组织芯片置于显微镜下计数200个细胞,阳性细胞百分数<10%为0分;>10%~40%为1分;>40%~70%为2分;>70%为3分。两者相加0~2分评为阴性;>2~6分为阳性[7]。结果由2位有资质的病理科医师进行判读,阴阳性判断不一致时,以第3位病理科医师的判读结果为准。
1.4统计学处理 采用SPSS17.0统计软件进行分析。计数资料以率或例数表示,组间比较采用χ2检验或Fisher精确概率法;相关性分析采用Spearman等级相关分析;采用Kaplan-Meier法评估总生存期,组间生存期的比较采用Log-Rank法。以P<0.05为差异有统计学意义。
2 结 果
2.1两组RBM25、Ki-67和Bcl-2的表达情况 肺腺癌组中的RBM25阳性率为13.3%,低于癌旁组织中的93.3%,差异有统计学意义(P<0.05)。肺腺癌组中的Ki-67和Bcl-2阳性率均为42.7%,高于癌旁组的6.6%和9.3%,差异有统计学意义(P<0.05)。见表1和图1。
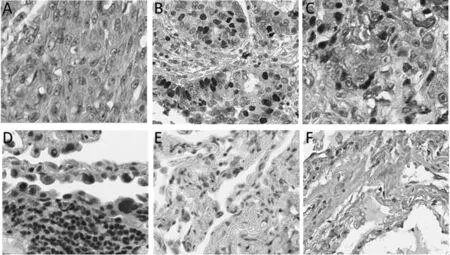
注:A为RBM25在肺腺癌组织中的表达;B为Ki-67在肺腺癌组织中的表达;C为Bcl-2在肺腺癌组织中的表达;D为RBM25在癌旁组织中的表达;E为Ki-67在癌旁组织中的表达;F为Bcl-2在癌旁组织中的表达
图1 RBM25、Ki-67和Bcl-2阳性表达(SP,×200)
2.2不同临床病理参数间RBM25、Ki-67、Bcl-2阳性率比较 肿瘤直径>3 cm、TNM分期Ⅲ~Ⅳ期的RBM25阳性率明显低于肿瘤直径≤3 cm、TNM分期Ⅰ~Ⅱ期的阳性率;肿瘤直径>3 cm、病理分级低分化的Ki-67阳性率明显高于肿瘤直径≤3 cm、病理分级高分化的阳性率;肿瘤直径>3 cm的Bcl-2阳性率明显高于肿瘤直径≤3 cm的阳性率,差异均有统计学意义(P<0.05)。RBM25的阳性率与患者的性别、年龄、病理分级、淋巴结转移无关;Ki-67的阳性率与患者的性别、年龄、淋巴结转移、TNM分期无关;Bcl-2的阳性率与患者的性别、年龄、病理分级、淋巴结转移、TNM分期无关(P>0.05)。见表2。
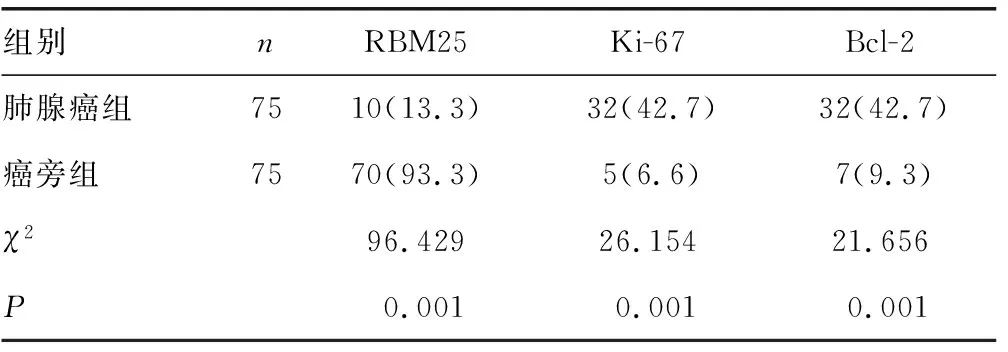
表1 两组RBM25、Ki-67和Bcl-2阳性表达比较[n(%)]
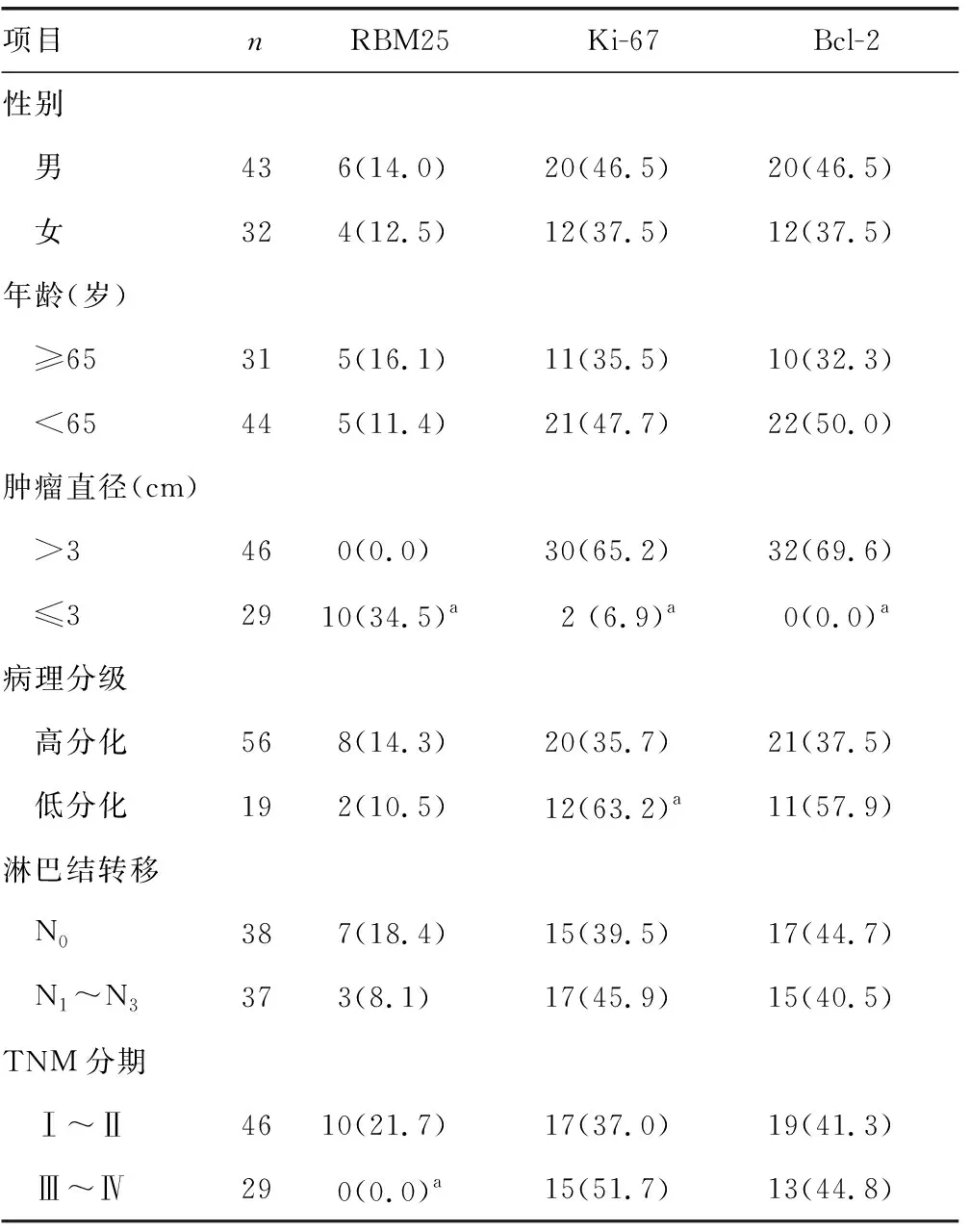
表2 不同临床病理参数间RBM25、Ki-67、Bcl-2阳性率比较[n(%)]
注:与同组内指标比较,aP<0.05
2.3肺腺癌组中RBM25阳性表达与患者预后生存的关系 肺腺癌组中RBM25阳性表达患者的累积生存率为60.00%,高于阴性表达患者的26.15%(χ2=3.905,P=0.048)。见图2。
2.4肺腺癌组织中RBM25、Ki-67和Bcl-2表达之间的相关分析 结果显示,RBM25水平与Ki-67和Bcl-2均呈负相关(r=-0.259、-0.338,P<0.05)。
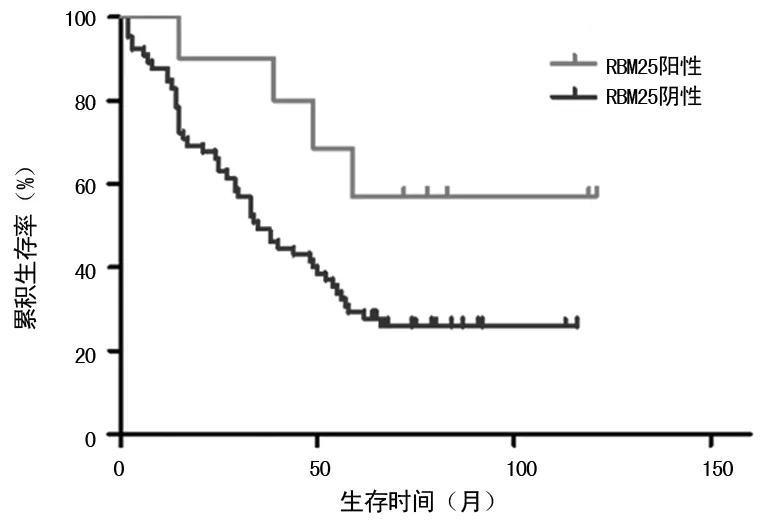
图2 RBM25不同表达患者的生存函数图
3 讨 论
肺腺癌是全球十大主要死亡原因之一。根据世界卫生组织的报告,2011年有超过150万人死于肺腺癌[3]。由于肺腺癌患者早期症状不明显,并且治疗手段的选择相对有限,绝大多数患者5年生存率不容乐观[8]。因此,寻找肺腺癌可靠的预后标志物和有效的治疗靶点迫在眉睫。
前体mRNA的可变剪接过程,使得单个基因产生多个mRNA剪接体,是增加蛋白质多样性和调控基因表达的关键机制[9]。大部分RNA结合蛋白可以通过识别位于外显子或内含子中的调节元件以及与剪接体因子或其他剪接调节物相互作用来影响剪接位点的选择[8]。约95%的人类基因具有可变剪接的形式,提示可变剪接对人类基因组功能多样性具有重要的作用[10]。现报道,包括肿瘤[11]、神经退行性疾病[12]、自身免疫性疾病[13-14]均与可变剪接有关。RBM25属于一类RNA结合蛋白家族,其成员都拥有精氨酸-谷氨酸/精氨酸-天门冬氨酸的中心区域和C-末端脯氨酸-色氨酸-异亮氨酸基序[5]。RBM25定位于细胞核并与多个剪接组分相关联,RBM25的特征表明其在mRNA的可变剪接中起重要作用,并且这种调控是具有基因特异性的[5]。RBM25在肺腺癌中的研究目前较少有研究报道,因此探讨RBM25在肺腺癌中的作用是一项有意义的工作。
本研究结果显示,肺腺癌组织中RBM25的表达明显低于癌旁组织,进一步统计学分析结果显示,肺腺癌中RBM25的表达与肿瘤的直径、TNM分期、Ki-67和Bcl-2水平相关,肿瘤组织中RBM25表达越低,肿瘤直径越大,提示RBM25与肿瘤增殖相关。Bcl-2抑制细胞凋亡,也是肿瘤预后指标,高表达者对多数化疗药物和放射治疗耐受[15],RBM25的表达越高,Bcl-2表达越低,提示RBM25可能是通过影响细胞凋亡来促进肿瘤细胞增殖,与ZHOU等[5]发现RBM25可以通过影响Bcl-2的表达来增强细胞凋亡进而抑制HeLa细胞增殖的报道相类似。RBM25的表达越低,TNM分期越高,提示RBM25参与了肺腺癌的发展。Ki-67定位于细胞核,由于其表达变化具有周期性,在有丝分裂期间水平达到高峰,因而被用作细胞增殖的标志物[16],肿瘤组织中RBM25水平与Ki-67的表达呈负相关,提示RBM25也有可能是通过影响细胞有丝分裂来影响细胞增殖。本研究结果显示,RBM25、Ki-67和Bcl-2与肿瘤增殖相关,并且RBM25还与TNM分期相关,Ki-67与病理分级相关,提示RBM25在预估患者临床进程方面较Ki-67和Bcl-2更有优势。虽然近年来肺腺癌患者总体生存时间不断提高,但是在接受标准化治疗后,部分肺腺癌患者仍然会发生局部复发和远处转移,这突出了肺腺癌患者预后评估的重要性。生存分析结果表明,肺腺癌组织中RBM25的表达与患者累积生存时间呈正相关,RBM25表达越高,肺腺癌患者累积生存时间越长。这些研究结果表明,RBM25可作为肺腺癌患者预后的标志,结合RBM25的表达检测与目前肺癌的评估系统可能会为准确预测患者的预后和改善个性化治疗方案提供新的途径。
综上所述,RBM25在肺腺癌组织中低表达,并且其低表达可能与肿瘤增殖、TNM分期及患者预后相关,提示RBM25与肺腺癌的发生、发展相关。本研究今后需要进一步增加样本量,在体外细胞层面和体内试验中进一步验证RBM25与肿瘤增殖之间的关系,并探讨RBM25调控肺腺癌增殖的机制,以及RBM25是否能成为肺腺癌患者预后评估的标志物。

