高分辨薄层直肠核磁共振新序列(3.0T RESOLVE-DWI)在直肠癌临床分期中的价值评估
丁静静 罗金龙,2 曾瑞腾 孙家瑜 邢丽红 张洪静 刘雪婷 李媛 杨烈周总光
结直肠癌(colorectal cancer,CRC)是危害人类健康的常见恶性肿瘤,在全球范围内发病率分居男性、女性恶性肿瘤的第3、第2位。在中国,结直肠癌发病率和死亡率均位居恶性肿瘤第5位,呈逐年递增趋势,年增长率分别为4.2%、1.6%[1]。早诊早治和规范化诊疗是降低结直肠癌死亡率的根本途径。按照规范化诊疗要求,应采用影像学进行准确的TNM临床分期,根据不同分期制定个体化综合治疗方案。对于直肠癌,临床分期为Ⅰ期的患者可直接行根治性手术,而Ⅱ/Ⅲ期患者大多数需行新辅助放化疗[2]。直肠癌的影像学评估手段包括CT、经直肠腔内超声和MRI。CT的主要价值在于进行胸腹部远处脏器的评估,即M分期,对于肿瘤局部T、N分期的准确性低。MRI和经直肠腔内超声对于肿瘤局部T、N分期的诊断准确性优于CT,但经直肠腔内超声的准确性受操作者的经验、水平影响大,且不能提供直观的影像学资料,普通盆腔MRI受到扫描角度、层厚、分辨率等局限,对于T、N分期的价值也有限。
直肠高分辨薄层MRI针对直肠采用多角度扫描、层厚更薄、空间分辨率更高,评估T、N分期的准确性显著优于普通盆腔MRI,是目前进行直肠癌T、N分期的最佳影像学手段[3]。但是,目前直肠高分辨薄层MRI在直肠癌术前分期中存在以下问题:(1)现有序列分辨率、精度有待提高,限制了分期的准确性;(2)MRI术前T分期的准确性尚缺乏研究数据;(3)表观弥散系数(apparent diffusion coefficient,ADC)与肿瘤 T 分期的相关性尚不明确,ADC值在判断转移性淋巴结中的价值存在争议。近期,西门子公司推出了MRI新序列(3.0T RESOLVE-DWI)(https://static.healthcare.siemens.com),新序列具有显著提高分辨率和清晰度,可望提高直肠癌术前T、N分期的准确性。本研究旨在评估高分辨薄层直肠MRI新序列(RESOLVE-DWI)对直肠癌术前临床T分期判断的准确性,ADC值与肿瘤T、N分期及分化程度的相关性。
资料与方法
一、临床资料
收集2015年7月至2016年6月四川大学华西医院收治的直肠癌病例。纳入标准:(1)病理确诊直肠癌;(2)已经行直肠癌根治性手术;(3)行术前直肠RESOLVE-DWI扫描;(4)有完整的术后病理报告。排除标准:(1)非行直肠癌根治性手术;(2)行新辅助治疗后未行再次行术前RESOLVEDWI扫描;(3)RESOLVE-DWI图像质量差。以术后肿瘤标本的病理检查结果为准,按照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(The Union for International Cancer Control,UICC)结直肠癌TNM分期(2009)标准进行分期[4-5]。T分期按照 T1~T2,T3,T4分为三组;肿瘤分化程度按照低-中分化,中-高分化分为两组;肿瘤N分期按照有无淋巴结转移分为两组;所有患者均按照术前是否行新辅助治疗分别进行统计分析。
二、影像学资料
(一)设备及扫描参数
采用Siemens 3.0T Skyra MR扫描仪,Body 18通道相控阵列线圈。检查前2 h肛注开塞露清肠道,肠腔内不使用任何对比剂,检查时嘱患者尽量保持平静呼吸,减少身体运动。扫描序列及相关参数:轴位T2WI及DWI。T2WI轴位(与病变肠道垂直且包全盆腔),TR 4 680 ms,TE 96 ms,矩阵(Matrix)384×281,视野(FOV)236 mm×260 mm,层厚3 mm。RESOLVE-DWI,TR5 000 ms,TE 66 ms,矩阵(Matrix)128×128,视野(FOV)216 mm×216 mm,层厚4.5 mm,b值为0 s/mm、600 s/mm、1 000 s/mm。
(二)数据采集及ADC值测量
由两位放射科磁共振诊断医师在不清楚知病理结果的前提下分别对75例直肠癌患者进行T、N分期评估及ADC值测量,意见不一致时协商取得一致。根据T2WI图像进行T分期,ADC值根据DWI图像,分别于直肠肿瘤及直肠周围淋巴结手动画定感兴趣区(region of interest,ROI),并将ROI复制到ADC图上,测量整个肿瘤及周围淋巴结ADC值,并取两者平均值。ROI选取的基本原则:(1)ROI的形态主要根据病灶的具体形态来决定;(2)ROI的大小和位置的选择应围绕病灶一周大于总面积的2/3,避开空洞、肠腔气体内容物及液化坏死物;(3)淋巴结/癌结节ADC值测量主要是>2 mm的结节[6](图1)。
三、统计学分析
所有数据应用SPSS 22.0(Chicago,IL)处理,数据正态性检验采用单样本正态分布检验,计量资料以均数±标准差表示,病理T分期与MRI T分期一致性比较采用Kappa检验,κ大于0.75认为一致性较好。ADC值与病理结果比较采用单因素方差分析,方差不齐时采用秩和检验,以P<0.05表示差异具有统计学意义。
结 果
一、一般资料
共收集75例直肠癌,其中,男性患者49例,女性患者26例,平均年龄(61.81±12.39)岁;行新辅助放疗5例,未行新辅助化疗2例,行新辅助放化疗10例,均未行术前化疗58例;肿瘤下缘距肛缘距离(3.93±1.31)cm;术后病理TNM分期(pTNM)为Ⅰ期3例,Ⅱ期11例,Ⅲ期40例,Ⅳ期21例。
二、MRI T分期与病理的T分期对比
患者病理T分期与MRI T分期对照见表1。在未行新辅助治疗组,病理分期为T1期的4例,MRI分期3例为T2、1例为T3,准确率为0;病理分期为T2期21例,MRI分期为T2期8例,准确率为38.1%;病理分期为T3期25例,MRI分期为T3期18例,准确率为72%;病理分期为T4期7例,MRI分期为T2期1例、T3期5例、T4期1例,准确率为14.3%,Kappa一致性检验显示,病理T分期与MRI T分期一致性κ值为0.200。在行新辅助治疗组,病理分期为T1期的2例,MRI分期1例为T1,准确率为50%;病理分期为T2期3例,MRI分期为T2期1例,准确率为33.3%;病理分期为T3期12例,MRI分期为T3期9例,准确率为75%;病理分期为T4期1例,MRI分期为T3期1例、T4期0例,准确率为0%。患者病理T分期与MRI T分期一致性κ值为0.270。见表1。
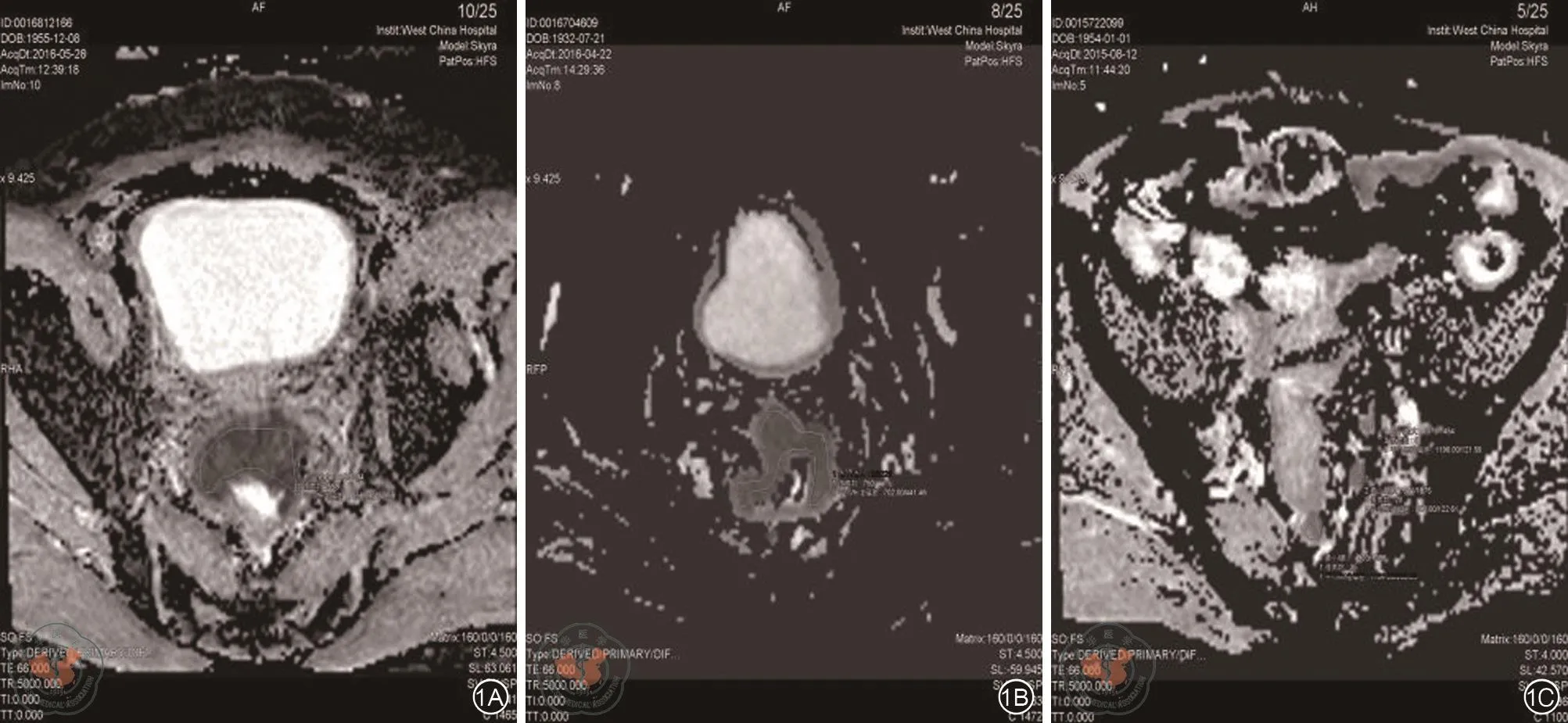
图1 为ADC图。1A:男,60岁,肿瘤位于直肠上段,病理分期:pT3,病灶ADC值:1 056.00±457.59;1B:男,83岁,肿瘤位于直肠中上段,病理分期:pT3,ADC值702.00±441.46;1C:男,61岁,图中所示结节:编号1、位于乙状结肠系膜区,直径8 mm,ADC值1 194.00±235.28;编号2、位于乙状结肠系膜区,直径5 mm,ADC值902.00±122.61;编号3、位于乙状结肠系膜区,直径5 mm,ADC值1 196.00±121.59,病理分期:pN1c
三、ADC值与病理T、N分期及肿瘤分化程度相关性
直肠肿瘤ADC值在未行新辅助治疗组(F=0.074,P=0.929)和行新辅助治疗组(F=0.737,P=0.496)中均与病理T分期无显著相关性。见表2。与肿瘤分化程度也无显著相关性(未行新辅助治疗组:F=0.076,P=0.783;新辅助治疗组:F=4.385,P=0.627)。见表3。在未行新辅助治疗的患者中,淋巴结ADC值在术后病理淋巴结阳性组高于淋巴结阴性组(F=0.073,P=0.012),而在新辅助治疗组无统计学差异(F=0.035,P=0.793)。见表3和图2。
讨 论
本研究结果显示,在未行新辅助治疗组中,MRI的T分期准确性从病理分期T1、T2到T3呈逐渐升高趋势,依次为0、38.1%和72%。其中,MRI对病理分期T1的4例评估均偏高(3例T2,1例T3),而对于病理分期T2的18例也有10例评估偏高(3例T3,7例T4),对于T3的准确率高达72%。MRI对病理分期T4的7例评估偏低(5例T3,1例T2)。Kappa一致性分析显示一致性差。该结果提示,对于未行新辅助治疗的直肠癌,MRI对于T1~T2的早期肿瘤趋于高估T分期而对于T4趋于低估的可能性,对于T3分期最准确,但总体与病理T分期的一致性差。
本研究结果显示,无论术前是否行新辅助治疗,肿瘤ADC值与T分期无显著相关性。磁共振DWI通过观察活体组织水分子扩散运动进行功能成像,常使用ADC值定量反映组织中水分子的扩散特性[7]。由于ADC值不仅受到细胞内外水成分比例改变和细胞外水分扩散路径影响,而且受到ROI、温度及b值选取的影响,目前报道不一,且目前多选用1.5 T,盆腔MRI进行扫描,扫描准确性相对较低[8]。本研究采用3.0 T高分辨薄层直肠MRI进行研究,以期获得高质量影像学治疗,提高直肠癌检查准确性。对于直肠癌ADC值与术后病理T分期的相关性,目前文献报道不尽相同。Akashi等[9]报道肿瘤ADC值与不同CEA水平、T分期、N分期、淋巴血管侵犯,以及局部复发均无统计学关系。陆志华等[10]研究显示,肿瘤ADC值与T分期有统计学意义。但目前大部分文献报道肿瘤ADC值与T分期的相关性不大。DWI提供的量化指标ADC值通过反应组织内水分子扩散运动来定量分析出肿瘤组织,肿瘤生长较快,组织内密度较大,细胞大小差异越大,水分子的扩散越受限,ADC值就越能定量反映组织内水分子的扩散运动,如肿瘤恶性程度越高,组织内细胞密度更大,细胞大小差异越大,水分子的扩散越受限,ADC值就越低,而与肿瘤组织侵犯深度目前认为相关性不大[7]。
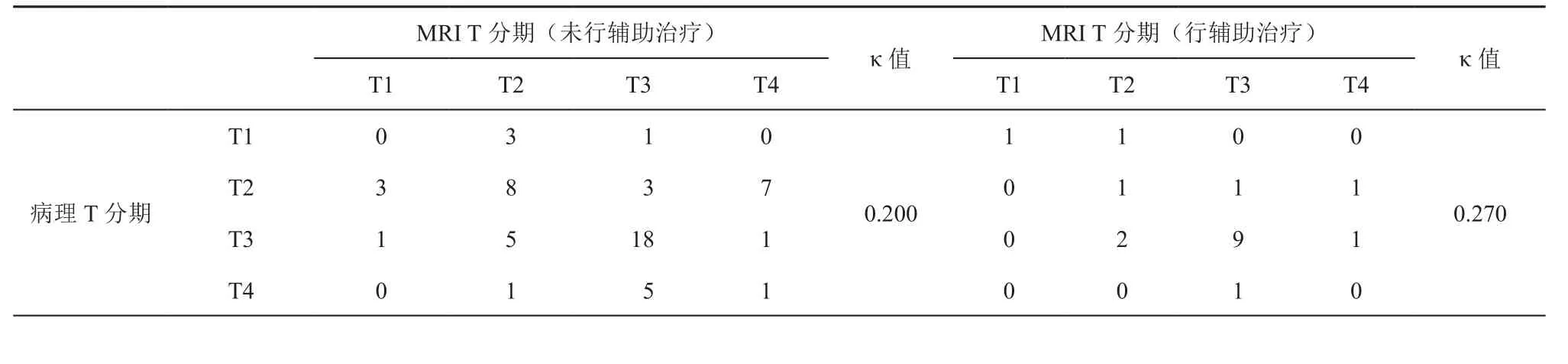
表1 MRI T分期与病理T分期比较

表2 ADC值与T分期关系
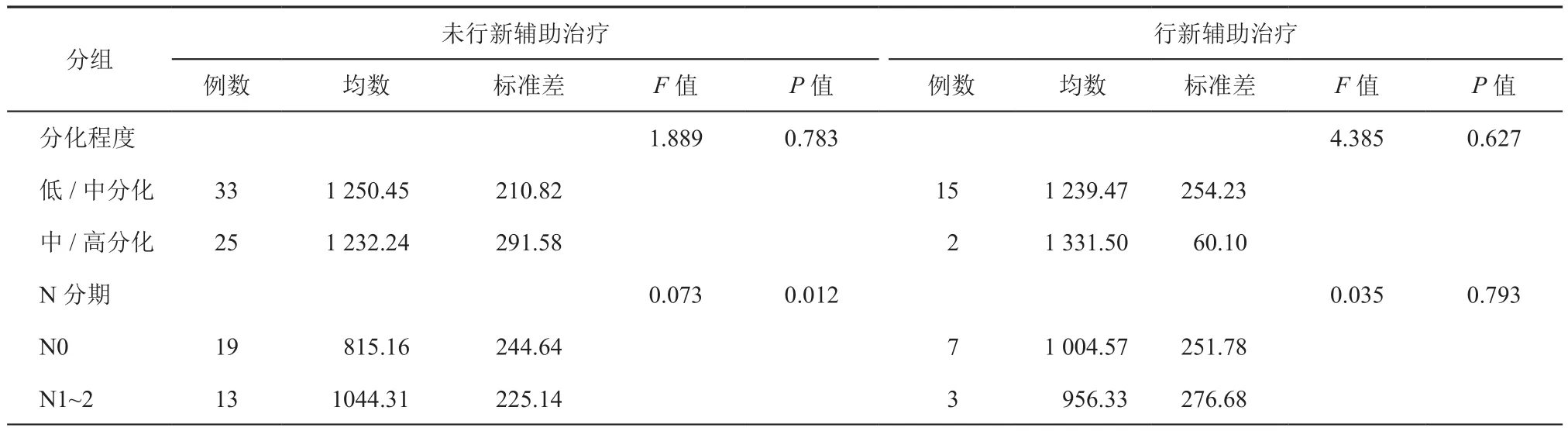
表3 ADC值与直肠癌分化程度和N分期关系
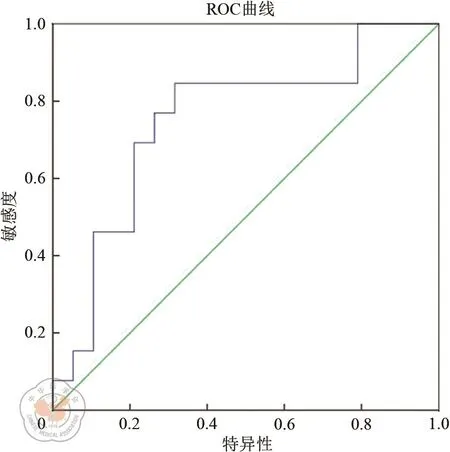
图2 ADC值鉴别直肠癌有无淋巴结转移的ROC曲线
对于ADC值与肿瘤分化程度的相关性,现有文献大多显示分化较差的肿瘤组织ADC值较分化程度较好的肿瘤明显更低。Cho等[11]报道,肿瘤转移淋巴结ADC值(0.9±0.15×10-3mm2/s)较无转移淋巴结(1.1±0.22×10-3mm2/s)明显更低,以1.0×10-3作为最佳阈值,准确性为72%,敏感性78%,特异性67%。但仍有研究实现ADC值与直肠癌分化程度无统计学差异,陈应明等[12]报道不同分化程度直肠腺癌间ADC值差异无统计学意义,而陈长春等[13]研究认为高、中、低分化直肠腺癌的平均ADC值不同。我们研究发现低-中分化和中-高分化两组患者ADC值差异无统计学意义。理论认为,肿瘤的分化程度可以反映肿瘤良恶性,分化程度越低的肿瘤恶性程度越高,细胞异形性越明显,核浆比增大,细胞排列紧密,造成组织中细胞内、外水分子扩散均受限,ADC值相应降低。造成这种差异原因我们认为如下:(1)现有报道多为回顾性,小样本研究,可能存在统计上误差;(2)肿瘤恶性程度不仅受分化程度影像,同时也受到肿瘤细胞学形态和肿瘤分期等的影像,可能造成一定影像;(3)对于肿瘤分化程度判定可能存在一定重叠;(4)ADC值不仅受到水分子扩散影像,同时也受到肿瘤微环境影像,肿瘤细胞坏死,富血管化,囊变和纤维化等都会影像水分子扩散,进而影像肿瘤ADC值。
本文按照术前是否行辅助治疗,将患者分为两组进行统计学分析,按照将术后病理结果有无淋巴结转移分为两组,术前行辅助治疗未行辅助治疗患者淋巴结ADC值明显高于无转移组。而术前行辅助治疗两组患者差异无统计学意义。马二奎等[14]研究结果显示ADC值与淋巴结转移差异存在统计学意义,转移性淋巴结与非转移性淋巴结的ADC值分别为0.79±0.12×10-3mm2/s和0.98±0.23×10-3mm2/s(P < 0.01)。Akashi等[9]按照有无淋巴转移进行分组发现,无淋巴结转移组ADC值(0.876±0.108×10-3mm2/s,M±SD)与有淋巴结转移组ADC值(0.903±0.094×10-3mm2/s,M±SD)间差异无统计学意义。术前放化疗对于肿瘤会导致肿瘤成分改变,出现坏死,纤维化等,这对于影像学判断会存在一定影响。我们研究并未将选取测量ADC值的淋巴结/癌结节与术后病理一一对应,可能造成ADC值判断不稳定。所以仍需要大样本、前瞻性、高质量的报道证实。
本研究为回顾性研究,由于样本量分布不均,并未排除细胞学形态对肿瘤ADC值影响;按照术前有无淋巴结进行分组,虽然排除放化疗对于影像学影响,但同时相对缩小样本量,可能会增加统计学上误差;同一患者术后病理检查可能存在多个转移淋巴结,本文未将选取测量ADC值的淋巴结/癌结节与术后病理一一对应。
基于本组资料研究,认为3.0 T高分辨直肠MRI对于术前T分期准确性较差,在诊断T3期准确性相对较高;ADC值对于未行放化疗患者是否存在淋巴结转移的判断有价值,对于行辅助治疗患者判断差异无统计学意义;对于无论术前是否行辅助治疗的患者,不同T分期、不同分化程度间ADC值差异无统计学意义。

